基于Nrf2/HO-1通路介导的及己根和雷公藤水提取物诱导的大鼠肺毒性比较研究
孙淑萍,任秀海,吴成华 ,张小平,董婷玉,锁孝国
雷公藤(Tripterygium wilfordiiHook.f.)系卫矛科雷公藤属木质藤本植物雷公藤的根.雷公藤作为一种常用中药,味苦有大毒,具有清热解毒、活血化瘀、消肿散结等功效,并具有抗炎、免疫调节及抗肿瘤等多种活性,被广泛用于治疗肾小球肾炎、类风湿关节炎或者红斑狼疮等自身免疫性疾病.但在使用过程中,所引起的毒性反应事件频繁报道,成为近半个世纪以来发生中毒事件最多的中草药之一[1],因此,有必要进一步寻找抗炎活性好、毒性小的替代中药.
及己(Chloranthus serratusRoem.et Schalt)为金粟兰科金粟兰属植物,以根或全草入药,具有消肿解毒、祛风止痛、舒筋活络等功效,常用于治疗风湿腰腿痛、跌打损伤、毒蛇咬伤、疔疮肿毒等[2].前期研究证实及己有确切的抗炎活性[3],但本品有毒,过量服用后会引起心外膜下出血、肺出血及水肿等.
现有关雷公藤、及己对肺组织损伤的文献报道较少,大多为临床报道.关于雷公藤与及己根水提取物对大鼠肺毒性比较及其毒性机制的研究尚未见报道.为此,通过检测肺组织匀浆中MDA、T-SOD、GSH和CAT水平;HE染色法观察肺组织病理变化;Western-blot法检测肺组织中Nrf2、HO-1蛋白表达情况;免疫组化法检测ICAM-1阳性表达情况来比较雷公藤与及己根水提取物对大鼠肺毒性大小,并初步探明其毒性机制,为民间和临床用药提供安全性指导,为法医鉴定提供参考,为把及己开发成较好的抗炎药打下基础,现报道如下.
1 材料与仪器
1.1 实验动物
清洁级SD雄性大鼠,购自山东省实验动物中心,批准文号:SCXK(鲁)2014-0007,体重200±10g.动物先适应性饲养1周,饲养温度为23±2℃,湿度为50%~60%,饮用水为自来水.
1.2 药材
雷公藤购自亳州药材市场,及己采于安徽黄山,经皖南医学院朱建华教授鉴定均为真品.
1.3 药品与试剂
总超氧化物歧化酶(T-SOD)试剂盒、丙二醛(MDA)试剂盒、BCA法蛋白测定试剂盒(南京建成生物工程研究所);细胞间黏附分子-1(ICAM-1)兔多抗、Mouse Anti-β-Actin、Goat Anti-Mouse IgG、Rabbit Anti-HO-1、核因子E2相关因子2(Nrf2)一抗、Goat Anti-Rabbit IgG、免疫组化三步法试剂盒、增强型RIPA裂解液、PMSF(博士德生物工程有限公司);硝酸纤维素(NC)膜(PallCorporation);彩色预染蛋白marker(Thermo);BeyoECLplus化学发光试剂盒等.
1.4 主要仪器
常规轮转石蜡切片机(浙江省金华市益迪医疗设备厂);EYELAN-1100旋转蒸发仪(上海爱朗仪器有限公司);高速冷冻离心机(安徽嘉文仪器装备有限公司);Thermo Scientific Multiskan FC酶标仪(北京昊诺斯科技有限公司);YD-AB型生物组织摊烤片机(浙江省金华市益迪医疗设备厂);YD-6D智能型生物组织包埋机(浙江省金华市益迪医疗设备厂);CKX31OLYMPUS显微镜(昆山诺普森实验室用品科技有限公司);AmershamImager600自动曝光仪(GE Healthcare Japan Corporation);Biorad电泳仪(伯乐生命医学产品有限公司)等.
2 实验方法
2.1 雷公藤水提取物与及己根水提取物的的制备
将雷公藤、及己根粉碎成粗粉,分别按以下方法提取:称取500g粗粉,用水回流提取,第1次加12倍量水,浸泡0.5h,提取1.5h,第2次加10倍量水,提取1h,第3次加8倍量水,提取1h,每次用布氏漏斗抽滤,合并滤液,减压浓缩,放45℃真空干燥箱干燥,粉碎过80目筛,得雷公藤水提取物和及己根水提取物.用水提取物重量/粗粉重量×100%,即得水提取物得率.
2.2 动物的分组与给药剂量的确定
将SD雄性大鼠24只随机等分为空白(KB)组、雷公藤水提取物(LS)组和及己根水提取物(GS)组,灌胃给药.
根据预实验结果设置100倍剂量毒性试验组.根据种属间等效剂量折算表[4]确定大鼠日给药量(水提取物质量,g/kg)为成人的临床用药剂量(3g)×0.018×100×药材提取率(LS提取率为13.8%,GS提取率为14.2%)×5,即LS 3.73g/kg/天,GS 3.83g/kg/天.水提取物用蒸馏水配成溶液,每日灌胃给药1次,连续14天,第15天处死.KB组给予相同量蒸馏水,给药体积为2mL/200g体重/天.给药期间每日观察并记录大鼠活动、精神状态、进食饮水、大小便等一般情况及出现的毒性症状和体征等.大鼠于给药第1、3、5、7、9、11、13、15天分别称体重,并计算体重变化率.体重变化率(%)=(后面天数的体重-第1天体重)/第1天体重×100%.以纵坐标为体重变化百分率,横坐标为天数作图,可得体重变化率曲线图.
2.3 取材
麻醉大鼠,摘除眼球取血,断头处死,进行大体解剖,摘取两肺.用生理盐水洗净表面血液后,用滤纸吸干,称重并计算脏器系数.脏器系数=脏器湿重(g)/动物体重(g)×100%.
2.4 肺组织中氧化指标MDA、T-SOD、GSH和CAT含量的测定
肺组织在低温条件下,按肺质量(g):生理盐水(mL)=1∶9,常规方法制作肺组织匀浆,4℃条件下,以2500r/min离心20min,取上清液,严格按照试剂盒说明书要求测MDA、T-SOD、GSH和CAT含量.
2.5 HE染色的肺组织病理学检查
大鼠肺组织经10%甲醛固定,乙醇逐级脱水,石蜡包埋,按3μm厚度切片,捞片,烤片,脱蜡,复水,苏木精-伊红(HE)染色,脱水,透明,封片,进行光镜观察每张切片.
2.6 免疫组化法检测ICAM-1阳性表达情况
对2.5项制备的蜡块进行常规石蜡切片,捞片,烤片,脱蜡复水,磷酸盐缓冲液(PBS)漂洗,灭活内源性过氧化物酶,抗原热修复,正常羊血清封闭,在切片上滴加ICAM-1一抗,4℃孵育过夜,PBS漂洗后滴加二抗(1∶200),37℃孵育1h.PBS漂洗后,滴加SABC试剂,37℃恒温孵育1h,PBS漂洗后,DAB显色,苏木精复染,盐酸酒精分化,氨水返蓝,脱水,透明,封片,显微镜下观察、拍照.用ImageJ软件统计阳性表达百分率,多次统计取平均值.
2.7 Western-blot法检测Nrf2/HO-1的蛋白水平
肺组织适量,置于1.5mL离心管中,加入10倍体积的裂解液(RIPA∶PMSF=100∶1)于冰上匀浆30min.然后在4℃、12000rpm的条件下,离心20min.取上清液,用BCA蛋白定量试剂盒测定蛋白浓度后,加入5×上样缓冲液,煮沸变性10min.用SDS-聚丙烯酰胺凝胶(12%分离胶和5%浓缩胶)进行分离,使用NC膜,110V转膜70min,牛奶封闭2h,洗净,4℃一抗 Nrf2(1∶1000)/HO-1(1∶400)/β-actin(1∶400)孵育过夜,用TBST清洗,孵育二抗抗兔(1∶6000)/二抗抗鼠(1∶8000)1.5h,洗膜后滴加现配的ECL显影液曝光显影.用ImageJ软件计算灰度值并定量分析.
2.8 统计学分析
利用统计软件SPSS19.0处理系统进行配对t检验,文中数据采用均数±标准差表示(±s),以p>0.05为无统计学差异,p<0.05为显著性差异,p<0.01为极显著性差异,多组间比较用方差分析.
3 结果
3.1 各组大鼠一般情况比较
KB组大鼠食欲、活动均正常,皮毛有光泽.LS组皮毛明显黯淡无光,活动减少,食欲下降,精神萎靡,有掉毛现象,在饲养过程中出现中毒死亡现象,可见角弓反张、嘴角出血和四肢抽搐等现象.GS组大鼠和KB组相比差异较小.初步说明LS组毒性大于GS组.
3.2 雷公藤与及己根水提取物对各组大鼠体重变化的影响
与KB组相比,LS组、GS组的大鼠体重变化率均较低,且LS组大鼠体重下降趋势更明显,说明LS组毒性显著.且在第13天时,与KB组相比,LS组体重变化率有显著性差异(p<0.05),经分析可得,LS组毒性大于GS组,见图1.
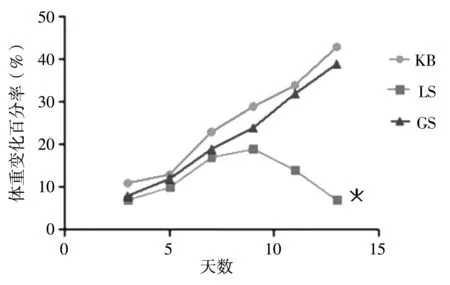
图1 各组大鼠体重变化率曲线
3.3 雷公藤与及己根水提取物对大鼠肺系数的影响
与KB组相比,LS组肺系数显著增大(p<0.05),GS组肺系数略微升高(p>0.05),说明LS组、GS组均有肺毒性,且LS组毒性大于GS组,见图2.
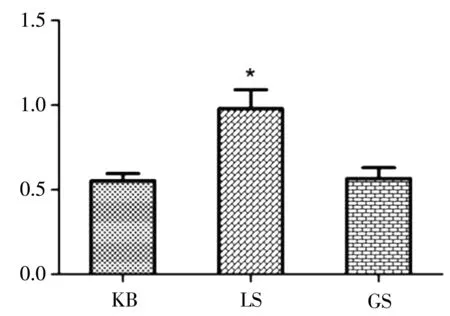
图2 大鼠给药后肺系数
3.4 雷公藤与及己根水提取物对大鼠肺组织中MDA、CAT、T-SOD、GSH含量的影响
与KB组相比,LS组MDA含量极显著性增高(p<0.01),CAT、T-SOD、GSH水平均显著性降低(p<0.01或p<0.05),GS组MDA、CAT、T-SOD和GSH含量均无显著性差异(p>0.05),由此可见,LS组肺毒性大于GS组,见表1.
3.5 雷公藤与及己根水提取物对大鼠组织形态的影响
(1)各组大鼠肺组织肉眼观察.KB组大鼠肺表面光滑,无出血现象.而LS组、GS组都有一定程度的出血情况.LS组有深色片状淤血.初步观察可知,毒性大小为LS组大于GS组,见图3.
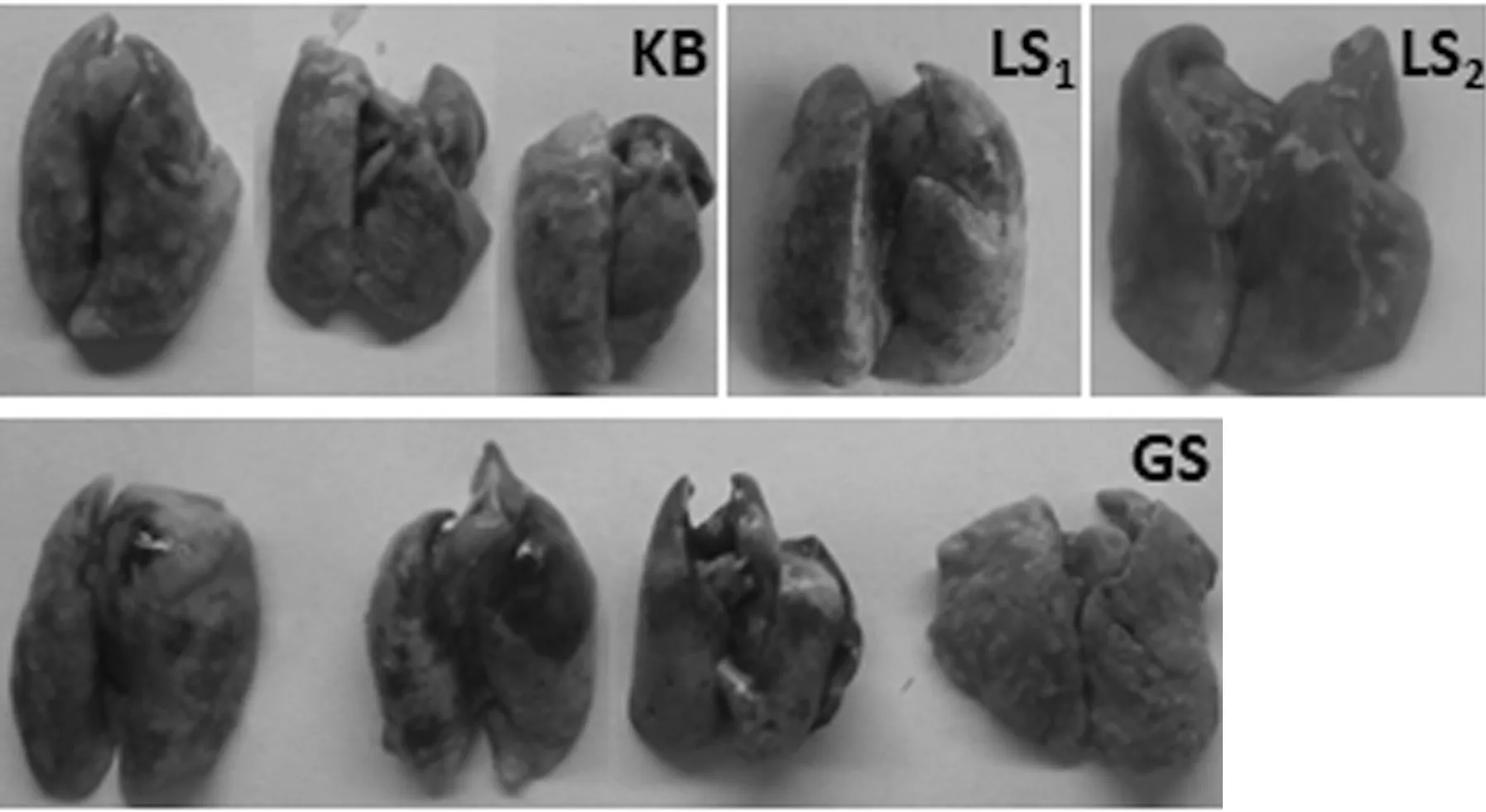
图3 各组大鼠肺大体形态
(2)各组大鼠肺组织切片镜下观察.镜下见KB组局部肺泡间隔轻微增厚,有少量炎症细胞浸润,肺泡腔内未见渗出物,肺泡腔无病理性扩大,肺泡间质血管未见明显充血现象.LS组可见支气管呈锯齿状增生,支气管周围有大量以淋巴细胞为主的炎性浸润,肺泡间质内大量充血且肺泡间隔有不同程度增生,部分支气管腔内有大量红细胞,有的视野中肺组织实质化,可见大量炎症细胞、充血和淀粉样变性.GS组可见支气管周围有炎性细胞浸润,主要以淋巴细胞和中性粒细胞为主,肺泡间质内有少量充血并伴有肺泡间隔轻微增宽.由此可以得出,LS组、GS组均有肺毒性,且LS组大于GS组,见图4.
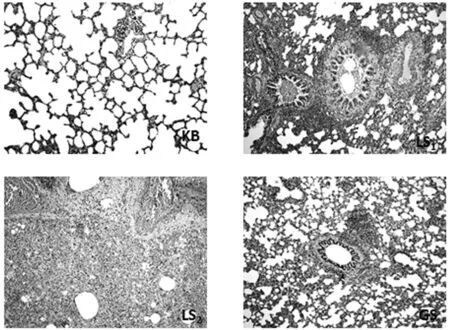
图4 给药后大鼠肺组织切片
3.6 雷公藤与及己根水提取物对各组大鼠肺组织中黏附因子ICAM-1阳性表达率的影响
ICAM-1主要在细胞膜及细胞浆表达,呈棕黄色颗粒.与KB组相比,LS组、GS组阳性表达率均升高,且LS组有显著阳性表达(p<0.05),而GS组无明显差异(p>0.05),见图5.故肺毒性大小为LS组大于GS组.
3.7 雷公藤与及己根水提取物对肺组织中Nrf2/HO-1蛋白表达的影响
与KB组相比,LS组、GS组肺组织中Nrf2、HO-1蛋白含量均降低,故LS组、GS组皆有肺毒性;且LS组极显著性降低(p<0.01),GS组无明显差异(p>0.05),故肺毒性大小为LS组大于GS组,如图6所示.
表1 各组SD大鼠肺匀浆指标的变化(±s,n=8)

表1 各组SD大鼠肺匀浆指标的变化(±s,n=8)
注:与KB组相比,**p<0.01,*p<0.05.
GSH(μmol/gprot)4.15±1.047 3.11±0.241*4.32±0.265组别KB LS GS MDA(nmol/mgprot)1.05±0.062 1.61±0.130**1.09±0.090 T-SOD(U/mgprot)98.31±2.967 84.19±4.572**95.52±3.730 CAT(U/mgprot)4.28±0.317 3.64±0.320**4.12±0.187

图5 各组大鼠肺组织中黏附因子ICAM-1的表达(×200倍)

图6 各组大鼠肺组织中Nrf2/HO-1的表达
4 讨论
雷公藤、及己根中毒后可引起多种脏器损伤,有研究表明其主要是通过产生的自由基参与氧化应激反应对机体发挥作用[5].氧化应激被认为是雷公藤、及己根在体内发挥毒性作用的重要机制.
CAT、SOD、GSH和MDA反映机体的氧化状态和抗氧化能力,四者均可以反映体内氧化应激水平[6].当体内抗氧化防御能力(CAT、SOD、GSH水平)不足以清除过量氧自由基时,机体处于氧化应激状态,从而导致组织和细胞产生一系列损伤[7].CAT、SOD、GSH是机体和细胞内抗氧化防御体系中重要的抗氧化酶,起到抗毒抗氧化的作用[8].MDA是脂质过氧化的重要产物之一,测定MDA含量常可反映机体内脂质过氧化的程度,也是反映组织细胞受自由基攻击受损严重程度的重要指标[5].因此,检测此四个指标的含量可以有效反映机体受损伤程度.本研究表明,LS组、GS组CAT、T-SOD、GSH含量均下降且LS组下降幅度大于GS组;LS组、GS组MDA含量均上升且LS组上升幅度大于GS组,说明LS组肺毒性较大,提示氧化-抗氧化失衡,可能受到氧自由基的攻击,使肺清除氧自由基的能力减弱,并可能引起肺组织损伤.
肉眼观察肺组织病理学形态的改变与HE染色结果一致.LS组支气管周围有大量以淋巴细胞为主的炎性细胞浸润,肺泡间质内大量充血,部分支气管腔内有大量红细胞,有的视野肺组织实质化;GS组支气管周围有炎性细胞浸润,肺泡间质间偶见充血和增生等现象.可见LS组、GS组对大鼠肺均有毒性,且LS组造成的肺组织损伤大于GS组.
ICAM-1在促进炎症部位的黏连性方面起到重要作用.在受到炎症因子刺激后,炎症细胞与内皮细胞间的黏附作用增强,阳性表达增强[9].本实验结果显示,与KB组相比,LS组、GS组肺组织ICAM-1阳性表达均增强,且LS组阳性表达增强更显著.
在ROS刺激下机体还能通过激活一些特异性的转录因子对细胞进行保护,如Nrf2.Nrf2/HO-1途径是调节机体抗氧化应激反应的重要信号通路[10].生理条件下,细胞中Nrf2与Keap1结合在一起,从而阻滞了Nrf2的活性;而在氧化应激条件下,Nrf2与Keap1复合物解体,Nrf2由细胞质进入细胞核,从而启动ARE调控第II相酶及抗氧化酶的基因进行表达,增强细胞对氧化应激反应的抗性.而ARE调控的抗氧化蛋白包括HO-1等,可进一步被激活,从而促使失衡的氧化还原反应恢复到平衡状态,减轻自由基对脏器的损伤.同时,HO-1是一种保护蛋白,有很强的自由基清除能力,其活性直接影响到抗氧化损伤能力的变化[11].HO-1及其酶解产物胆红素、CO共同发挥着抗炎、抗氧化、抑制细胞凋亡等作用.因此,Nrf2、HO-1蛋白表达可以反应机体受损伤程度.实验结果显示,与KB组相比,LS组、GS组肺组织中Nrf2、HO-1蛋白表达均降低,LS组Nrf2、HO-1蛋白表达极显著性降低,GS组蛋白表达无显著性差异.故可以看出,LS组肺毒性大于GS组.
综上所述,多项指标均能得出LS组、GS组均具有肺毒性,且LS组肺毒性大于GS组,其毒性机制可能与氧化应激及Nrf2/HO-1通路有关.因此,本实验可为今后科研人员研究雷公藤和及己根对肺组织毒性提供理论依据,对临床安全合理用药有一定的指导作用,为把及己根开发成较好的抗炎药打下基础.

