高糖通过Nox4型NADPH氧化酶影响施旺细胞凋亡的机制研究*
于 婷,辛 青,许 飞,李 雷
(1.济宁医学院基础医学院生理学教研室,山东 济宁 272067;2.济宁市第一人民医院血管外科,山东 济宁 272011;3.济宁医学院附属医院神经内四科,山东 济宁 272029)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,缺乏有效的治疗措施,显著降低患者的生活质量,增加社会经济负担。施旺细胞作为周围神经系统中的神经胶质细胞,为轴突提供支持,并且形成髓鞘,其活性及分泌的物质对维持神经纤维的存活、生长及再生具有重要意义。研究证实DNP患者及动物模型均出现不同程度的施旺细胞凋亡及功能下降,引起周围神经系统的节段性脱髓鞘和髓鞘再生等病理改变[1]。长期处于高糖环境下的施旺细胞,通过增加细胞内活性氧自由基(reactive oxygen species,ROS),加强氧化应激,降低细胞活性,启动细胞凋亡[2]。NADPH氧化酶(NADPH oxidase,Nox)是细胞内生成ROS的主要酶体[3],在不同种类的细胞中发现了一系列Nox的同源物,包括Nox1-5,Duox1和Duox2。其中Nox4由于分布广泛,表达量高,是NADPH氧化酶家族中可以产生过氧化氢的唯一亚型,因此对细胞内ROS含量发挥决定性作用[4]。本实验拟采用高糖培养的施旺细胞,研究高糖对于Nox4表达的调控作用,通过下调Nox4基因表达,研究Nox4是否通过氧化应激途径参与高糖引起的施旺细胞凋亡,进而探求DPN新的治疗途径。
1 材料与方法
1.1 材料
兔抗Nox4单克隆抗体(Abcam,美国);兔抗天冬氨酸特异性半胱氨酸蛋白酶-3(cysteinylaspartate specific proteinase 3,Caspase 3)多克隆抗体(Abcam,美国);小鼠抗β-actin单克隆抗体(北京中杉金桥生物技术有限公司);小鼠抗S-100单克隆抗体(Abcam,美国);HRP标记羊抗小鼠IgG(北京中杉金桥生物技术有限公司);HRP标记羊抗兔IgG(北京中杉金桥生物技术有限公司);FITC标记羊抗小鼠IgG(Abcam,美国);含DAPI抗荧光淬灭封片剂(Santa Cruz,美国);BCA蛋白浓度检测试剂盒(上海碧云天生物技术有限公司);ECL试剂盒(Millipore,美国);NC膜(Millipore,美国);RNA提取试剂盒(北京天根生化科技有限公司);cDNA合成试剂盒(北京天根生化科技有限公司);SYBR Green 荧光实时定量PCR试剂盒(Thermo Scientific Molecular Biology,美国);DMEM/F-12细胞培养液(Gibco,美国);胎牛血清(Invitrogen,美国);胰蛋白酶(Sigma,美国);IA型胶原酶(Invitrogen,美国);WST-1细胞增殖检测试剂盒(上海碧云天生物技术有限公司);2',7'-二氯荧光素二乙酸酯(Sigma,美国);对照 siRNA(序列:5'-CTGCCGCATGGAGAATCCAGT-3'F,5'-GCATCAATGGTGCAAGAATCG-3'R,广州锐博生物科技有限公司);Nox4 siRNA(序列:5'-GACACAAACCTGTCACCTACA-3'F,5'-GCTCTTACCTACGACATAAGA-3'R,广州锐博生物科技有限公司);Nox4引物(上海生工);Caspase 3引物(上海生工)。
1.2 细胞培养及分组
无菌条件下取出生4 d的Wistar大鼠新生鼠双侧坐骨神经,用眼科剪剪碎,置于含0.25%胰蛋白酶和0.5%IA型胶原酶的D-Hanks溶液中37℃孵育40 min消化为分散细胞。分离的细胞重悬在含10%胎牛血清的DMEM/F-12培养液中,以0.5×105个细胞/孔的密度接种在96孔细胞培养板上,以1.5×105个细胞/孔的密度接种在24孔细胞培养板上。在37℃,5%CO2的条件下培养24 h后更换培养液并分组按照以下条件培养24 h:对照组(control组)培养于含10%胎牛血清的DMEM/F-12培养液中;高糖组(high glucose组)培养于葡萄糖浓度为30 mmol/L的含10%胎牛血清的DMEM/F-12培养液中;Nox4 siRNA组培养于葡萄糖浓度为30 mmol/L的含10%胎牛血清的DMEM/F-12培养液中,按照说明添加转染试剂及Nox4 siRNA;对照siRNA组(control siRNA组)培养于葡萄糖浓度为30 mmol/L的含10%胎牛血清的DMEM/F-12培养液中,按照说明添加转染试剂及对照siRNA。
1.3 细胞纯度检测
按照1.2细胞取材方法得到分散的施旺细胞,以1.5×105个细胞/孔的密度接种在24孔细胞培养板上,培养板底部铺设多聚赖氨酸预先包被的玻片。用含10%胎牛血清的DMEM/F-12培养液培养,每24 h更换培养液,共培养48 h。培养结束后,用 0.01 mmol/L PBS缓冲液冲洗玻片,去掉残余的培养液。用4%多聚甲醛溶液固定玻片上的细胞40 min后,3% Triton X-100溶液浸泡玻片1 h使细胞膜穿孔。室温下用10%山羊血清封闭1 h,S-100一抗(1∶1 000)4℃孵育10 h。充分洗涤一抗后加入FITC标记羊抗小鼠IgG(1∶200),室温避光孵育1 h。充分洗涤二抗后用含DAPI抗荧光淬灭封片剂封片。以530 nm波长的光波激发FITC探针的荧光信号,以460 nm波长的光波激发DAPI探针的荧光信号,曝光时间设定为150 ms,用荧光显微镜记录信号,计数同一视野中染成绿色和蓝色的细胞个数。
1.4 细胞活力检测
应用WST-1细胞增殖检测试剂盒检测四种培养条件下的细胞活力。将电子介质溶液与WST-1显影剂按照1∶1的比例混匀。新鲜配制的WST-1混合溶液按照每孔10 μl的体积加入培养于96孔培养板的细胞中,震荡混匀。在37℃,5%CO2的条件下孵育4 h后震荡混匀,应用超微量分光光度计检测各孔溶液对450 nm波长光波的吸光度。以吸光度表示各组细胞的活力值。
1.5 细胞内ROS检测
细胞内ROS采用具有细胞膜穿透性的氧化敏感性荧光探针2',7'-二氯荧光素二乙酸酯(DCFH-DA)检测。DCFH-DA可以自由扩散进入细胞并被切割转化成2',7'-二氯二氢荧光素(DCFH)酯酶。在ROS的存在下,DCFH更进一步氧化形成荧光化合物2',7'-二氯荧光素(DCF),可以用来确定细胞内ROS的相对水平。培养结束后向培养于24孔培养板的细胞中加入DCFH-DA,使其终浓度为10 μmol/L。在37℃,5%CO2的条件下孵育20 min后,除去培养基,用PBS洗涤细胞3次以除去未结合的探针。以485nm波长的光波激发探针的荧光信号,曝光时间设定为150 ms,用荧光显微镜记录信号。应用Image-Pro Plus 5.1软件分析计算荧光显微照片中胶质细胞内的光密度值。
1.6 Nox4和Caspase3 mRNA表达量检测
培养结束后Trizol法分组提取细胞全部RNA,逆转录为cDNA,采用SYBR Green荧光实时定量PCR试剂盒检测Nox4、Caspase 3及β-actin的mRNA表达量。引物序列为:Nox4 5'-CCAGAATGAGGATCCCAGAA-3'(F),5'-AGCAGCAGCAGCATGTAGAA-3'(R);Caspase 3 5'-ATGCTTACTCTACCGCACCCG-3'(F),5'-GGTTAACACGAGTGAGGATGTGC-3'(R);β-actin 5'-CAC CCGCGAGTACAACCTTC-3'(F),5'-CCCATACCCACCATCACACC-3'(R)。反应条件为:预变性:95℃,10 min;变性:95℃,15 s;退火:Nox4(60℃),Caspase 3(56℃),β-actin(58℃),30 s;延伸:72℃,30 s;终止延伸:72℃,5 min;循环40次。得到各基因的Ct值后以β-actin作为内参,采用△Ct值表示Nox4和Caspase 3 mRNA相对表达量。
1.7 Nox4和Caspase3 蛋白表达量检测
培养结束后分组提取细胞的全部蛋白,应用BCA蛋白浓度检测试剂盒测定蛋白浓度,用蛋白裂解液调整蛋白浓度为5 μg/μl,加入蛋白上样缓冲液混匀。凝胶电泳上样量20 μl/well,10%的分离胶电泳2 h后将蛋白转移至NC膜,5% BSA室温下封闭2 h。Nox4一抗(1∶500),Caspase 3一抗(1∶ 1 000),β-actin一抗(1∶2 000)4℃孵育10 h。充分洗涤一抗后加入相应二抗,室温孵育2 h。充分洗涤二抗后加入ECL化学发光液暗室孵育2 min后用凝胶成像与分析系统曝光并拍照,分析蛋白条带的光密度值并以β-actin作为内参计算Nox4和Caspase3蛋白相对表达量。
1.8 统计学处理
2 结果
2.1 细胞纯度
S-100是广泛采用的施旺细胞特异性标记蛋白,通过免疫荧光染色,可以使表达S-100蛋白的施旺细胞发出绿色荧光。DAPI荧光染料与细胞核内的双链DNA结合后发出蓝色荧光,可以使全部有核细胞的细胞核显色。通过S-100阳性细胞计数与DAPI阳性细胞计数的比例,即可得到培养终止时的施旺细胞纯度。计算3次培养过程中每次5个样本的施旺细胞比例,得到细胞纯度为(97.3±2.8)%(图1)。

Fig.1Double fluorescence labeling of S-100 and DAPI(×400)
A:S-100-labeled SCs;B:DAPI-labeled nuclei of all cells in culture;C:Overlay of A and B,the arrow shows an S-100 negative fibroblast
2.2 Nox4 siRNA对施旺细胞活性的影响
活细胞内含有的脱氢酶可以将WST-1稳定的四唑盐还原为水溶性橙色甲臜染料。WST-1混合溶液的吸光度反映了不同培养条件下的活细胞数量。高糖培养降低了施旺细胞活性或者有活力的施旺细胞数量,Nox4 siRNA对高糖导致的施旺细胞活性下降具有一定的保护作用,而对照siRNA则不具备保护效果(表1)。
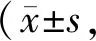
Tab. 1 Changes of cell vialibility and intracellular ROS levels n=10)
*P<0.05vscontrol group;#P<0.05vshigh glucose group
2.3 Nox4 siRNA对施旺细胞内ROS的影响
细胞内的ROS含量用荧光信号的密度值来显示(图2)。高糖培养使施旺细胞内ROS含量明显升高,Nox4 siRNA组细胞内ROS含量低于高糖组,高于正常对照组,对照siRNA组细胞内ROS含量与高糖组没有明显差异,高于正常对照组(表1)。
2.4 NOX4 siRNA对施旺细胞Nox4和Caspase3 mRNA表达的影响
△Ct值与Nox4和Caspase3 mRNA的相对表达量成反比关系,因此相较于正常对照组,高糖组施旺细胞Nox4和Caspase3 mRNA表达量均明显升高。Nox4 siRNA明显降低了高糖培养的施旺细胞Nox4和Caspase3 mRNA表达量,而对照siRNA对高糖培养的施旺细胞Nox4和Caspase3 mRNA表达量没有明显影响(表2)。

Fig.2Intracellular ROS levels of SCs in each group(×400)
A:Control group;B:High glucose group;C:Nox4 siRNA group;D:Control siRNA group
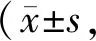
Tab. 2 Expression levels of Nox4 and Caspase 3 mRNA n=10)
*P<0.05vscontrol group;#P<0.05vshigh glucose group
2.5 NOX4 siRNA对施旺细胞Nox4和Caspase3 蛋白表达的影响
蛋白免疫印迹结果显示:高糖培养使施旺细胞 Nox4和Caspase3 蛋白表达量明显升高,Nox4 siRNA组Nox4和Caspase3 蛋白表达量低于高糖组,高于正常对照组,对照siRNA组Nox4和Caspase3 蛋白表达量与高糖组没有明显差异,高于正常对照组。四组细胞的Nox4和Caspase3 蛋白表达量具有与Nox4和Caspase3 mRNA表达一致的改变(图3,表3)。

Fig.3Immunoblotting bands of Nox4 and Caspase 3 protein
A:Control group;B:High glucose group;C:Nox4 siRNA group;D:Control siRNA group
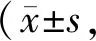
Tab. 3 Expression levels of Nox4 and Caspase 3 protein n=10)
*P<0.05vscontrol group;#P<0.05vshigh glucose group
3 讨论
周围神经病是由创伤或疾病引起的外周感觉神经和自主神经损伤,最常见的病因是糖尿病,高达50%的糖尿病患者有周围神经病变的临床表现[5]。糖尿病周围神经病变可引起周围神经系统结构和功能进行性恶化,导致自发性疼痛并最终丧失感觉功能,另外还可能出现运动无力和器官功能障碍。尽管高血糖对神经功能的影响是研究的热点,但是糖尿病性神经病变的生物学机制仍未阐明,除了严格控制血糖外,缺乏有针对性的治疗措施[6]。施旺细胞将外周神经的轴突或长树突包裹形成有髓或无髓神经纤维,不仅是神经纤维的绝缘体,而且为神经元提供营养支持,在损伤时参与神经纤维的修复与再生。DPN的病理改变包括:最初轻度节段性轴索脱髓鞘,随后髓鞘再生,最终出现轴索退化[7]。表明施旺细胞病变启动了神经纤维损伤,也是DPN发病机制的关键步骤。
尽管高糖在DPN的发生发展过程中占据首要地位,但是具体机制仍未阐明。高糖可以通过以下几条通路引起机体损伤:多元醇途径的代谢产物增加,启动氧化应激;糖酵解途径的中间产物己糖胺蓄积,通过蛋白激酶C导致多种代谢障碍;蛋白质及核酸非酶促糖基化增加,引起蛋白质及核酸功能失常[1]。然而,不同的信号通路都可以通过促进ROS的产生,进而启动氧化应激,促进细胞凋亡,这是目前公认的导致糖尿病并发症的核心机制[8]。高糖主要通过NADPH氧化酶生成ROS,其中Nox4型NADPH氧化酶对细胞内ROS含量发挥决定性作用。研究显示在高糖情况下Nox4过表达,通过促使肾小球系膜细胞[9]、肾间质成纤维细胞[10]、人主动脉内皮细胞[11]以及人脐静脉内皮细胞[12]内ROS堆积,加强氧化应激。Nox4/ROS进而通过Notch信号通路[13]、Bax及caspase3信号通路[14]诱导细胞凋亡,参与糖尿病慢性并发症的发病过程。而基因靶向或药物抑制Nox4则对糖尿病肾病具有肾脏保护的作用[15]。然而,Nox4/ROS通路在DPN中的改变,是否可以作为治疗DPN的靶点,目前为止国内外均未见报道。
本实验采用高糖培养液体外培养Wistar大鼠新生鼠施旺细胞,研究高糖对于Nox4表达的调控作用。结果显示高糖组Nox4 mRNA及蛋白表达均高于正常对照组,证实在糖尿病状态下施旺细胞通过上调Nox4基因转录进而增加蛋白表达量。本实验的结果与高糖对肾小球系膜细胞、肾间质成纤维细胞、人主动脉内皮细胞以及人脐静脉内皮细胞Nox4表达的影响具有类似的趋势,提示糖尿病肾病、血管病变、周围神经病变在发病机制方面具有一定的相似性。在本实验中,高糖培养不仅上调施旺细胞Nox4表达,而且促进细胞内ROS蓄积,降低细胞活性,并且通过上调caspase3表达促进细胞凋亡。
为了进一步验证Nox4表达改变与施旺细胞内ROS含量以及施旺细胞凋亡的关系,本实验采用Nox4 siRNA下调Nox4基因转录,与对照siRNA进行对比。结果显示Nox4 siRNA使施旺细胞Nox4 mRNA及蛋白表达明显减少,不仅低于高糖组,而且低于正常对照组。对照 siRNA对于Nox4 mRNA及蛋白表达没有影响,排除了转染试剂对Nox4 mRNA及蛋白表达的作用。另外,Nox4 siRNA组施旺细胞内ROS含量低于高糖组,但是高于正常对照组,提示尽管Nox4是生成ROS的重要途径,但仍有其他途径参与高糖导致的ROS蓄积,下调Nox4的表达只能部分降低ROS的含量。Nox4 siRNA对高糖导致的施旺细胞活性下降具有一定的保护作用,可能是由于减轻了细胞的氧化应激,但具体机制仍需进一步研究。caspase3作为caspase级联反应中最下游的细胞凋亡执行蛋白,其表达量直接调控细胞的凋亡程度[14]。本实验中Nox4 siRNA下调施旺细胞caspase3 mRNA及蛋白表达,反向验证了Nox4参与高糖所致的施旺细胞凋亡。实验未进一步验证ROS和Caspase3通路二者之间的关系,推测Nox4可能通过ROS参与高糖引起的施旺细胞凋亡。
综上所述,Nox4参与高糖引起的施旺细胞凋亡,针对Nox4表达或功能的调控方式可能成为治疗DPN的新途径。

