吴茱萸次碱对高糖诱导的阿尔茨海默病大鼠认知障碍的影响*
陈建国,吴亚更,李 响
(锦州医科大学附属第一医院耳鼻咽喉头颈外科,锦州 121001)
阿尔茨海默病(Alzheimer's disease,AD)是一种进行性的神经退行性疾病。AD的两大主要神经病理学特征是形成大量过度磷酸化tau 蛋白为主要成分的神经原纤维缠结和β-淀粉样多肽为主要成分的老年斑[1,2]。正常的 tau 蛋白可使神经元骨架蛋白保持稳定,但过度磷酸化的tau蛋白可破坏细胞骨架,影响神经元胞浆转运,最终导致突触功能紊乱和神经元退化[3]。微管相关蛋白tau病变是AD早期病变,其磷酸化水平与患者的痴呆程度成正相关。有研究显示,高糖能导致应激触发的急性严重认知损害,表现为一种海马可逆性tau蛋白过度磷酸化改变[4]。糖代谢紊乱会加剧AD模型鼠tau蛋白磷酸化和空间学习记忆障碍。因此研究针对tau蛋白过度磷酸化为靶点的药物可能对AD的治疗具有重要意义。
吴茱萸次碱(Rutaecarpine,Rut)是从吴茱萸将近成熟的果实中提取出来的一种吲哚喹啉类生物碱,对应激诱导的损伤具有神经保护作用,在TRPV1敲除小鼠中发现海马依赖性学习、记忆缺陷和突触可塑性受损[5]。Rut作为辣椒素受体(transient receptor potential vanilloid 1,TRPV1)高选择性激动剂[6],除了作为强效镇痛药和抗炎药的作用外,在中枢神经系统中也发挥神经保护作用,可以提高脑缺血/再灌注损伤小鼠的学习记忆能力[7],但在体内Rut是否对高糖诱导的AD大鼠空间记忆损伤具有保护作用,以及其如何发挥这种保护作用尚未可知。本研究旨在探讨Rut对高糖诱导的大鼠 AD 样病理变化和认知功能障碍的影响及其可能的机制。
1 材料与方法
1.1 抗体与试剂
吴茱萸次碱(纯度98%)购自南京泽朗医药科技有限公司;丙烯酰胺、十二烷基磺酸钠、甘氨酸、三羟甲基氨基甲烷、过硫酸铵、二喹啉甲酸蛋白测定试剂盒、SDS-PAGE蛋白上样缓冲液和RIPA裂解液均购自碧云天生物技术研究所,抗体PT205、PS214和R134d购自abcam公司,抗体pS9-GSK-3β、GSK-3β和pY307-PP2AC/PP2A均购自CST公司。
1.2 实验动物与分组
SPF级雄性SD大鼠购于北京军事医学科学院动物实验中心,体质量分数(250±20)g,SD大鼠许可证号:SCXK-(军)2012-0004。大鼠饲养温度为25℃,正常昼夜节律。将大鼠随机分成3组(n=20)。对照组、高糖组和吴茱萸次碱组。其中对照组大鼠给予常规饲料和自来水饲养,高糖组大鼠行常规饲料和20%蔗糖水饲养,吴茱萸次碱组行 0.01%吴茱萸次碱饲料和20%蔗糖水饲养。实验24周后,采用Morris水迷宫实验检测大鼠空间学习记忆能力,Morris水迷宫测试后2 h处死各组大鼠,取双侧新鲜海马,Western blot实验检测各组大鼠海马tau蛋白Thr205和Ser214位点以及S9-GSK-3β和pY307-PP2AC的蛋白表达水平,免疫组织化学实验检测海马tau蛋白在Thr205位点的蛋白表达水平。
1.3 Morris水迷宫实验检测各组大鼠空间学习记忆能力
水迷宫包括一圆形水池(高 60 cm,直径 120 cm)和一个位置可改变的圆柱形有机玻璃平台(直径10 cm,高 40 cm),平台的顶端平面低于水池液面约 2 cm,实验时水温均维持在 25℃左右。大鼠在训练前 1 h移入水迷宫室,训练时将大鼠从第 III 象限 1/2 弧度处头面向池壁轻放于水中,其游泳路径经水面上方 1.5 cm 处的摄像机拍摄并连接于路径追踪系统进行采集,通过计算机分析,可提供潜伏期(即大鼠从入水点至找到平台所用的时间)、穿越平台次数和目标象限停留时间。大鼠接受连续6 d的Morris水迷宫训练,每天4次。第6日记录大鼠寻找隐匿平台的潜伏期、穿越平台次数和目标象限停留时间。
1.4 Western blot 实验检测各组大鼠tau蛋白Thr205和Ser214位点以及S9-GSK-3β和pY307-PP2AC的蛋白表达水平
Morris水迷宫测试后2 h处死各组大鼠取材。取双侧新鲜海马,称重剪碎,加入RIPA组织裂解液。在 4℃静置 30 min,再加入1 mmol/L的 PMSF和蛋白酶抑制剂混合物(1∶200)在4℃下超声处理10 s,然后与SDS-PAGE蛋白上样缓冲液混合,在水浴中煮沸10 min。使用BCA法测量蛋白质浓度备用。将处理后的蛋白样本通过10%SDS-聚丙烯酰胺凝胶电泳分离等量的蛋白质并转移至PVDF膜。5% 脱脂奶粉封闭 2 h,分别孵育一抗PT205、PS214、S9-GSK-3β和pY307-PP2AC,置于4℃过夜。然后与辣根过氧化物酶标记的二抗室温温育1 h,并用化学发光底物试剂盒显色。然后使用Odyssey红外成像系统显影,最后使用ImageJ软件对蛋白免疫印迹条带进行扫描和分析。
1.5 免疫组织化学实验检测大鼠大脑皮质与海马tau蛋白在Thr205位点的蛋白表达水平
Morris水迷宫测试后,采用水合氯醛(50 mg/kg)腹腔注射深麻醉大鼠。采用4%多聚甲醛溶液进行心脏灌注固定大脑组织(去除小脑),取出脑组织后再于上述固定液中后固定12 h,即可振荡切片,切片厚度为 20 μm。挑选各组部位相同的脑片置于3% H2O2甲醇溶液处理切片30 min,阻断内源性过氧化物酶活性,0.01 mmol/L的PBS 漂洗3个5 min;然后采用含 0.1%Triton 的缓冲液孵育20 min,增加细胞膜对抗体的通透性,0.01 mmol/L的PBS 漂洗3个5 min,加3% BSA室温下封闭1 h。加入稀释的一抗PT205(1∶250)、pS214(1∶500),4℃ 孵育 24 h,0.01 mmol/L的PBS 漂洗3个5 min,加入辣根过氧化物标记的二抗置于37℃孵育2 h,0.01 mmol/L的PBS 漂洗3个5 min,0.06%的DAB避光显色5 min,0.01 mmol/L PBS充分冲洗以终止显色反应,将脑片贴于载玻片上晾干,梯度酒精脱水、二甲苯透明、中性树胶封片,最后置于显微镜下观察。
1.6 统计学处理
2 结果
2.1 Rut对高糖诱导的AD大鼠空间学习记忆能力的影响
与对照组相比,高糖组大鼠寻找隐匿平台的潜伏期显著延长(表1),尤穿越平台的次数减少和在目标象限停留时间显著缩短(表2)。与高糖组相比,吴茱萸次碱大鼠寻找隐匿平台的潜伏期的显著缩短,尤其是第4~7日最为明显(表1),穿越平台的次数和目标象限停留时间显著增加(表2)。
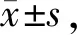
Tab. 1 The latency of time to find platform of the three groups(s, n=20)
CON:Control group;SUC:Sucrose group;RUT:Rutaecarpine group
*P<0.01vscontrol group;#P<0.01vsSUC group

Tab. 2 The number of crossing times to the platform and the time in target quadrant of each n=20)
*P<0.01vscontrol group;#P<0.05vsSUC group
2.2 Rut对高糖诱导的大鼠海马tau蛋白过度磷酸化的影响
与对照组相比,高糖组Thr205(pT205),Ser214(pS214)位点的tau蛋白磷酸化水平增加,Rut组经过tau5(总tau蛋白)标准化后,Thr205和Ser214位点tau蛋白过度磷酸化水平有所降低(图1,表3)。免疫组织化学结果也显示高糖组海马(图2)和皮质(图3)的Thr205位点tau蛋白磷酸化水平增强,与高糖组相比,Rut组tau蛋白Thr205位点的过度磷酸化水平显著降低(图2,3)。



Fig.1Phosphorylation levels of tau protein at Thr205 and Ser214 sites of the three groups detected by Western blot
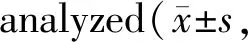
Tab. 3 Phosphorylation levels of tau protein at Thr205 and Ser214 sites were quantitatively n=8)
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsSUC group
2.3 Rut对高糖诱导的大鼠海马S9-GSK-3β和Y307-PP2A位点的磷酸化水平的影响
与对照组相比,高糖组大鼠Y307-PP2A位点的磷酸化水平没有明显变化,S9-GSK-3β位点的磷酸化水平降低。与高糖组相比,吴茱萸次碱组Y307-PP2A位点的磷酸化水平没有明显变化,S9-GSK-3β位点的磷酸化水平显著增高(图4,图5,表4)。

Fig.4The levels of total GSK-3β and Ser9-phosphorylated GSK-3(S9-GSK-3β)were probed by Western blot

Fig.5The levels of total PP2A and Tyr307-phosphorylated PP2A(Y307-PP2A)were probed by Western blot
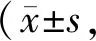
Tab. 4 The expressions of total GSK-3β,PP2A and S9-GSK-3β,Y307-PP2A were quantitatively analyzed n=6)
*P<0.05vscontrol group;##P<0.01vsSUC group
3 讨论
神经原纤维缠结的形成是AD特征性病理损害,其主要成分为过度磷酸化的tau蛋白。神经原纤维缠结与AD患者的记忆损害程度正相关,并且被认为是 AD 的早期病理改变[8]。因此,调控tau蛋白的过度磷酸化对减缓AD的发生和发展非常关键。
糖代谢紊乱或2型糖尿病与AD有相似的发病谱和危险因素,而且二者有相似的临床表现和行为学特征,认为2型糖尿病是AD的危险因素之一[9]。为检测糖代谢紊乱模型大鼠是否出现AD样的学习记忆障碍,本研究采用水迷宫实验来检测各组大鼠的空间学习记忆能力的差异。水迷宫实验结果显示,高糖饮食24周大鼠的空间学习记忆能力显著下降,同时给予Rut可显著逆转高糖诱导的空间学习记忆能力的下降。
TRPV1是哺乳动物脑内广泛分布的非选择性阳离子通道,激活可产生以Ca2+内流为主的阳离子内流。Rut是的TRPV1天然激活剂,Rut激活TRPV1除了具有抗中枢性神经痛和和抗炎作用[10,11]外,对脑血管也具有保护作用,有研究报道Rut可以透过血脑屏障发挥其神经保护作用[12],据报道,TRPV1的激活剂在多种脑缺血模型中具有神经保护作用[13]。但Rut是否对AD样神经病变具有保护作用以及激活TRPV1后通过什么途径或方式保护神经元、改善AD样病变机制尚不清楚。为检测高糖对大鼠脑内tau蛋白磷酸化的影响及Rut对此有无拮抗作用,本研究检测了上述各组大鼠皮质和海马tau蛋白常见磷酸化位点,结果显示,高糖饮食可以使tau蛋白在Thr205和Ser214位点的磷酸化水平显著升高,同时给予Rut可减轻高糖所致的上述改变。结果提示,Rut可通过减轻tau蛋白的异常磷酸化程度而减轻高糖所致AD样病理变化。
Tau蛋白的磷酸化主要受蛋白激酶和磷酸酯酶活性所调控。大量研究表明蛋白激酶和蛋白磷酸酶的不平衡是造成tau蛋白过度磷酸化的原因[14,15]。糖原合成激酶(glycogen synthase kinase-3β,GSK-3β)激活和蛋白磷酸酯酶-2A(protein phosphatase 2A,PP2A)的失活在AD患者tau蛋白过度磷酸化中起关键作用[16,17]。其中,其中GSK-3β的活性受丝氨酸9位点磷酸化水平影响,丝氨酸9位点磷酸化水平增加会导致GSK-3β激活,进而可诱导tau蛋白多个相关位点的高度磷酸化,那么高糖诱导的tau蛋白磷酸化GSK-3β是否参与其中呢?于是本研究检测了大鼠海马中GSK-3β活性以及S9-GSK-3β的磷酸化水平。结果显示,高糖组大鼠海马组织中总的GSK-3β变化不明显,但S9-GSK-3β的磷酸化水平变化显著降低,而同时给予Rut处理能增强S9-GSK-3β位点的磷酸化水平。另外Y307-PP2A磷酸化水平增加会导致PP2A失活,进而可诱导tau蛋白多个相关位点的高度磷酸化。因此,本研究还检测了各组大鼠海马PP2A活性和Y307-PP2A的磷酸化水平。结果发现,各组大鼠海马组织中总的PP2A及Y307-PP2A的表达变化均不明显。这些均提示,高糖诱导的tau蛋白AD样过度磷酸化,可能主要通过激活GSK-3β,而不是通过失活磷酸酯酶PP2A。
本研究观察到高糖24周可导致大鼠海马tau蛋白过度磷酸化,引起大鼠空间学习记忆受损,Rut通过增强海马S9-GSK-3β位点的磷酸化水平来改善高糖诱导的大鼠AD样病理改变和认知功能障碍,本研究结果提示Rut可作为AD治疗干预的潜在药物靶标。
——以吴茱萸为例

