间歇运动对心梗大鼠梗死周边区单个心肌细胞钙瞬变和收缩功能的影响*
薄文艳,李达刚,田振军
(陕西师范大学体育学院暨运动生物学研究所运动与心血管健康研究室,西安 710062)
心肌梗死(myocardial infarction,MI)导致心肌局部缺血缺氧,引发心肌细胞结构与功能损伤,严重损害心室收缩功能。心肌细胞收缩和舒张过程中胞浆[Ca2+]i的瞬时动态变化即为钙瞬变(Ca2+transient)[1],是引起心肌细胞收缩的关键。心肌缺血缺氧后,梗死周边区出现应激损伤反应,细胞内和线粒体内Ca2+水平增加,可导致钙超载而发生钙瞬变异常,出现心肌细胞收缩功能障碍[2,3]。研究发现,高强度间歇运动可显著提高缺血心脏左室射血分数,改善左室功能障碍,提升心功能[4,5]。运动可显著改善心肌细胞收缩过程中的钙瞬变速率,降低舒张期心肌细胞[Ca2+]i浓度,增强心肌细胞收缩功能[6]。我们曾应用钙电镜细胞化学和EDAX能谱分析不同运动负荷下大鼠心肌细胞Ca2+变化,发现过度训练导致心肌细胞钙稳态异常,肌浆网和线粒体钙超载[7],随后应用激光扫描共聚焦显微镜(Laser scanning confocal microscope,LSCM)和胞浆特异性钙荧光试剂动态观察不同运动负荷下小鼠心肌活细胞动态变化,发现大强度疲劳运动导致心肌细胞[Ca2+]c和静息态基值显著升高,峰值后移[8],应用LSCM和胞核特异性Ca2+荧光试剂STDBT研究有氧运动训练后心肌活细胞核Ca2+的变化,发现有氧运动训练可影响心肌细胞[Ca2+]n调控水平[9]。文献表明,运动引起的心肌细胞钙瞬变和收缩-舒张速率变化具有相关性且趋势具有一致性[10],但两者是否同时发生变化,尚不清楚。同步观察单个心肌细胞钙瞬变与收缩功能显得非常必要,可直接反映两者的同步关系。目前,缺乏间歇运动对心梗周边区单个心肌细胞钙瞬变与收缩同步测定的报道。本文拟采用单细胞钙瞬变与收缩力同步测定系统,观察间歇运动对MI大鼠梗死周边区心肌活细胞[Ca2+]i和收缩力的作用,为进一步研究运动对缺血心脏保护效应的生物学机制提供实验依据。
1 材料与方法
1.1 主要仪器与试剂
主要仪器:离体心脏灌流系统、ALC-V8动物呼吸机、BX51OLYMPUS显微镜、电动大鼠跑台、Power Lab/8ST生物信号采集系统(AD instruments)、单细胞可视化动缘探测系统(IonOptix)等。
主要试剂:戊巴比妥钠、胶原酶Ⅱ、蛋白酶、Ca2+荧光探针Fura-2/AM等。
1.2 实验动物分组与心梗模型制备
动物分组:3月龄SD雄性大鼠24只(购于西安交通大学实验动物管理中心),体重为180-220 g,自由进食和饮水。适应性喂养1周后随机分3组:假手术组(S)、心梗组(MI)、心梗+运动组(ME),每组8只。MI组采用左冠状动脉前降支结扎法造模,假手术组只穿线不结扎。
大鼠心梗模型制备:5%戊巴比妥钠腹腔麻醉(30 mg/kg体重),心电图实时监测,佩戴呼吸面罩辅助呼吸(60次/min,潮气量20 ml,呼吸比2:1)。常规手术备皮,开胸暴露心脏,在左心耳与肺动脉圆锥交界下方约2 mm处进针并结扎左冠状动脉前降支,肉眼观察结扎远端心肌颜色变白或变浅、心电图ST段抬高或T波倒置说明结扎成功,缝合关胸。
1.3 间歇运动方案
参考Wisloff训练方式,本实验采用15 m/min×6 min(低强度,50~60 VO2max)、25 m/min×4 min(高强度,80~90 VO2max)交替进行的间歇运动方案:ME组进行预适应运动10 m/min,30 min/d×1周,之后先以10 m/min运动10 min,再以15 m/min×6 min和25 m/min×4 min依次交替进行间歇运动,60 min/d,每周5 d×8周。
1.4 心肌细胞急性分离测定
心肌细胞急性分离方法:5%戊巴比妥钠腹腔麻醉(30 mg/kg体重),舌下静脉注射肝纳素(1 000 U/kg体重),待10 min后开胸取出心脏并迅速放入无钙台式液中(NaH2PO4·2H2O、HEPES、NaCl、D-glucose、KCl、BDM和MgCl2的浓度分别为0.33 mmol/L、10.00 mmol/L、136.00 mmol/L、10.00 mmol/L、5.40 mmol/L、10.00 mmol/L和1.00 mmol/L,pH=7.35)。将处理后的心脏迅速固定于离体心脏灌流系统,灌流含氧无钙台式液(预热37℃)。心脏停跳后用含有胶原酶Ⅱ(1 mg/ml,275 U/mg)、蛋白酶(0.1 mg/ml)和BSA(1 mg/ml)的无钙台式液灌流30 min,等心脏颜色变为粉红色且变软后,再换为BSA无钙台式液灌流5 min。灌流结束后,在无钙台式液中(37℃)剪开心室使其完全溶解,过滤,静置15 min后放入新鲜无钙台式液中,逐次滴加CaCl2(0.2 mol/L)溶液,复钙终浓度为1.8 mmol/L。将复钙前后的细胞悬液取适量制片,放置于显微镜下观察并拍照。
1.5 心肌活细胞钙瞬变测定
复钙后细胞悬液取0.5 ml加入0.5 μl Ca2+荧光染料Fura-2,避光,每10 min用移液枪吹打3次,总计30 min。取少量细胞悬液滴入单细胞可视化动缘探测系统操作台的细胞池中,灌流含钙台式液。显微镜下观察形态功能俱佳的单个细胞,测试数据并记录。数据包括心肌细胞在舒张和收缩期[Ca2+]i变化的百分数([Ca2+]iamplitude)、[Ca2+]i荧光比率(ratio)、达峰的速率(departure velocity)、达峰的时程(time to peak,TTP)和达峰50%的时程(TTP50%)、达基线的速率(return velocity)、达基线50%的时程(time to baseline,TTB50%)以及心肌细胞的[Ca2+]i荧光比率变化幅度(ratio amplitude)。
1.6 心肌活细胞收缩功能测定
由IonOptix软件系统测试采集处理并生成Sarc Length曲线。记录指标包括肌节的最大收缩和舒张速率(±dl/dtmax)、肌节的缩短分数(SL shortening%)、肌节的长度变化(Sarc length,SL)和收缩幅度(PTA)。
1.7 统计学处理

2 结果
2.1 各组大鼠心肌细胞分离结果
光学显微镜下观察心肌细胞分离情况,结果显示80%以上为杆状心肌细胞,且其复钙前形态完整,横纹清晰(图1A,B,C),复钙后观察发现,杆状心肌细胞存活比例下降为70%,边缘折光性良好,横纹清晰可见,单个细胞自发收缩现象消失(图1D,E,F)。说明分离所得大鼠心肌细胞符合实验条件。

Fig.1Images of isolated cardiomyocytes
2.2 各组大鼠心肌细胞钙瞬变测定结果
采用IonOptix系统,采集心肌细胞Ca2+荧光强度变化,经软件计算生成Ratio曲线,同时采集心肌细胞动态收缩图像生成Sarc Length曲线(图2)。各组拟合的Ratio曲线显示(图3),MI组与S组相比心肌细胞Ratio变化幅度下降;与MI组相比,ME组心肌细胞Ratio变化幅度增大。表明心梗后大鼠心肌细胞钙瞬变减弱,间歇运动干预可同步改善MI大鼠梗死周边区心肌细胞钙瞬变。

Fig.2Images of cardiomyocytes,ratio and contractility

Fig.3Effects of interval training on cardiomyocytes Ca2+transient
S:Sham-group;MI:Myocardial infarction-group;ME:MI with interval training(Same as below)
单细胞钙瞬变统计分析结果显示,MI组Departure velocity、[Ca2+]iamplitude、Ratio amplitude和Return velocity值较S组相比均显著显下降(P<0.01,表1),TTB50%、TTP和TTP50%的值均显著增长(P<0.01 表2);与MI组相比,ME组Departure velocity、[Ca2+]iamplitude、Ratio amplitude和Return velocity值均显著提高(P<0.01,表1),TTP、TTP50%和TTB50%的值均明显缩短(P<0.05,P<0.01,表2)。表明MI大鼠梗死周边区心肌细胞钙瞬变幅度与速率明显降低,Ca2+调控异常,间歇运动干预显著改善MI大鼠梗死周边区心肌细胞钙瞬变能力。
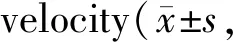
Tab. 1 Effects of interval training on cardiomyocytes Ca2+ transient amplitude and n=8)
S:Sham group;MI:Myocardial infarction group;ME:MI with interval training(Same as below)
*P<0.05,**P<0.01vsS group;#P<0.05,##P<0.01vsMI group(Same as below)

Tab. 2 Effects of interval training on TTP and TTB of cardiomyocytes Ca2+ transient(ms, n=8)
TTP:Time to peak;TTB:Time to baseline
2.3 大鼠心肌细胞收缩功能测定结果
采用IonOptix系统,采集心肌细胞动态收缩图像,生成Sarc Length拟合曲线(图2)。各组拟合的Sarc Length曲线显示(图4),与S组比较,MI组心肌细胞Sarc Length值降低;与MI组比较,ME组心肌细胞Sarc Length值升高。表明心梗后大鼠心肌细胞收缩力减弱,间歇运动干预可同步改善MI大鼠梗死周边区心肌细胞收缩力。

Fig.4Effects of interval training on cardiomyocytes contractility
单细胞收缩各项指标统计分析结果显示,与S组比较,MI组肌节SL Shortening%、PTA、±dl/dtmax均显著下降(P<0.01),与MI组比较,ME组肌节SL Shortening%、PTA、±dl/dtmax均显著提高(P<0.01,P<0.05,表3)。表明大鼠心梗周边区心肌细胞收缩力降低,间歇运动干预可显著改善心梗周边区心肌细胞收缩功能。

Tab. 3 Effects of AIT on cardiomyocytes n=8)
3 讨论
心肌梗死是我国心血管疾病患者死亡率逐年升高的主要原因之一[11]。MI导致心肌细胞缺血缺氧,心室恶性重塑,左心室收缩功能减弱,心功能降低[12]。心肌细胞的收缩功能直接决定心脏的收缩功能,因此如何提高心梗心脏存活心肌细胞收缩功能成为基础和临床研究的关键。钙瞬变(Ca2+transient)反映心肌细胞收缩和舒张过程中胞浆[Ca2+]i的瞬时性变化,是细胞收缩和舒张的分子基础,其速度和幅度的升高和下降均影响细胞收缩的进程。病理条件下,心肌细胞肌浆网Ca2+含量及钙瞬变降低[13],肌浆网回收钙离子的能力减弱[14]。心衰时,心肌细胞内钙调蛋白表达和功能障碍,导致细胞内Ca2+稳态失衡[15]。心脏缺血性损伤可致心肌细胞产生非节律性钙波,破坏细胞兴奋-收缩耦联中的Ca2+稳态,肌浆网Ca2+释放非同步化,影响细胞舒缩[3]。心梗后心肌细胞缺血导致细胞膜NHE通道(Na+/H+exchanger,NHE)开放,静息时胞内Ca2+浓度增加,大量能源物质被消耗,肌浆网钙循环过程被抑制,当缺血严重时,Ca2+持续紊乱,最终导致胞浆和线粒体钙超载造成不可逆细胞损伤[16,17]。本研究实验发现,MI大鼠梗死周边区心肌细胞钙瞬变幅度和速率均明显降低,肌浆网钙调控能力减弱,心肌细胞收缩功能下降。病理性心脏心肌细胞收缩功能障碍由多种因素共同导致,其中钙调控紊乱在收缩功能下降机制中可能占有主导地位。研究发现,心肌细胞[Ca2+]i浓度与其收缩能力密切相关,降低[Ca2+]i浓度后收缩分数立刻下降[18],[Ca2+]i浓度升高可直接刺激细胞凋亡[19]。缺血心脏心肌细胞钙瞬变速率降低可能是导致心肌细胞收缩能力降低的原因之一,同步观察单个心肌细胞钙瞬变和收缩力可直接反映两者的关系。
文献表明,运动是防治各类心血管疾病最安全有效的方式之一,适宜的运动可改善心梗患者心脏恶性重塑现象,提升心功能并提高其生活质量[20,21]。研究发现,高强度间歇运动可显著降低心梗心脏心肌纤维化和细胞凋亡水平,改善左室收缩功能障碍,提高心功能[20,4,5]。但力竭运动会导致大鼠心肌细胞舒缩时间延长、收缩幅度减小,损害心肌细胞收缩功能[22]。在缺血致心衰模型中,运动可加快心肌细胞收缩期钙瞬变上升以及舒张期钙瞬变下降的速率,提高心肌细胞收缩分数[23]。另有研究发现,运动引起的心肌细胞收缩力与钙瞬变变化趋势一致,且8周的间歇运动即可达到对心肌细胞的最佳改善效应[10],推测运动提高心肌细胞收缩功能的机制与改善钙瞬变水平相关[6]。目前缺乏间歇运动对心梗周边区单个心肌细胞钙瞬变与收缩同步测定的报道,心肌细胞钙瞬变水平提高的同时收缩力是否同步提升尚不清楚。以往对运动与心肌细胞内Ca2+变化关系的研究是在细胞死亡固定状态下的静态研究。我们前期的工作在心肌活细胞中证实不同运动负荷影响小鼠心肌活细胞胞浆游离Ca2+动态变化[8],进一步又证实了运动可调控心肌细胞核内[Ca2+]n水平[9]。本研究对MI大鼠进行8周的高强度间歇运动干预,应用单细胞可视化动缘探测系统同步测定梗死周边区心肌活细胞钙瞬变与收缩力变化情况,发现高强度间歇运动显著提高心肌活细胞钙瞬变幅度及速率,同时其收缩幅度和速率同步提升,收缩力与钙瞬变变化趋势一致。
综上,本文对心梗周边区心肌活细胞钙瞬变与收缩力进行同步观察,发现间歇运动训练可同步提升心梗周边区心肌活细胞钙瞬变和收缩功能。该研究将为运动对缺血心脏保护效应的生物学机制提供实验依据,对运动与心血管疾病预防和运动康复提供新思路和方法。

