益气化瘀化痰方对肺纤维化大鼠的干预作用及其机制*
田 晟,曹文富,张永越,吴 庆
(1.重庆医科大学中医药学院,重庆 400016;2.重庆医科大学中医药研究室,重庆 400016;3.重庆医科大学附属第一医院中西医结合科,重庆 400016)
肺纤维化(pulmonary fibrosis,PF)是以肺组织成纤维细胞增殖及大量细胞外基质(extracellular matrix,ECM)聚集并伴炎症损伤、组织结构破坏为特征的呼吸系统疾病[1],即ECM(主要是Ⅰ、Ⅲ型胶原)过度沉积为特征的肺间质疾病。异常增多的肺间质逐渐占据肺泡腔,并取代肺泡上皮细胞。严重的肺换气功能障碍最终导致呼吸衰竭[2]。目前肺纤维化治疗手段较为有限,中药治疗肺纤维化有一定的优势,但中医学中并没有“肺纤维化”的病名,只能根据临床症状认为属于“肺萎”和“肺痹”的范畴。肺纤维化属本虚标实之证,病因主要为正气虚弱、痰瘀互结所致,故其基本病机为“气虚-痰瘀互结-阻滞肺络”,故以中医的益气化瘀化痰为治则的中药来治疗肺纤维化。国内外研究表明,上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)在PF的发生发展中重要过程。锌指蛋白转录因子(Snail)通路的激活在肺泡上皮细胞EMT中起到重要作用,而转化生长因子-β1(transforming growth factor-β1,TGF-β1)是Snail信号通路激活的重要因素[3]。TGF-β1是公认的致纤维化因子,可通过调控TGF-β1和Snail1来调控TGF-β/Snail信号通路从而干预EMT的发生。故在前期研究和已知疗效的基础上,本实验以参与纤维化进程的TGF-β1、Snail1及EMT生物标志物E-cadherin、Fibronectin等作为主要观察指标;以曹文富教授治疗肺纤维化及相关疾病的基础方——益气化瘀化痰方为研究对象;以博来霉素诱导的大鼠肺纤维为模型,探讨益气化瘀化痰方改善大鼠肺纤维的作用机制。
1 材料与方法
1.1 实验动物
同批次健康SPF级SD大鼠62只,雌雄不限,7周龄,体重180~220 g。购于重庆医科大学实验动物中心,动物许可证:SCXK(渝)2012-001。实验场所重庆医科大学实验动物中心SPF实验室,房间通风良好,SPF清洁级,温度20℃,空气湿度70%,大鼠自由饮水,饮食。
1.2 主要试剂
中药饮片黄芪、白术、川芎、姜黄、瓜蒌、海藻(购于重庆医科大学附属第一医院中药房,由重庆医科大学中医药研究室曹文富教授鉴定合格);醋酸氢化可的松片(上海上药信谊药厂有限公司,批准文号:国药准字H31021270,购于重庆医科大学附属第一医院西药房);一抗:TGF-β1抗体(购于Servicebio,GB11179)、Snail1抗体(购于Servicebio,GB11260)、E-cadherin抗体(购于Servicebio,GB11082)、Fibronectin抗体(购于Servicebio,GB11091)和β-actin(购于Servicebio,GB12001);二抗:HRP标记山羊抗兔(购于Servicebio,GB23303)HRP标记山羊抗小鼠(购于Servicebio,GB23301);RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、蛋白Marker(购于碧云天生物技术公司);PCR引物(购于Servicebio)。
1.3 肺纤维化大鼠模型的建立
同批次健康SD大鼠62只,适应性喂养1周后,随机选取52只,用10%的水合氯醛行腹腔注射麻醉大鼠,无菌条件下,沿颈正中切开大鼠皮肤,逐层钝性分离暴露气管,使用留置针经气管环状软骨间隙一次性灌注博来霉素(BLM)5 mg/kg,直立旋转,使BLM在肺内均匀分布,建立大鼠肺纤维化模型。剩余10只大鼠气管内一次性灌注等体积生理盐水,作为正常对照组(N组)。待造模4周后,随机选取经BLM处理过的大鼠2只处死,取肺组织行HE及Masson染色,参照Szapiel[4]等的方法观察,确定肺纤维化模型复制成功。
1.4 药物制备
益气化瘀化痰方中药饮片均按《中国药典》(2015版)规定的临床常用量使用,黄芪30 g、白术10 g、姜黄10 g、川芎10 g、海藻10 g、瓜蒌10 g等中药饮片混合水提,按1∶2∶4的浓度比例熬制低、中、高浓度制剂,用旋转蒸发仪浓缩,低浓度组含1 g/ml生药,4℃冰箱中保存备用。氢化可的松制剂:氢化可的松用生理盐水配成6.95 mg/ml的制剂,现配现用。
1.5 给药及分组
将剩余成模的50只大鼠,随机分成5组,模型对照组、阳性对照组、低浓度组、中浓度组、高浓度组各10只。根据《药理试验方法学》体表面积折算法计算大鼠用药剂量,成人体重以70 kg计算,大鼠等效剂量为成人约6.3倍。以此为标准计算各组大鼠给予的灌胃剂量:阳性组大鼠给予醋酸氢化可的松灌胃;低浓度组给予低浓度制剂灌胃;中浓度组给予中浓度制剂灌胃;高浓度组给予高浓度制剂灌胃;模型组和正常组等体积的纯水灌胃,各组大鼠均按 3.6 ml/kg灌胃;实验期间每日灌胃1次,连续灌胃观察12周。分笼饲养,自由饮水、饮食。
1.6 标本采集
连续给药12周后,禁食不禁水12 h,各组大鼠用2%戊巴比妥钠以0.25 ml/100 g剂量腹腔注射麻醉后解剖分离肺组织,取全肺称湿重。冰生理盐水冲洗,滤纸滤干后,取右肺组织放入4%多聚甲醛溶液中固定,待做HE和Masson染色后光镜观察。取左肺组织放入冻存管内,液氮冷冻后放入-80℃冰箱保存,待做Western blot和qRT-PCR检测。
1.7 肺组织形态学观察
(1)肺组织固定后,酒精梯度脱水,二甲苯透明,石蜡包埋、制成3 μm厚切片;按试剂说明进行HE染色、Masson染色后,脱水,透明,中性树胶封片。(2)肺泡炎和肺间质纤维化分级判断标准。在100倍光学显微镜下观察肺泡炎及肺纤维化程度。按Szapiel法进行评分,确定肺泡炎(0—+++级)及肺纤维化(0—+++级)的程度。
无肺泡炎评级—记0分;轻度肺泡炎表现为单核细胞清润,肺泡间隔增宽,病变范围局限于全肺20%以下评级+记1分;中度肺泡炎表现为病变范围占全肺21%~50%评级++记2分;重度肺泡炎表现为呈弥漫性肺泡炎,病变范围大于51%评级+++记3分。
无肺纤维化评级—记0分;轻度肺纤维化表现为病变范围占全肺20%以下评级+记1分;中度肺纤维化表现为病变范围占全肺21%~50%,肺泡机构紊乱评级++记2分;重度肺纤维化表现为病变范围大于51%,肺泡融合,肺实质结构明显紊乱评级+++记3分。
显微镜下随机选取5个视野,对其炎症程度及纤维化程度进行评价。评分标准见表1。
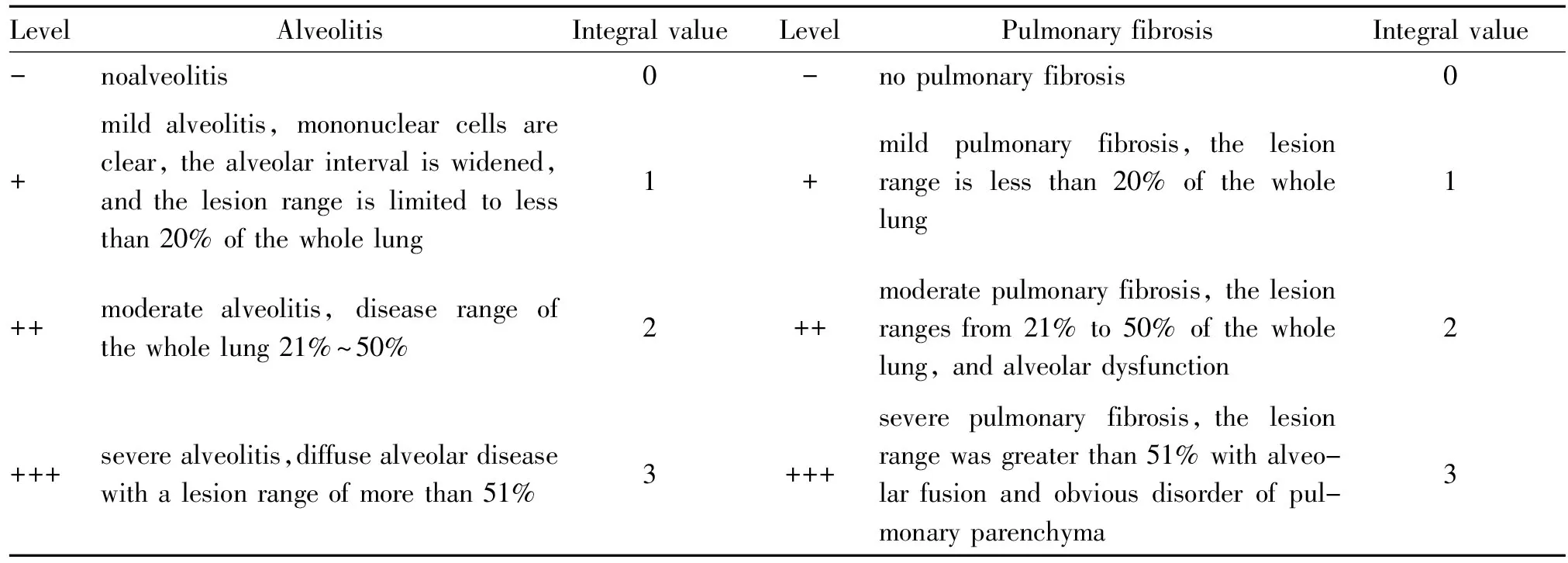
Tab. 1 Pulmonary alveolitis and pulmonary interstitial fibrosis classification and integral criteria
1.8 蛋白免疫印迹检测蛋白表达
用蛋白裂解液来提取蛋白质,然后样品中加入适量 5 × SDS 上样缓冲液和 10% β-巯基乙醇,100℃ 煮 10 min,10% SDS-PAGE 电泳电转移至 PVDF 膜上后,丽春红染色观察蛋白质转移情况。室温下5% 脱脂牛奶封闭 4 h,分别加入1∶1 000 TGF-β1、Snail1、E-cadherin、Fibronectin一抗,4℃ 反应过夜,用TBST 洗涤 3 次,每次 10 min,加入用TBST稀释3 000倍的二抗,室温孵育 1 h,TBST 洗涤 3 次,每次 10 min,Western blot荧光检测。结果用 Labwork 凝胶图像分析系统对胶片扫描,以对照组的面积灰度值为100% 与实验组进行比较和半定量分析。
1.9 RT-PCR检测相关基因表达
采用Trizol法提取总mRNA,在37℃ 15 min,85℃ 5 s条件下逆转录合成cDNA。按如下条件进行扩增:预变性:95℃ 30 s;PCR反应:95℃变性 5 s,55℃退火30 s,72℃延伸30 s,循环40次。采用RT-PCR相对定量方法(ΔΔCt值比较法)进行分析:ΔΔCt=(干预组Ct -内参Ct)-(假手术组Ct-内参Ct),平均相对含量=2-averageΔΔCt× 100%。qRT-PCR引物信息见表2。

Tab. 2 Sequences for primers
1.10 统计学处理
2 结果
2.1 各组大鼠肺系数实验结果
通过公式:肺系数=肺湿重(g)/体重(kg)×100%计算。与空白组比较,模型组肺系数显著升高(P<0.01),与模型组比较,阳性组肺系数降低(P<0.05),中药治疗组肺系数显著下降(P<0.01),与中浓度组比较,中浓度组肺系数下降程度较低、高浓度组显著(P<0.05),与阳性组比较,中药治疗组肺系数下降程度较阳性组显著(P<0.05,表3)。肺系数结果说明中浓度组较其他各治疗组能更有效的降低肺系数。

Tab. 3 The results of the lung coefficients of the n=10)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel;△P<0.05vsmedium concentration;▲P<0.05vspositive
2.2 各组肺组织形态学观察
HE染色显示:正常组肺组织结构清楚,肺泡间隔正常,无充血水肿、炎症及纤维化表现;模型组肺内肺泡炎不明显,肺泡间隔显著增厚,肺泡结构破坏,肺泡腔缩小,肺泡塌陷或融合,肺间质内有大量胶原纤维;中药治疗各组纤维化程度较模型组轻,肺泡壁结构基本正常,肺泡间隔纤维增生灶较少,肺泡内未见明显渗出物淤积(图1)。

Masson染色显示:正常组肺内结构正常,肺泡腔存在较少胶原纤维;模型组肺组织纤维化明显,大量蓝染胶原纤维呈片状积聚,肺泡组织结构破坏;中药治疗各组肺组织纤维化程度较模型组明显减轻,蓝染胶原沉积明显减少,肺泡间隔宽带较M组小(图2)。
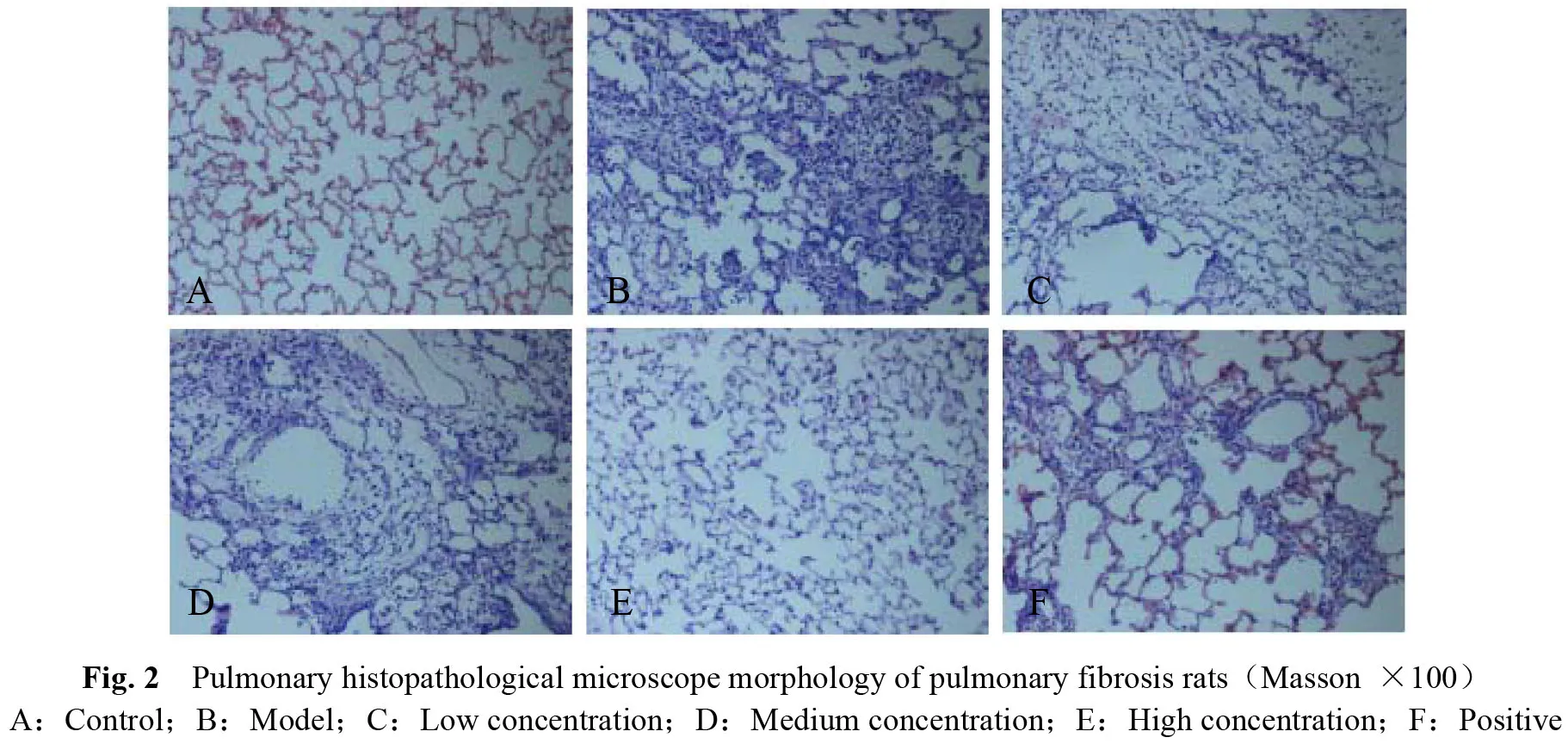
按Szapiel法进行评分,确定肺泡炎(0—+++级)及肺纤维化(0—+++级)的程度。显微镜下随机选取5个视野,对其炎症程度及纤维化程度进行评价(表4)。
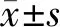
Tab. 4 The results of pulmonary alveolitis and pulmonary interstitial fibrosis(score,,n=10)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01 vs model;△P<0.05vsmedium concentration;▲P<0.05vspositive
2.3 各组TGF-β/Snail通路、E-cadherin及Fibronectin 蛋白表达的变化
Western blot结果显示:与正常组大鼠比较,模型组大鼠的肺组织中TGF-β1、Snail1、Fibronectin的蛋白表达明显高于正常组(P<0.01),E-cadherin 蛋白表达则明显低于正常组(P<0.01,图3,表5);与模型组大鼠比较,低、中、高浓度组均能不同程度的下调肺纤维化大鼠的肺组织中 TGF-β1和Snail1 蛋白的表达(P<0.05),能够下调肺纤维化大鼠的肺组织中Fibronectin蛋白的表达(P<0.05)以及增加E-cadherin蛋白的表达(P<0.05);低、高浓度组与中浓度组比较,中浓度组结果更加显著(P<0.05);中药治疗各组与阳性组比较,表达结果优于阳性组(P<0.05,图3,表5)。

Fig.3The protein expressions of TGF-β/Snail signal pathway,E-cadherin and Fibronectin
A:Control;B:Model;C:Low concentration;D:Medium concentration;E:High concentration;F:Positive
2.4 TGF-β/Snail通路、E-cadherin及Fibronectin mRNA相对表达的影响
qRT-PCR显示:与正常组大鼠比较,模型组大鼠的肺组织中TGF-β1、Snail1、Fibronectin的mRNA表达明显高于正常组(P<0.01),E-cadherin mRNA表达则明显低于正常组(P<0.01,表6);与B组大鼠比较,低、中、高浓度组均能不同程度的下调肺纤维化大鼠的肺组织中 TGF-β1和Snail1 mRNA的表达(P<0.05),能够下调肺纤维化大鼠的肺组织中Fibronectin蛋白的表达(P<0.05)以及增加E-cadherin mRNA的表达(P<0.05);低、高浓度组与中浓度组比较,中浓度组结果更加显著(P<0.05);中药治疗各组与阳性组比较,表达结果优于阳性组(P<0.05)。qRT-PCR与Western blot结果趋势一致(表6)。

Tab. 5 The expressions of TGF-β1,Snail1,Fibronectin and E-cadherin protein in rats with pulmonary fibrosis(score, n=10)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel;△P<0.05vsmedium concentration;▲P<0.05vspositive

Tab. 6 The expressions of TGF-β1,Snail1,Fibronectin and E-cadherin mRNA in rats with pulmonary fibrosis(score, n=10)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel;△P<0.05vsmedium concentration;▲P<0.05vspositive
3 讨论
肺纤维化是多种肺部疾病发展到终末期的共同的病理变化,严重危害着人类的健康,一直是医学界研究的热点和难点问题。本研究采用目前公认的气管内一次性注射博来霉素的方法复制肺纤维化模型,该模型是观察肺纤维化的经典模型。
本研究选取曹文富教授治疗肺纤维化及相关疾病的基础方——益气化瘀化痰方来实验。中医学中并没有“肺纤维化”的病名,只能根据临床症状认为属于“肺萎”和“肺痹”的范畴。肺纤维化属本虚标实之证,主要是以“气虚-痰瘀互结-阻滞肺络”为基本病机,故以益气化瘀化痰为治法来治疗肺纤维化。以益气、化瘀、化痰法为治法原则,益气使肺脾肾之气健旺,水湿与津液输布、转化功能和血液运行功能趋于恢复正常,减少或消除痰浊与瘀血的生成(ECM形成减少);化瘀使血行通利,减轻或消除瘀血内阻和痰瘀互结(ECM形成减少,降解增强);化痰以消除已成之痰(促进ECM降解),益气化瘀化痰法合用可扶正祛邪,澄源除积,达到使受损后处于纤维化病理进程的肺组织形态和功能复原的目的。
益气化瘀化痰方以益气药黄芪为君药,黄芪为补气之要药,配白术以增强其补气之功。有研究报道,黄芪含有多糖、皂苷、黄酮和微量元素,具有扩张小血管、改善微循环、抗炎、调节免疫功能、抗氧化等多重药理作用,并且在肾、肝、肺等多个器官具有抗纤维化作用[5];臣以化瘀药川芎和姜黄,川芎为“血中之气药”,对气血瘀滞效果明显,配以姜黄以加强行气活血的功效。川芎的主要有效成分川芎嗪,能抑制博来霉素诱导的肺纤维化大鼠肺组织Col-Ⅰ、Col-Ⅲ、LN的表达,减少细胞外基质积聚,发挥治疗作用[6];川芎其有效成分阿魏酸有明显的抗脂质过氧化作用,可以有效的防止纤维化的发生和发展[7];姜黄可抑制肺纤维化大鼠肺组织胶原沉积,在延缓肺纤维化形成中起重要作用[8];佐以化痰药海藻和瓜蒌,肺纤维化患者有呼吸困难,胸闷不畅等临床症状,瓜蒌具有清热化痰、宽胸散结功效,可减轻患者症状,现代药理研究表明,瓜萎薤白汤(瓜蒌、薤白)能明显减轻平阳霉素所致的大鼠肺泡炎及纤维化[9],与海藻相须使用能增强其化痰散结的功效,现代研究表明,海藻多糖能抑制羟脯氨酸的合成,减少肺胶原的产生,对博莱霉素诱导的大鼠肺纤维化形成有一定的抑制作用[10]。综上所述,益气化瘀化痰方有益气健脾、化瘀消痰散结之功。
肺系数是肺湿重与大鼠体重的比值,肺系数的高低是反映肺纤维程度的最直观的指标之一。在博来霉素诱导的肺纤维早期,主要有肺泡炎症为主,肺部炎性渗出、细胞水肿、毛细血管充血等因素导致肺湿重增加,使肺系数增高;随着进入肺纤维化末期,炎症、水肿、充血逐渐减轻,但胶原纤维沉积不断加重,肺组织质地变硬,弹性减弱[11],肺湿重较早期略有降低,但较正常大鼠仍是增加;同时在肺纤维化发展过程中,由博来霉素干预的大鼠体重增长缓慢,严重者体重还会下降,最终导致肺系数的增高。观察HE和Masson染色结果,中药治疗组可以下调博来霉素诱导的肺纤维化大鼠肺泡炎症和肺纤维化程度的损伤评分。这说明益气化瘀化痰方不同浓度的制剂均可在不同程度上降低大鼠的肺系数,改善肺组织纤维化程度,以中浓度组最明显,这说明益气化瘀化痰方对治疗肺纤维化有显著的疗效。
进一步探讨益气化瘀化痰方治疗肺纤维化的机制。EMT是PF发生发展中的重要过程。通过EMT,肺泡上皮细胞失去细胞极性,失去与基底膜领导连接等上皮表型,获得迁移与侵袭的能力,进入ECM获得成纤维细胞表型。EMT与损伤修复、组织再生和器官纤维化密切相关,生理状态下当炎症反应缓解时会自行停止;但当炎症反应持续活化,EMT过程将持续存在,最终导致肺纤维化的形成。TGF-β信号通路是许多可以导致EMT中的一条,TGF-β1是公认的致纤维化因子,TGF-β1可以促进成纤维细胞增殖、分化为肌成纤维细胞,肌成纤维细胞产生大量基质蛋白成分分泌到细胞外基质中,如胶原蛋白等细胞外基质成分在TGF-β1的刺激下合成增多并沉积,进一步增加TGF-β1诱导肺成纤维细胞分化为肌成纤维细胞,进一步促进肺纤维化的发展[12-13]。TGF-β信号通路能激活转录因子Snail,Snail可以抑制上皮基因的表达并且可以作为EMT的激活剂发挥作用。Snail蛋白连接到E-cadherin蛋白的启动子上沉默其表达用[14]。而E-cadherin和Fibronectin是EMT发生的标志蛋白,EMT发生的主要特征是细胞黏附分子(如E-cadherin)表达的减少、细胞外基质蛋白(如Fibronectin)表达的增加。因此,可通过调控TGF-β1和Snail1来调控TGF-β/Snail信号通路来影响EMT发生。本研究中,模型组TGF-β1、Snail1和Fibronectin蛋白和mRNA表达较正常组明显上调,E-cadherin蛋白和mRNA表达下调,表明博来霉素干预后TGF-β/Snail信号通路被激活;中药治疗组TGF-β1、Snail1和Fibronectin蛋白和mRNA表达较模型组明显下调,E-cadherin蛋白和mRNA表达上调,提示药物治疗对TGF-β/Snail信号通路有抑制作用。本研究结果推测,益气化瘀化痰方改善大鼠肺纤维化的作用可能与其能抑制TGF-β/Snail信号通路,在一定程度上抑制ECM的生成和堆积,增加细胞外基质的降解有关。
PF是细胞、细胞因子、ECM产生与降解等相互作用、相互调节的多因素参与的十分复杂的过程[15],所以单一靶点的药物难以治疗肺纤维化。益气化瘀化痰方可以多靶点、多环节、多途径的治疗肺纤维化,本研究证明益气化瘀化痰方可以显著的改善博来霉素引起的肺纤维化,其机制是能抑制TGF-β/Snail信号通路,从而抑制ECM的生成和堆积,在防治肺纤维化方面具有较好的临床应用前景。

