佝偻病患儿维生素D受体基因BsmI和FokI位点多态性与骨密度相关性研究
王道静,吕为萍,李建友,厉吉霞
维生素D缺乏性佝偻病(vitamin D deficient rickets)是由于婴儿体内维生素D不足,造成钙、磷代谢紊乱、骨盐沉积量减少、骨形成障碍,形成一种以骨骼病变为特征的全身慢性营养性疾病[1],甚至造成成人后骨质疏松的发生。研究发现,即使在阳光充足的地域,佝偻病的发病率也比较高,且给予患儿补充维生素D之后的效果也不尽相同,说明佝偻病的发生不仅与环境和营养因素有关,还与基因遗传因素有关[2]。维生素D受体(vitamin D receptor,VDR)作为核内生物大分子,在机体内发挥着极其重要的作用,尤其是维持钙磷代谢等[3]。近年来,VDR基因被认为是遗传调控骨和钙代谢的候选基因[4]。研究表明,VDR等位基因通过影响信使RNA的表达,进而引起其受体蛋白在数量或功能上的差异,进一步地引起对钙磷代谢调节出现异常,最终影响机体肠道中对钙磷的吸收,使骨骼中的钙磷沉积发生改变,从而影响骨密度(BMD)[5]。因此本研究采用病例对照研究方法,选取山东省烟台地区的婴幼儿作为研究对象,分析VDR基因 BsmI和FokI位点多态性与佝偻病、骨密度相关性,以期对本地区佝偻病患儿提供辅助性病因诊断,预测维生素D治疗效果,指导临床维生素D个体化用量。进而降低佝偻病患儿低骨密度对骨骼造成的不可逆性的改变,避免成人期骨质疏松的发生,报道如下。
1 资料和方法
1.1 临床资料 选取2017年1—12月于烟台市烟台山医院儿科就诊的佝偻病患儿作为研究对象,纳入标准:(1)符合中华医学会儿科学分会儿童保健学组制定的“维生素D缺乏及维生素D缺乏性佝偻病防治建议”诊断标准[6];(2)临床表现为枕秃、肋软骨沟、鸡胸。排除标准:(1)长期服用激素类药物;(2)伴随先天性疾病;(3)早产儿;(4)伴随遗传性疾病及肝肾功能障碍的患儿。最终纳入符合要求的患儿50例作为研究组,男30例,女20例,年龄4~12(7.89±1.23)个月。另选择同期在医院体检的健康婴儿50例作为健康对照组,男29例,女21例,年龄4~12(7.92±1.21)个月。2组婴儿均不存在影响维生素D吸收的胃肠道、内分泌、肝肾疾病等。2组婴儿性别和年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有入选婴儿的监护人均知情同意并签署知情同意书。
1.2 观察指标与方法
1.2.1 VDR基因BsmI和FokI位点多态性分析:采用口腔拭子采集婴儿口腔上皮细胞,然后采用DNA试剂盒进行提取,并采用紫外分光光度计测量纯度和含量,PCR引物采用Primer Premier 6.23 DEMO软件进行设计,由上海吉玛生物有限公司代为合成。BsmI:F.3'-CCCTCACTGCCCTTAGCTC-5',R.3'-CCTCCAAAATCAATCAGGTAAAC-5';FokI:F.3'-GCTGAGCTCCCTGGTGGT-5',R.3'-AGCATTGAAGTGAAAGCCAGT-5'。反应条件:总体系为50 μl,95℃预变性3 min,之后94℃变形30 s、55℃退火35 s、72℃延伸40 s,35个循环后,再72℃延伸5 min。1%琼脂糖电泳,嗅化乙啶染色,然后采用PCR纯化试剂盒进行纯化,采用3730XL基因测序仪(美国ABI公司生产)完成基因分型。
1.2.2 骨密度检测:采用BMD-1000A超声波骨密度仪(上海名元实业有限公司)检测左胫骨中段骨密度,然后通过数据库自动计算骨密度Z值,骨密度检测由2位具有5年以上工作经验的医师完成。
1.2.3 生化指标检测:常规禁食8 h,采集肘静脉血1.5 ml,离心5 min,收集血清,一部分采用全自动生化分析仪检测血清钙和磷;另一部分采用酶联免疫试剂盒(基尔顿生物科技有限公司)检测25-(OH)D3水平,采用全血干化学法检测骨碱性磷酸酶(bone alkaline phosphatase,B-ALP),试剂盒购自安徽高山药业有限公司。
1.3 统计学方法 采用SPSS 16.0统计软件对数据分析。采用卡方检验判断各位点基因型频率分布是否符合Hardy-Weinberg平衡;计数资料用频数或率(%)表示,组间比较采用χ2检验;符合正态分布计量资料用均数±标准差表示,组间比较采用t检验;不同基因型的骨密度、血钙、血磷以及25-(OH)D3采用单因素方差分析,两两比较采用LSD-t检验;Logistic单因素回归分析基因位点与佝偻病发病的风险性。P<0.05为差异有统计学意义。
2 结 果
2.1 2组婴儿血钙、血磷、骨密度、B-ALP及25-(OH)D3水平比较 研究组患儿血钙、骨密度以及25-(OH)D3明显低于健康对照组,而血磷和B-ALP明显高于健康对照组,差异具有统计学意义(P<0.01),见表1。
2.2 Hardy-Weinberg平衡检验 Hardy-Weinberg平衡检验结果显示BsmI位点(χ2=0.714,P>0.05)和FokI位点(χ2=0.693,P>0.05),均符合Hardy-Weinberg遗传平衡,说明选取的对象具有代表性。
2.3 2组婴儿VDR基因BsmI和FokI位点基因多态性分布比较 研究组和健康对照组在FokI位点上的基因型ff、Ff及FF分布上差异有统计学意义(P<0.05),而在BsmI位点上基因型BB和Bb+bb分布差异无统计学意义(P>0.05),见表2。
2.4 2组婴儿VDR基因BsmI和FokI位点基因多态性与佝偻病风险性的关系 校正性别和年龄后,结果显示FokI位点携带FF基因型个体的佝偻病发生风险是携带Ff+ff基因型个体的3.918倍,差异具有统计学意义(OR=3.918,95%CI1.174~8.918,P=0.045),而BsmI位点基因型BB与bb+Bb个体相比,佝偻病发病差异无统计学意义(OR=1.034,95%CI0.437~1.562,P=0.782)。
2.5 2组婴儿VDR基因FokI位点不同基因型血钙、血磷、骨密度、B-ALP及25-(OH)D3比较 2组骨密度和25-(OH)D3在不同基因型间差异均具有统计学意义(P<0.05),而不同基因型间血钙、血磷以及B-ALP间差异无统计学意义(P>0.05)。两两比较结果显示FF基因型个体骨密度和25-(OH)D3水平均明显低于携带Ff和ff基因型个体(P<0.05),见表3。
3 讨 论
据报道,中国北方地区佝偻病的流行率为40%左右[7]。人体大部分骨矿含量的累积发生在婴儿及青少年时期,至30岁左右达到骨量峰值(peak bone mass,PBM)。PBM代表个体一生中所能达到的最大BMD值,PBM的高低与原发性骨质疏松症发生密切相关[8]。婴幼儿作为佝偻病的高发群体,虽不会给患儿生命安全造成威胁,但会引起患儿抵抗力下降,致使其容易发生腹泻、贫血等疾病,因此正确识别和诊断佝偻病至关重要[9]。B-ALP作为骨合成过程中的关键酶,由成骨细胞合成分泌,如果小儿体内缺乏维生素D,骨钙化不足,成骨细胞就会活跃,B-ALP活性就会升高[10]。本研究结果显示佝偻病患儿血钙、骨密度以及25-(OH)D3明显低于健康对照组,而血磷和B-ALP明显高于健康对照组,差异具有统计学意义(P<0.05)。提示血钙、骨密度、25-(OH)D3、血磷和B-ALP均可作为诊断佝偻病的生化指标。
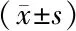
表1 2组婴儿血钙、血磷、骨密度、B-ALP及25-(OH)D3水平比较

表2 2组婴儿VDR基因BsmI和FokI位点基因多态性分布比较 (例)
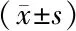
表3 2组婴儿VDR基因FokI位点不同基因型血钙、磷、骨密度、B-ALP以及25-(OH)D3比较
注:组内与ff基因型比较,aP<0.05;组内与Ff基因型比较,bP<0.05
婴儿时期的PBM与性别、钙吸收、运动、体质以及遗传等诸多因素有关。文献报道称即使在阳光充足的地域,佝偻病的发病率也比较高,且给予患儿补充维生素D之后的效果也不尽相同,说明佝偻病的发生不仅与环境和营养因素有关,还与基因遗传因素有关[11]。维生素D与骨代谢有着非常密切的关系。人体内维生素D主要活性形式是25-(OH)D3,它通过对肠、肾、骨等靶器官的作用发挥其抗佝偻病的生理功能[12]。维生素D受体(vitamin D receptor,VDR)作为核内生物大分子,属于一种配体依赖的核转录因子,通过与其他激素如甲状旁腺激素共同维持钙、磷的动态平衡,调节骨骼代谢[13]。近年来,研究发现维生素D受体基因是调控骨和钙代谢的候选基因[14]。本研究结果显示烟台地区婴幼儿VDR基因FokI位点基因多态性和佝偻病风险性相关,携带FF基因型个体的佝偻病发生风险是携带Ff+ff基因型个体的3.918倍,说明FokI位点FF基因更容易发生佝偻病。
与骨代谢相关的VDR基因FokI位点在VDR基因5'端第二个外显子转录起始位点,当由ATG突变为ACG时,原本由从第一位起始密码子ATG转录(f型VDR基因),转变成从下游存在ATG开始转录(F型VDR基因)[5]。因此,F位点的VDR所表达出来的蛋白质长度要短于f位点,因此其亲和力、稳定性及转运活力要比f位点高,所以F位点的VDR所表达出来的蛋白质能够增加肠道对钙的吸收,从而增加BMD。FokI位点基因多态性可能主要是通过影响钙和维生素D的摄入,从而引起佝偻病的发生[16]。另外本研究还对比了佝偻病婴儿和健康婴儿不同基因型个体血钙、血磷、骨密度、B-ALP以及25-(OH)D3的差异,结果显示FokI位点FF基因型个体骨密度和25-(OH)D3水平均明显低于携带Ff和ff基因型个体(P<0.05),说明FokI位点基因多态会影响到骨代谢,从而引起佝偻病发生。而对于BsmI位点多态性,本研究尚未发现其与佝偻病风险性相关,研究结果与银川地区婴儿BsmI位点多态性分布差异无统计学意义一致[17]。可能是因为BsmI位点在VDR内含子中,因此并不改变VDR蛋白的序列。
综上所述,烟台婴幼儿FokI位点基因多态性和骨密度、25-(OH)D3水平密切相关,FF基因型可能是佝偻病发生的遗传危险因素,提示佝偻病发生不仅与维生素D缺乏和紫外照射不足有关,还与基因异常突变有关,通过对婴儿VDR基因检测,从遗传角度进行评估,明确个体对维生素D需求的差异,从而采取个性化干预方案,有利于针对性地指导婴儿对维生素D和钙的摄入,从而降低佝偻病发生率。
利益冲突:无
作者贡献声明
王道静、吕为萍:设计研究方案,实施研究过程,论文撰写,提出研究思路,分析试验数据,论文审核;李建友、厉吉霞:实施研究过程,资料搜集整理

