东海外海海域生物体内总汞蓄积差异性研究
乔艺飘 ,杨光昕,王媛,李小蕾,娄晓祎,黄冬梅,史永富*
1. 中国水产科学研究院东海水产研究所/农业农村部水产品质量监督检验测试中心(上海),上海 200090;2. 上海海洋大学食品学院,上海,201306;3. 广东海洋大学海洋与气象学院,广东 湛江 524088
汞(Hg)是一种剧毒非必需元素,在大气、土壤和水体中广泛存在。其中在水生生态系统中,汞沉积于水底并在厌氧菌和甲基维生素B12的作用下形成甲基汞和乙基汞,水生生物可以将水体中的甲基汞大量富集,富集后水生生物体内的甲基汞含量可达到水体中含量的104-106倍(US EPA,1997)。食用被汞污染的水产品是人体最主要的汞暴露途径之一(US EPA,1997),当人或动物食用含有过量汞的水产品后,由于该物质在人体内蓄积后不易被排出的特殊理化性质,容易造成汞中毒,对人体健康产生极大危害(李世龙等,2016;常家琪等,2016),闻名遐迩的日本公害水俣病就是长期饮用含汞水和食用含汞产品所致(张铁涛等,2012)。
对海洋生物(鱼类、贝类、藻类等)体内的汞含量调查研究引起了研究人员的持续关注。李崇德等(1990)早在 1990年便对黄海海域近海底栖动物中的总汞含量进行了初步分析和探讨;朱艾嘉等(2014)对黄海常见鱼体内汞含量的种内和种间差异进行了深入分析,发现海洋生物由于其种类、食性、栖息区域的差别,对汞的积累含量情况不同;梅光明等(2016)对浙江沿海海产品甲基汞污染及膳食风险进行了调查及评估,94.2%的海产品均有甲基汞检出,但含量均低于国家标准限量值;且营养级别高的鱼类对甲基汞的生物富集能力较强,鲨鱼、金枪鱼等大型肉食性鱼类甲基汞含量明显高于一般鱼类;另外胶州湾、大亚湾等海域海洋生物中汞的含量研究也有报道(崔毅等,1997;王增焕等,2009)。然而,目前关于东海外海海域的生物体中汞含量及蓄积特征差异性的研究尚未见相关报道。
本研究对来自东海外海海域的 22个品种共计104个生物样本中的汞含量进行了测定分析,使用精密度高、准确度高、省时简单的直接测汞仪进行定量,采用标准物质进行质量控制(刘丽萍等,2010;胡国媛等,2017;张红英等,2008)。本文旨在探清目前东海外海海域内汞对生物体的影响情况,及该海域海产品的食用安全风险。通过对所得数据中总汞含量的差异性,对不同物种的食性、生活栖息水层以及食物链营养级等方面进行分析探讨,为分析东海外海海域生物体内汞含量蓄积差异性现状提供科学依据。
1 实验部分
1.1 仪器与试剂
DMA-80全自动直接测汞分析仪(意大利Mile Stone);电子天平(上海精天电子仪器厂),精确到0.0001 g;Milli-Q超纯水系统(美国Millipore);汞 单 元 素 标 准 溶 液 10 μg·mL-1; 标 准 物 质(GBW10050,地球物理地球化学勘查研究所),汞含量(49±8) μg·kg-1;氧气,纯度 99.99%;硝酸(优级纯)。
1.2 样品采集
本文所分析样品为2018年1-3月由中国水产科学研究院东海水产研究所“东进1号”和“东进2 号”海洋科学调查船在 27°59.790′-29°00.964′N,125°26.018′-126°29.985′E 海区内所采集,调查区域内共设置34个站位,根据其经纬度作图(图1)。本次分析的样品共 22种:白带鱼(Trichiurus lepturus)、鱿鱼(Loligo chinensis)、墨鱼(Octopus vulgaris)、短鳍红娘鱼(Lepidotrigla microptera)、朱红平鲉鱼(Sebastes miniatus)、竹荚鱼(Trachurus japonicus)、黄鲷(Dentex tumifrons)、红虾(Plesionika izumiae)、绿鳍马面鲀(Thamnaconus septentrionalis)、日本海鲂(Zeus faber)、长蛇鲻(Saurida elongata)、白姑鱼(Pennahia argentata)、孔鳐(Okamejei kenojei)、黑鮟鱇(Lophiomus setigerus)、银鲳(Pampus argenteus)、刺鲳(Psenopsis anomala)、蟹类(Brachyura)章鱼(Octopus vulgaris)、黑鱼(Channa argus)、宽纹虎鲨(Heterodontus japonicus)、牙鲆(Paralichthys olivaceus)、日本蟳(Charybdis japonica),总计 104个样本。样本数(N)及取样站位见表1。
1.3 仪器工作条件
干燥温度200 ℃,干燥时间120 s;催化温度650 ℃,催化时间150 s;热分解温度650 ℃,热分解时间150 s,氧气流量350 mL·min-1,输入压力14.5 PSI,输出压力1.3 PSI;测量时间300 s。
1.4 标准曲线及方法检出限
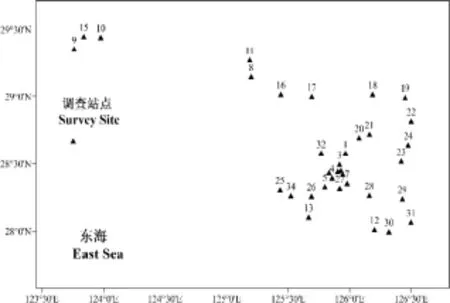
图1 取样站位Fig. 1 Collecting sample stations
用汞标准储备液分别配制低浓度(1、2、5、10、15 μg·L-1)和高浓度(20、30、50、80、100 μg·L-1)两个线性范围的标准曲线。方法检出限的计算以体积分数为1%的硝酸水溶液为测定空白,以3倍的空白标准偏差计算检出限。以吸光度(R)为纵坐标,汞浓度(ng·mL-1)为横坐标,测得结果低浓度标准线性回归方程为y=0.01582015+0.04539960x,R2=0.9976;高浓度标准回归方程为y=-8.877298×10-4+1.003459×10-3x-4.944985×10-6x2,R2=0.9999;本方法的检出限为0.00025 ng,以0.1 g样品量计算,则最低检出浓度为 0.0025 μg·kg-1,表明在1-100 ng范围内线性关系良好。
1.5 方法的准确度和精密度
选用大虾粉(GBW10050)标准参考物质作为质控样品,对其总汞含量进行平行测定,以验证本方法的准确度和精密度,测定结果见表 2。平行样品测定值均在标准物质的定值范围之内,RSD值小于 1%,表明本方法准确度和精密度高,所得结果准确可靠。
1.6 样品测定
汞原子蒸气对波长253.65 nm的共振线具有强烈的特征吸收,并遵循朗伯比尔定律。将称好的样品放入石英样品舟内,仪器自动进样,将样品舟送入干燥分解炉中进行干燥,在高温作用下汞蒸汽从样品中释放出来,再经过装有催化还原剂的石英管,将硫化物、酸性卤化物以及硝化物吸附,将汞还原成汞原子,进入金汞齐化器,对汞进行选择性吸附,此时加热汞齐化器,使吸附的汞以汞蒸气释放出来,随载气(氧气)通过吸收池,在253.65 nm处测量吸收峰高,与标准系列比较定量,最后计算出汞含量。准确称取质量在0.0500-0.1500 g之间的待测样品于样品舟中,样品随自动进样器被带至热解析炉中,样品经过干燥、高温分解、催化还原、齐化富集后等过程之后,软件根据峰高自动计算出汞含量,其中样本量为3,测定结果见表1。
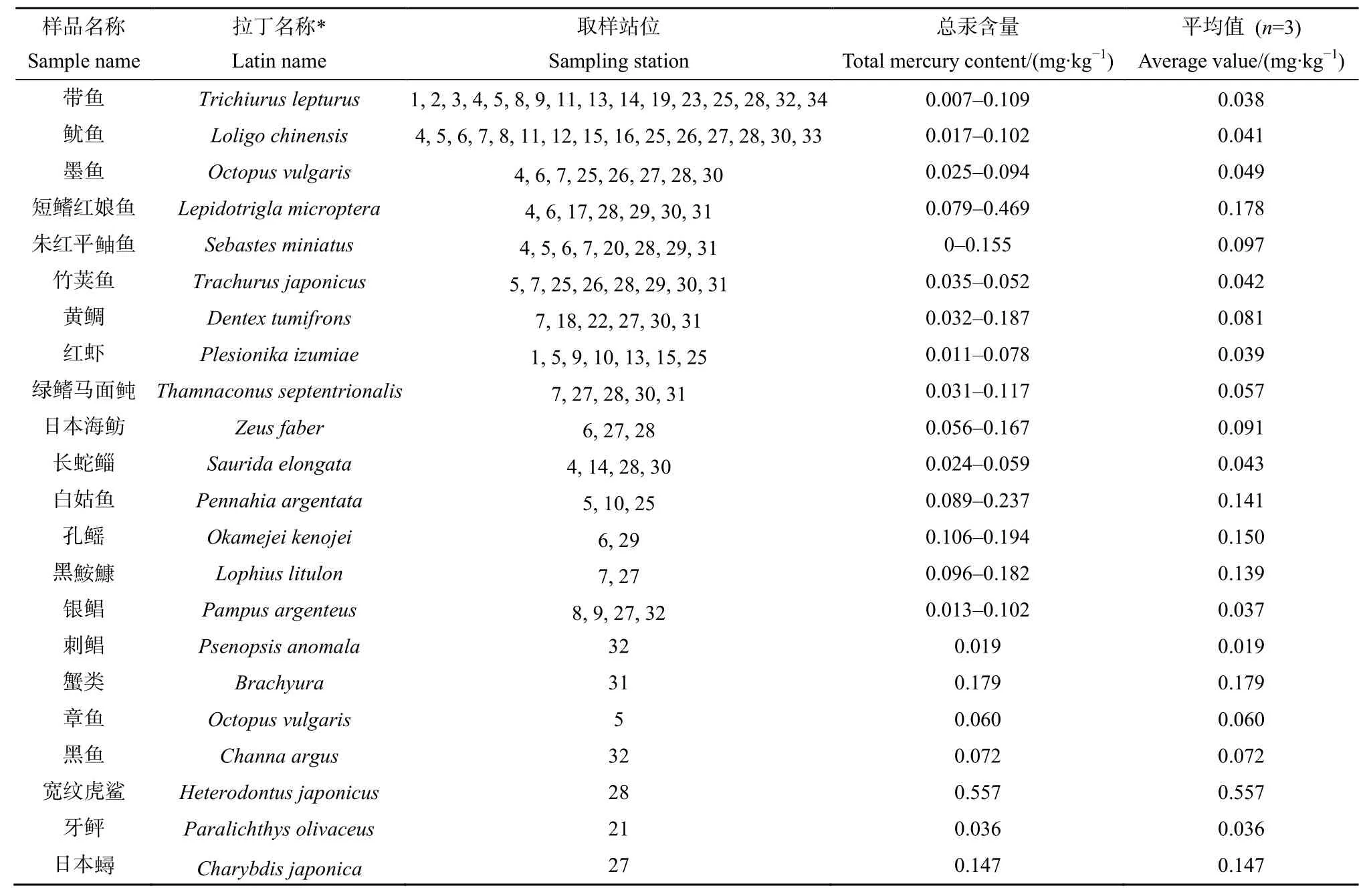
表1 22种生物样本中总汞含量测定结果Table 1 Total mercury content determination of 22 biological samples
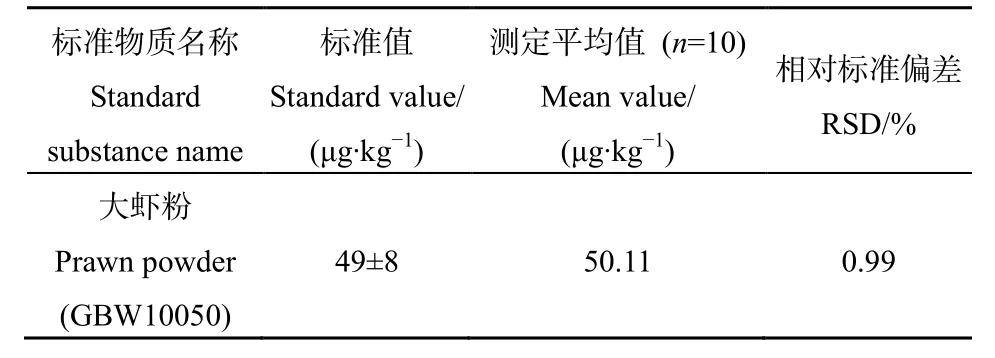
表2 准确度和精密度测定结果Table 2 Measurement results of accuracy and precision
2 结果与讨论
2.1 海洋生物中的总汞含量
中国《食品中污染物限量》(GB2762—2017)规定,鱼(不包括食肉鱼)及其他水产品中甲基汞的限值为 0.5 mg·kg-1,食肉鱼类为 1.0 mg·kg-1,若测得的总汞水平不超过甲基汞限值时,不必测甲基汞。由表1可知,在22种海洋生物104个样本中,总汞含量的变化范围为 0-0.557 mg·kg-1,平均值为0.103 mg·kg-1,均低于该标准污染物限量值,表明东海海域的生物体中汞含量处于安全限值范围内。将样品分别根据其种属、食性、栖息水层进行了分类,见表 3。其中不同种属生物的汞含量如图2所示,甲壳类中汞的变化范围为 0.011-0.179 mg·kg-1,平均值为 0.122 mg·kg-1,头足类中汞的变化范围为 0.017-0.102 mg·kg-1,平均值为 0.050 mg·kg-1;鱼类中汞的变化范围为 0-0.557 mg·kg-1,平均值为 0.111 mg·kg-1。

图2 不同海洋生物总汞含量Fig. 2 Total mercury content of different marine organisms
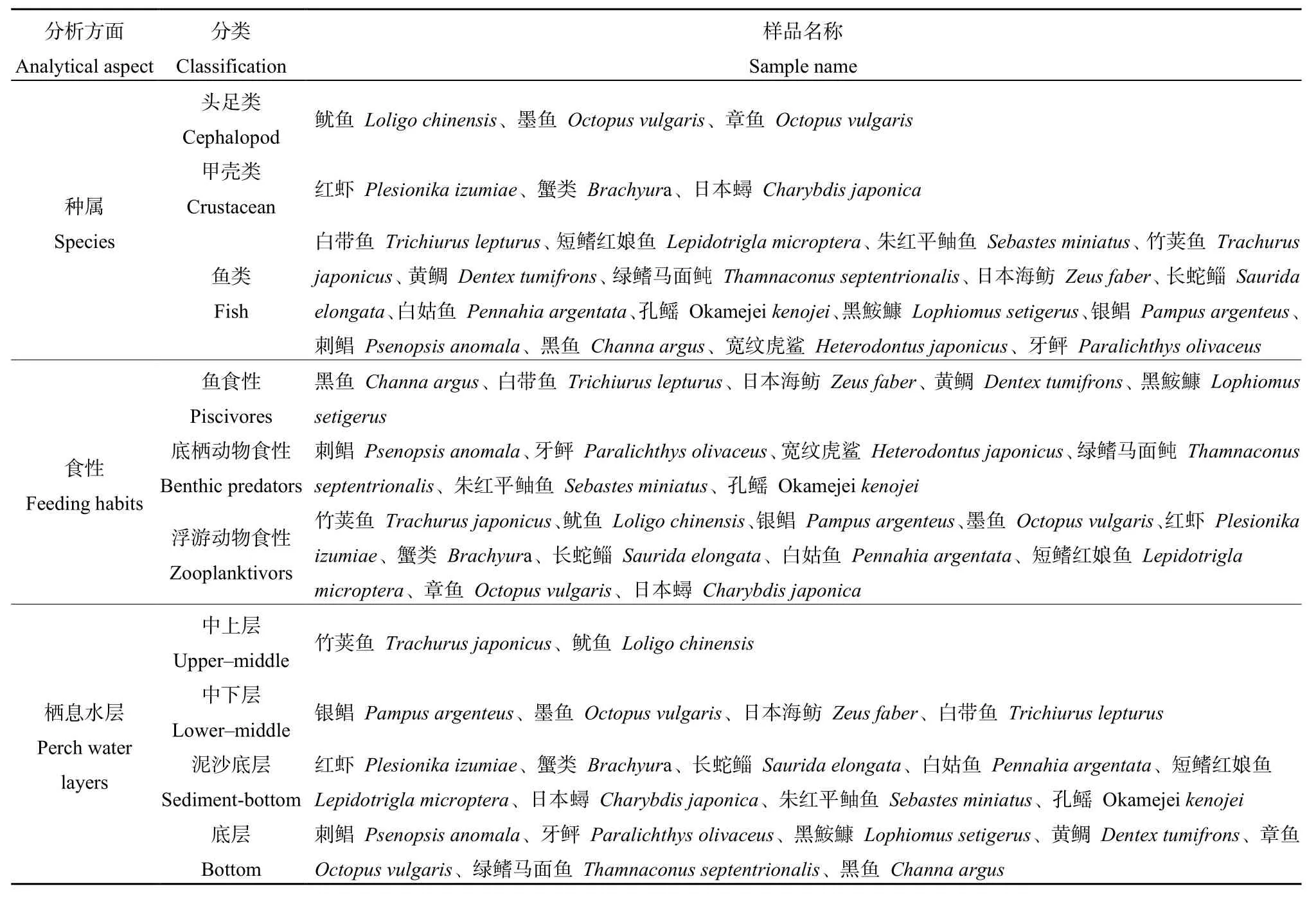
表3 东海海洋生物的分类Table 3 Classification of marine organisms in East China Sea
在鱼类中,虎鲨中汞的含量远远高于其他鱼类,为0.557 mg·kg-1,虽然虎鲨的样本数为1,存在一定的偶然性和误差性,但在确保本方法准确度和精密度可靠的前提下,本数值仍具有一定的代表性和参考性,虎鲨体内汞含量高,一方面是由于虎鲨作为海洋大型杂食性鱼类,处于食物链顶端,食物链结构复杂且较长,加之捕食面广泛,对汞的富集能力强;另一方面,已有研究表明,汞含量水平与鱼体饮食、尺寸大小呈正相关(Teffer et al.,2014),而虎鲨寿命可达10-20年,且成年虎鲨体长可达3-5 m,这可能是虎鲨体内汞含量偏高的重要原因之一。另外,汞含量平均值超过0.1 mg·kg-1的有短鳍红娘鱼、白姑鱼、孔鳐、黑鮟鱇,分别为0.178、0.141、0.150、0.139 mg·kg-1、,远高于其他鱼类(0-0.094 mg·kg-1)。以上结果表明,东海远海海域的甲壳类、头足类、鱼类中汞平均含量高低顺序为甲壳类>鱼类>头足类(图2)。
同一种生物的不同样本间总汞的富集也有明显差异,如所检测的带鱼样总数为 14个,鱿鱼样品总数为15个,总汞变化范围分别为0.007-0.109、0.017-0.102 mg·kg-1,体长、体重的差异是导致汞含量种内差异的重要因素。朱艾嘉等(2014)对黄海多种常见鱼类体内汞含量的种内差异进行研究发现,鱼体肌肉中汞含量与鱼类体长、体重呈显著正相关(P<0.0001)。Storelli et al.(2002)研究发现地中海剑鱼(Xiphias gladius)和蓝鳍金枪鱼(Thunnus thynnus)体内的汞含量与其个体大小显著相关。Walters et al.(2010)指出鱼体的大小与营养级有关,个体大的顶端捕食者体内汞含量最高。此外,鱼类的快速生长能够对体内的汞含量形成生长稀释效应,而体重增长缓慢则有利于汞在鱼体内的积累(Andersen et al.,1997)。因此本研究中带鱼、鱿鱼等鱼体内总汞蓄积差异性可能与其体长、体重有关。
2.2 生物的食性对总汞蓄积的影响
本研究中的海洋生物按食性分类如表3所示,分别为鱼食性鱼类、底栖动物食性鱼类、浮游动物食性鱼类。据统计,浮游生物食性鱼类共 11种,汞的平均变化范围为0.011-0.469 mg·kg-1,平均值为0.093 mg·kg-1;鱼食性鱼类共5种,汞的平均变化范围为 0.007-0.187 mg·kg-1,平均值为 0.084 mg·kg-1;底栖动物食性鱼类共6种,汞的平均变化范围为 0-0.557 mg·kg-1,平均值为 0.153 mg·kg-1(图 3)。通过对各个种类中汞含量平均值的比较,初步得出以下结论:汞含量与生物的食性有关,不同生物体内汞的蓄积水平高低顺序为底栖动物食性鱼类>浮游生物食性鱼类>鱼食性鱼类。
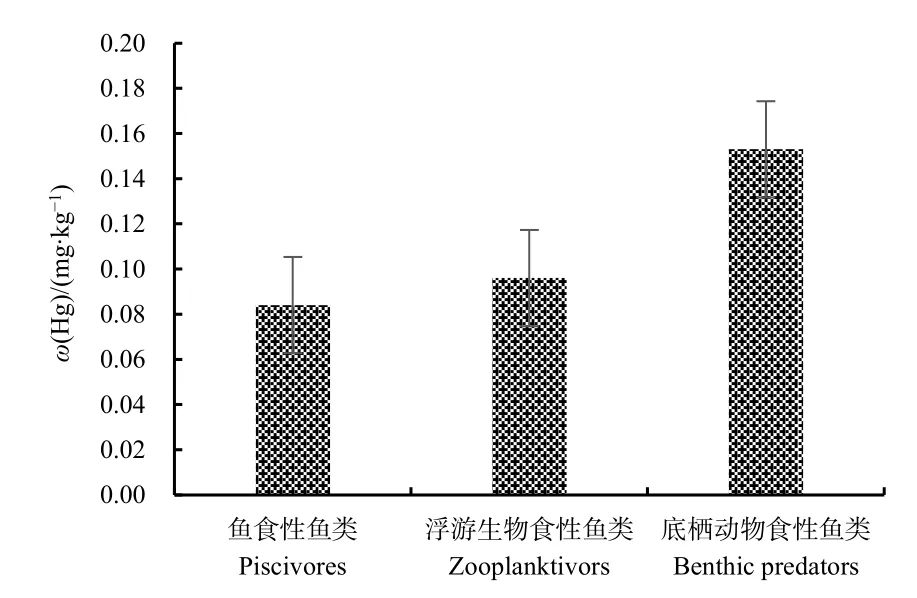
图3 不同食性生物总汞含量Fig. 3 Total mercury content of different diet organisms
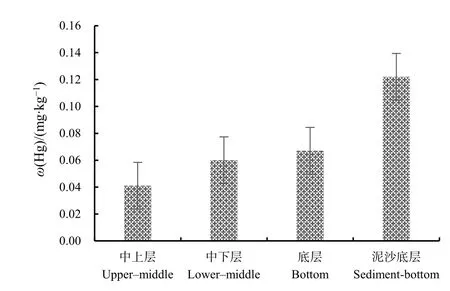
图4 不同栖息水层生物总汞含量Fig. 4 Total mercury content of different habitats
不同生物体内的汞与其食性密切相关。本研究中底栖动物食性的虎鲨,其体内汞含量(0.557 mg·kg-1)明显高于其他品种(均值为 0.083 mg·kg-1);浮游生物摄食类汞含量平均值为 0.093 mg·kg-1,其中蟹类(0.179 mg·kg-1)、白姑鱼(0.141 mg·kg-1)、短鳍红娘鱼(0.178 mg·kg-1)均高于平均值;就鱼类而言,食物中汞的吸收占总汞吸收的90%,Hall et al.(1997)发现鱼类体内汞的积累主要来自食物中的吸收。梅光明等(2016)研究发现,大型肉食鱼类甲基汞含量明显高于一般鱼类,表明汞含量与鱼的食性有很大关系。Teffer et al.(2014)研究结果也表明,鲨鱼、金枪鱼和鲯鳅等生物体内的汞含量与其体型大小、饮食和所处营养级相关。
除此之外,也有很多研究证实,汞在海洋食物链中有放大作用。朱艾嘉等(2014)对黄海常见鱼体内汞含量的研究表明,汞在黄海常见鱼体内有生物放大效应;Coelho et al.(2013)证实了汞在被汞污染的河口地区有显著的放大效应;在食物链中所处营养级越高,对汞放大倍数越高。鱼体中的汞绝大部分是以甲基汞的形式存在(王文雄,2011)。甲基汞在海产品中的富集主要受食物链层级方面因素影响,一般处于食物链上层的鱼类相对于下层的鱼类体内甲基汞质量分数更高(刘永懋等,1996)。虎鲨是典型的海洋大型肉食性鱼类,食性很杂,以无脊椎动物和甲壳类动物为食,处于食物链的高层营养级,因此汞的富集程度高;红虾(0.039 mg·kg-1)、鱿鱼(0.041 mg·kg-1)、墨鱼(0.049 mg·kg-1)等处于食物链的低层级,食性相对简单,汞含量较低,表明汞在海洋生物体内呈现出生物放大效应。
2.3 生活水层对汞含量的影响
本研究发现,鱼类体内总汞含量与鱼类的栖息水层有很大关系,表现为泥沙底层(0.122 mg·kg-1)>底层(0.067 mg·kg-1)>中下层(0.060 mg·kg-1)>中上层(0.041 mg·kg-1)的分布趋势,随着栖息水层的深入,生物体内的汞含量呈上升趋势,如图4所示。各生物栖息水层信息见表3。生活在泥沙底层的鱼类汞的平均值为0.122 mg·kg-1,其中短鳍红娘鱼(0.178 mg·kg-1)、白姑鱼(0.141 mg·kg-1)、孔鳐(0.150 mg·kg-1)等都生活在泥沙底质的海区,并摄食底栖生物,三者检测结果平均值为0.156 mg·kg-1,较栖息于其他底层生物(0.067 mg·kg-1)偏高,这可能是由于汞在海底沉积物表层积聚,导致生活在泥沙底层水体的鱼类体内汞增加。中国沿岸海洋鱼类体内的汞66%-93%为甲基汞(全国海岸带办公室,1989),无机汞由生物与非生物甲基化过程转化成甲基汞,其中又以海底沉积物表层汞的生物甲基化过程为主(Hammerschmidt et al.,2004)。因此生活在泥沙底层的生物体内汞含量较高,而生活在中上层的竹荚鱼(0.042 mg·kg-1)和鱿鱼(0.041 mg·kg-1)平均汞含量仅为生活在泥沙底层鱼体的 1/4左右。Saei-Dehkordi et al.(2010)在2009年对伊朗南部阿巴斯港两种海洋鱼类(栖息水底鱼类和浮游鱼类)Hg含量的调查发现,其Hg含量范围为0.120-0.527 mg·kg-1,而居于水底的鱼类Hg含量大于浮游鱼类中Hg含量(童永彭等,2015)。孙维萍等(2012)研究了浙江沿海经济鱼类体内重金属的残留水平,发现其中鱼类体内的汞质量分数与水层密切相关,生活在中下层的凤鲚高于中上层龙头鱼,与本研究所得结论一致。
3 结论
本研究对东海外海海域生物中汞的蓄积差异性的研究发现:在所分析的样品中,不同生物体之间汞蓄积差异与食性有关,对于不同种类的鱼类而言,表现为底栖动物食性鱼类>浮游生物食性鱼类>鱼食性鱼类;其次,处于食物链上层营养级的种类对汞有一定的富集和放大效应,处于食物链顶端的生物体内汞富集程度远高于底层级的生物;栖息水层方面,鱼体内的汞蓄积差异性与其栖息水层密切相关,表现为泥沙底层>底层>中下层>中上层的分布趋势。在所有品种中,杂食性底栖鱼类如虎鲨中的汞含量远远高于其他品种;泥沙底栖类如短鳍红娘鱼、蟹类中的汞含量也较高,表明生物种类的食性和栖息水层对其体内汞的蓄积差异性影响较大,本研究所分析的样品均低于GB2762—2017对汞的相关限量要求。

