海南山兰米酒酒曲微生物多样性分析*
杨春敏 黄建初 查丽艳
1(广州工商学院,广东广州 510850)2(华南农业大学,广东广州 510642)
山兰米酒是海南黎族人民配制的一种甜米酒,是海南五指山地区最受欢迎的传统酒精饮料。山兰米酒以山兰稻酿造而成,山兰稻是一种生长在山坡上的旱稻,有山兰红米、山兰黑米和山兰糯米3种,酿制山兰米酒主要以糯米为原料。由于山兰米酒在糖化发酵期间以糖化过程为主,其酒精度不高,味道甘醇甜美,酒浆黏稠,乳白色中微微泛黄,入口很有质感。
甜酒曲是酿造甜米酒的糖化发酵剂,其所含微生物种类十分丰富,组成复杂,微生物间的相互作用使酿造的米酒口感独特,香气浓郁。目前海南山兰米酒多为手工作坊酿制,采用传统制作工艺,微生物种类繁多且不稳定,生产控制主要依靠实践经验,温度、用曲量等控制不好,容易产生苦味,导致不同季节不同批次的米酒质量不稳定,因此研究酒曲中微生物种类、数量、代谢作用及微生物间的相互作用就显得极其重要。大量研究发现酒曲中主要有三大类微生物,即霉菌、酵母菌和细菌。高通量测序技术是目前研究微生物多样性中应用最广泛的测序技术,不仅能够快速地分析复杂微生物群落多样性,还能检测到低存在率以及不可培养的微生物,该技术已经广泛应用于发酵豆豉、醋、米酒、肠道微生物、酸奶等生物群落结构研究。
目前关于山兰米酒的研究主要集中在酿造工艺优化及营养成分分析等方面,对其微生物群落多样性研究相对较少。本研究以采集自海南6 个山兰米酒酒厂的酒曲为研究对象,采用IluminaMiseq 高通量测序平台对细菌的16SrDNA 和真菌ITS 区域进行测序,分析海南山兰米酒酒曲的微生物群落多样性,明确优势菌群,为更好地提高山兰米酒品质,推动其产业发展,建立现代化酿酒新工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
海南山兰米酒酒曲样品:由编号为A、B、C、D、E、F 的6 个酒厂提供。
QIAGEN DNA Mini-Kit,购于德国QIAGEN 公司;其他化学试剂,均购于国药集团化学试剂有限公司。
1.2 仪器与设备
5810R 高速冷冻离心机,德国Eppendorf;C1000 型PCR 仪,美国BIO-RAD 公司;电泳仪、电泳槽,北京市六一仪器厂;Gel Doc 型凝胶成像仪,美国BIO-RAD 公司;Miseq 高通量测序仪,美国Ilumina 公司;Agilent 2100 生物分析仪,美国安捷伦公司。
1.3 试验方法
1.3.1 样品总DNA 的提取
将酒曲用研钵粉碎,使用QIAGEN DNA Mini-Kit 试剂盒提取各酒曲样品中所有微生物的总DNA,经1%琼脂糖凝胶电泳检测无明显降解,质量合格。DNA 样品于-20 ℃保存,备用。
1.3.2 PCR 扩增
以1.3.1 得到的总DNA 为模板,对细菌16S rDNA 的V3-V4 区和真菌的ITS 区进行PCR 扩增,具体引物见表1。

表1 细菌、真菌的PCR 扩增引物
1.3.3 PCR 产物的定量、混样及测序
按操作说明使用The Agilent DNA1000Kit 和Agilent2100 生物分析仪对PCR 扩增产物精确定量。将所有样品的扩增产物等浓度混匀至终浓度为100 nmol/L,于IluminaMiseq 高通量测序平台上机分别对样品中的细菌和真菌序列测序。
2 结果与分析
2.1 不同酒厂酒曲样品的Alpha 多样性分析
采用Alpha 多样性指标的Simpson、Shannon、Chao1 和ACE 指数,对采集自6 个不同酒厂的酒曲样品中细菌和真菌的Alpha 多样性进行了比较分析,结果如图1 所示。

图1 不同酒厂酒曲样品的Alpha 多样性比较分析
由图1 可知,从6 个酒厂收集的酒曲样品中,酒厂E 的酒曲样品中细菌群落的Alpha 多样性最高,Simpson、Shannon、Chao1 和ACE 指数都高于其他5 个酒厂,说明其细菌群落的物种丰富度及均匀度都较高。酒厂C 的酒曲样品中真菌的Chao1 以及ACE 指数均明显高于其余5 个酒厂(图1GH),说明其酒曲样品中真菌物种丰富度较高;而其细菌的Chao1 以及ACE 指数却比较小(图1EF),说明酒曲样品中细菌物种丰富度较低。这些结果表明,不同酒厂收集到的酒曲真菌和细菌Alpha 多样性存在差异。
2.2 不同酒厂酒曲样品的优势微生物组成及其相关性
通过对各酒曲样品中的主要微生物进行定量分析发现,细菌菌属中片球菌(Pediococcus)(39.20%)、肠杆菌属(Enterobacter)(16.06%)、魏斯氏菌Weissella(8.83%)、Klebsiella(5.04%)、Escherichia-Shigella(3.64%)、Pelomonas(1.65%)、坂崎肠杆菌Cronobacter(1.53%)、Ochrobactrum(1.35%)和Ralstonia(1.04%)的含量都超过了1%(图2A),因此,将这些定义为核心微生物群。其中,片球菌(Pediococcus)数量最多,为39.2%。在真菌层面上,含量从高到低位列前十位的分别是:根霉(Rhizopus)、假丝酵母属(Candida)、Bullera、Simplicillium、曲霉属(Aspergillus)、Gibberella、Phaeoacremonium、Archae orhizomyces、Acremonium 和Chaetomium,其中根霉(Rhizopus)为样品中的绝对优势菌属,相对含量大于35%(图2C)。同时,基于Spearman 等级相关系数,对酒曲样品中细菌及真菌的优势菌属进行了相关性分析,在细菌层面上,片球菌(Pediococcus)与其他菌属之间呈现负相关,Enterobacter 与Klebsiella 呈明显正相关(图2B),在真菌层面上,Bullera 与假丝酵母属(Candida)正相关性较强,与Gibberella 则呈明显负相关(图2D)。

图2 酒曲样品中优势微生物组成
2.3 不同酒厂酒曲样品的Beta 多样性分析
采用基于UnweightedUnifrac Distance 和Weighted Unifrac Distance 的PCoA 分析图谱分别对酒曲样品进行了细菌和真菌层面上的Beta 多样性分析,如下页图3 所示。代表酒厂B 和C 细菌群落的点均能较好的与其他酒厂区分开,结合表2 可知,酒厂B和C 的细菌群落结构与酒厂D、E、F 均有显著差异,p<0.000 1,而酒厂A、D、E、F 的细菌群落混杂程度较高,差异不显著。从真菌层面来看,酒曲样品中真菌的群落结构差异小于细菌,各样品点的混杂程度较高,结合表3,酒厂A 的真菌群落结构与B 和D 差异显著。
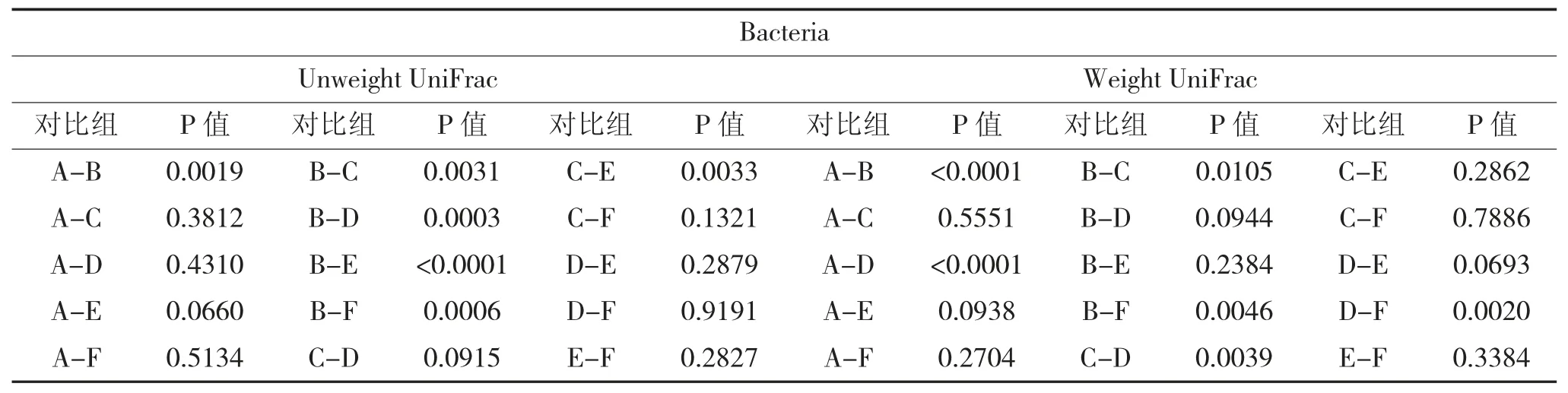
表2 不同酒厂的酒曲样品基于Unweight UniFrac PC1 及Weight UniFrac PC1 的P 值(细菌)

表3 不同酒厂的酒曲样品基于Unweight UniFrac PC1 及Weight UniFrac PC1 的P 值(真菌)
2.4 细化差异性菌属
为进一步研究不同酒厂的酒曲样品在属水平上的差异性,选取了p<0.05 的菌属作热图(图4)。在细菌层面上,酒厂B 和C 酒曲样品中Weissella、Bacillis 及Pantoea 含量明显高于其他组,而Cronobacter、Enterobacter、Klebsiella 及Escherichia-Shigella 含量明显低于其他组。同时发现6 个酒厂的酒曲样品中Pediococcus 含量都特别高。在真菌层面上,酒厂E 的Wicherhamomyces 及Candida 含量明显高于其他组,而酒厂B 的Mucor 含量明显高于其他组,Candida 含量明显低于其他组。同时,Bullera 在6 个酒厂酒曲中含量都比较高。

图4 属水平上微生物差异性
3 结论
海南山兰米酒酒曲中细菌和真菌组成较为丰富,真菌主要有根霉属(Rhizopus)、假丝酵母属(Candida)、Bullera、Simplicillium、曲霉属(Aspergillus)、Gibberella,其中根霉属是酒曲中真菌的优势菌属,这与泰国甜酒和陕北传统米酒一致;细菌层面主要有片球菌(Pediococcus)、肠杆菌属(Enterobacter)、魏斯氏菌Weissella、Klebsiella 等,其中片球菌含量最多。通过酒曲的细菌和真菌的Alpha 和Beta 多样性分析以及聚类分析,酒厂E 的细菌群落物种丰富度和均匀度都比较高,而酒厂C 的细菌群落丰富度较低,真菌群落多样性较高;通过热图发现6 个酒厂的酒曲中片球菌(Pediococcus)、Bullera 含量普遍都比较高,这可能与山兰米酒的发酵密切相关;酒厂B 和C的细菌群落结构和其他酒厂具有显著差异,酒曲某些菌属Weissella、Bacillis、Cronobacter、Enterobacter、Klebsiella 等含量存在一致性,可以进一步深入研究。本研究揭示了山兰米酒细菌和真菌群落组成和不同酒厂酒曲菌属的差异,明确酒曲中的优势菌种,为山兰米酒工业化生产提供理论指导。
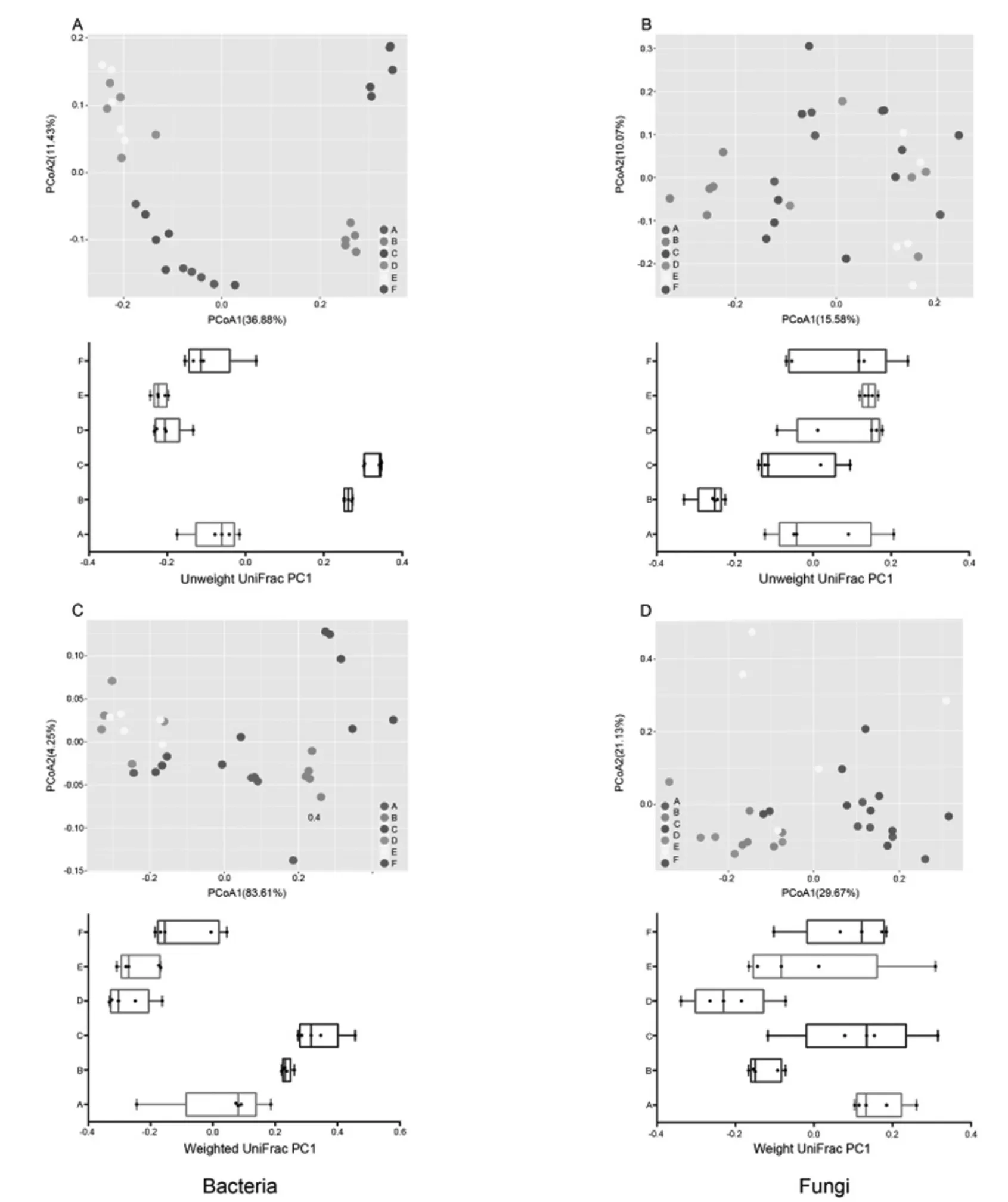
图3 酒曲样品的Beta 多样性

