重组α-1,3-葡萄糖苷酶的毕赤酵母表达及发酵优化
王晓燕 江 波 张 涛
(江南大学国家重点实验室,江苏无锡 214122)
α-葡萄糖苷酶(EC 3.2.1.20),可从麦芽低聚糖、异麦芽糖、α-葡聚糖等底物的非还原末端释放α-葡萄糖,或通过转糖基作用将葡萄糖基从底物转移至受体形成相应非发酵性的低聚糖或糖脂、糖肽等。在自然界中分布广泛,种类繁多,几乎在所有的生命体中皆有发现。根据氨基酸分类系统,α-葡萄糖苷酶分属于5 个糖苷水解酶家族:GH4,GH13,GH31,GH63 和GH97,大多α-葡萄糖苷酶均属于GH13 和GH31 家族。α-葡萄糖苷酶的应用研究主要集中在制备低聚异麦芽糖等方面,近年来,随着对α-1,3 糖苷键具有高度选择性的α-葡萄糖苷酶的发现,有报道表明可利用α-葡萄糖苷酶催化麦芽低聚糖等制备黑曲霉低聚糖(Nigerooligosaccharides,NOS)。
黑曲霉低聚糖是一类分子中含有α-1,3 糖苷键的新型功能性低聚糖,主要包括黑曲霉糖(Nigerose)、黑曲霉糖基葡萄糖(Nigerosylglucose,NOG)和黑曲霉糖基麦芽低聚糖(Nigerosyl matooligosaccharides,NMS)等。黑曲霉糖天然存在于清酒、豆酱等发酵型产品中,含量较低,难以进行大规模的提取工作,而对于聚合度更高的黑曲霉低聚糖,在自然界中几乎不存在,因此黑曲霉低聚糖的生产方法主要有化学合成、多糖水解法和糖基转移法3 种。据报道,黑曲霉低聚糖不仅具有一般功能性低聚糖所共有的热量低、抗龋齿、促进双歧杆菌增殖等生理功能,还具有免疫激活、改善风味、抑制色素褪色等多种作用,可广泛应用于医学、食品等多个行业。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及质粒
细菌克隆宿主E.coli DH5α、真菌表达宿主P.pastoris GS115 均为本实验室保藏,含有源自Acremonium sp.S4G13 α-1,3-葡萄糖苷酶基因的重组质粒pPIC9K 为委托上海捷瑞生物工程公司合成。
1.1.2 培养基
LB 培养基(g/L):酵母提取物10 g,胰蛋白胨5 g,NaCl 10 g;MD 培养基(g/L):YNB 13.4,生物素4×10-4,葡萄糖20g,琼脂15 g;YPD 培养基(g/L):酵母提取物10 g,蛋白胨20 g,葡萄糖20 g;BMGY 培养基(g/L):YNB 13.4 mL,生物素4×10-4,甘油30 mL,0.1 mol/L 磷酸钾缓冲液;BMMY培养基(g/L):YNB 13.4 mL,生物素4×10-4,甲醇0.5%,0.1 mol/L 磷酸钾缓冲液。
1.1.3 主要试剂
黑曲霉低聚糖、麦芽三糖标准品,购自Sigama公司;蛋白胨、酵母粉、YNB、生物素、G418、卡那霉素,均购自上海生工生物工程公司;麦芽糖、葡萄糖、磷酸氢二钠、磷酸二氢钠、甘油等,均为国产分析纯试剂,购自国药集团化学试剂公司;DL 10000、15000 DNA Marker、BglⅡ限制性内切酶、4S Green Plus 无毒核酸染料,购自大连宝生物工程有限公司;质粒小量制备试剂盒,购自上海捷瑞生物工程有限公司。
1.2 主要设备及仪器
GI54DWS 高压灭菌锅,厦门致微仪器有限公司,THZ-100 恒温培养摇床,上海一恒科技有限公司;Centrifuge 5804R 高速冷冻离心机、Authorized Thermal Cycler PCR 仪、电转仪、电转杯,德国Eppendorf 公司;Waters e2695 型高效液相色谱仪,美国Waters 公司;Asahipak NH2P-50 4E 氨基柱、Shodex 示差折光检测器,日本Shodex 公司;冷冻真空干燥机,Labconco 公司。
1.3 P.pastoris GS115 重组菌的构建
1.3.1 重组质粒pPIC9K-ALG 的构建
通过NCBI 基因文库,查找到来源于Acremonium sp.S4G13 的编码α-葡萄糖苷酶的基因,并将此基因片段委托上海捷瑞生物工程有限公司进行合成,在该基因的5' 和3' 末端分别引入EcoR I 和Not I2 个限制性酶切位点,将基因片段连接入酵母表达载体pPIC9K,合成重组质粒pPIC9K-AGL。
1.3.2 重组质粒的转化
重组质粒pPIC9K-agl 经使用BglⅡ快切酶线性化后,加入P.pastoris GS115 感受态细胞中以1.5 kV电压进行电转化。电转液在30℃条件下经1 h~2 h孵育后涂布于MD 平板,30 ℃倒置培养2 d~3 d直至长出单菌落。挑选MD 平板上的单菌落依次接种至0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、3.0 mg/mL的YPD-G418 平板上,30℃倒置培养2 d~3 d。同时转化pPIC9K 空质粒作为对照。
1.3.3 重组菌的培养及诱导产酶
1.3.3.1 种子培养
将MD 平板上的重组酵母单菌落接种到5 mL YPD 试管培养基中,30 ℃、200 r/min 条件下培养16 h。
1.3.3.2 扩大培养
以体积浓度2%的接种量将上述菌液接入装液量为50 mL BMGY 培养基的250 mL 锥形瓶中,30 ℃、200 r/min 条件下培养24 h。
1.3.3.3 诱导培养
离心收集上述菌体,在无菌条件下将其全部转接入装液量为50 mL BMMY 培养基的250 mL 锥形瓶中,30 ℃、200 r/min 条件下培养120 h,每24 h补加0.5%甲醇。
1.3.4 酶活测定方法及定义
将0.9 mL 的100 g/L 麦芽糖溶液与0.1 mL 的粗酶液在50 mmol/L、pH 7.0 磷酸缓冲液体系中充分混匀,55 ℃下反应12 h,沸水浴10 min 终止反应。反应液经树脂除盐及微孔过滤后经HPLC 检测,用归一化法(黑曲霉糖基葡萄糖占总糖的百分比)计算黑曲霉糖基葡萄糖的转化率,以葡萄糖作为内标计算黑曲霉糖基葡萄糖的生成量,计算酶活。
HPLC 检测条件:Waters e2695 型高效液相色谱仪,色谱柱AsahipakNH2P-504E(4.6mm×250mm),示差折光检测器,流动相为乙腈∶水=75 ∶25(v/v),流速1 mL/min,柱温30 ℃。
酶活定义:在上述反应条件下,每小时生成1 μmol 的黑曲霉糖基葡萄糖所需酶量为一个酶活单位(1 U)。
1.4 重组P.pastoris GS115 产酶条件的优化
1.4.1 接种量对重组P.pastoris GS115 生长阶段的影响
重组菌活化后,分别以1%、3%、6%、10%、15%的接种量接入50 mL/250 mL BMGY 培养基中,30 ℃、200 r/min 培养,每隔3 h 取样,测定OD600监测重组菌的生长状况。
1.4.2 碳源对重组P.pastoris GS115 生长阶段的影响
重组菌活化后,以10%的接种量分别接种至甘油比例为1%、2%、3%、4%、5%的50 mL/250 mL BMGY 培养基中,30 ℃、200 r/min 培养,每隔3 h取样,测定OD600 监测重组菌的生长状况。
1.4.3 初始pH 对重组P.pastoris GS115 生长阶段的影响
重组菌活化后,以10%的接种量分别接种到pH 值为5.0、6.0、7.0、8.0 的50 mL/250 mL BMGY培养基中,30 ℃、200 r/min 培养,每隔3 h 取样,测定OD600 监测重组菌的生长状况。
1.4.4 初始甲醇体积浓度对重组P.pastoris GS115 诱导阶段的影响
无菌条件下,将BMGY 培养基中的全部菌体转接入50 mL/250 mL BMMY 培养基中,初始甲醇体积浓度分别为0.5%、1%、2%、3%、4%、5%,30 ℃、200 r/min 培养,24 h 后取样,测定酶活和菌体干重。
1.4.5 补加甲醇量对重组P.pastoris GS115 诱导阶段的影响
无菌条件下,将BMGY 培养基中的全部菌体转接入甲醇初始体积浓度为1%的50 mL/250 mL BMMY 培养基中,每隔24 h 分别补加比例为0.25%、0.5%、1.0%、1.5%、2.0%、2.5%的100%甲醇,30 ℃、200 r/min 培养,每隔24 h 取样,测定酶活和菌体干重。
1.4.6 装液量对重组P.pastoris GS115 诱导阶段的影响
无菌条件下,将BMGY 培养基中的全部菌体转接入装液量分别10%、20%、30%、40%(250 mL锥形瓶计)的BMMY 培养基中,30 ℃、200 r/min培养,每隔24 h 取样,测定酶活和菌体干重。
1.4.7 诱导温度对重组P.pastoris GS115 诱导阶段的影响
无菌条件下,将BMGY 培养基中的全部菌体转接入装液量为20%的BMMY 培养基中,分别在25 ℃、28 ℃、30 ℃条件下诱导,每隔24 h 取样,测定酶活和菌体干重。
1.4.8 山梨醇添加量对重组P.pastoris GS115 诱导阶段的影响
无菌条件下,将BMGY 培养基中的全部菌体转接入山梨醇添加量分别为3 g/L、6 g/L、9 g/L、12 g/L 的BMMY 培养基中,25 ℃条件下诱导,培养144 h 后取样,测定酶活和菌体干重。
2 结果与分析
2.1 高拷贝转化菌P.pastoris GS115 的筛选
首先通过不含组氨酸的基本培养基MD 对转化子进行初筛,未转化的宿主P.pastoris GS115 在组氨酸脱氢酶位点(His4)有突变,不能在此平板上生长,只有整合成功的重组P.pastoris GS115 才能在MD 平板上生长。
为提高筛选效率,得到高拷贝转化子,通过YPD-G418 平板进行复筛。收集MD 平板上的阳性转化子,依次经0.25 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、3.0 mg/mL 的G418 平板进行梯度筛选。
经过多次转化试验后,分别从2.0 mg/mL、3.0 mg/mL 的G418 抗性平板上挑取20 个转化子,依次编 码 为PKAGL-2-1~PKAGL-2-20,PKAGL-3-1~PKAGL-3-20。活化后进行摇床诱导培养,96 h 后取样进行酶反应:以100 g/L 麦芽糖(50 mmol/L,pH 7.0 的磷酸缓冲液配制)为底物在45 ℃反应6 h,沸水浴10 min 灭酶。经HPLC 进样检测后,因产物黑曲霉糖转化率较低,难以进行准确定量,而在前期反应阶段中,黑曲霉糖的转化率与葡萄糖的转化率呈正相关,因此可简单的以体系中检测到的葡萄糖转化率作为筛选高拷贝转化子的相对指标,结果如下页表1 所示,选择菌株PKAGL3-14继续进行后续试验。
2.2 重组P.pastoris GS115 产酶条件的研究
毕赤酵母的发酵采取分阶段培养,第一阶段以甘油为碳源,主要目的是促进菌体生长,实现菌体大量增殖,为后期发酵阶段做准备,根据Invitrogen的毕赤酵母操作手册,这一阶段培养温度一般设为30 ℃,无需优化,但其他影响因素例如接种量、碳源浓度、初始pH 等对菌体生长的影响需要做进一步的研究;第二阶段是甲醇诱导表达阶段,此过程中,初始甲醇体积浓度、甲醇补加量、诱导温度、转接量、多碳源补充等因素均会对毕赤酵母的生长和发酵产生不同程度的影响,需要逐一进行研究。
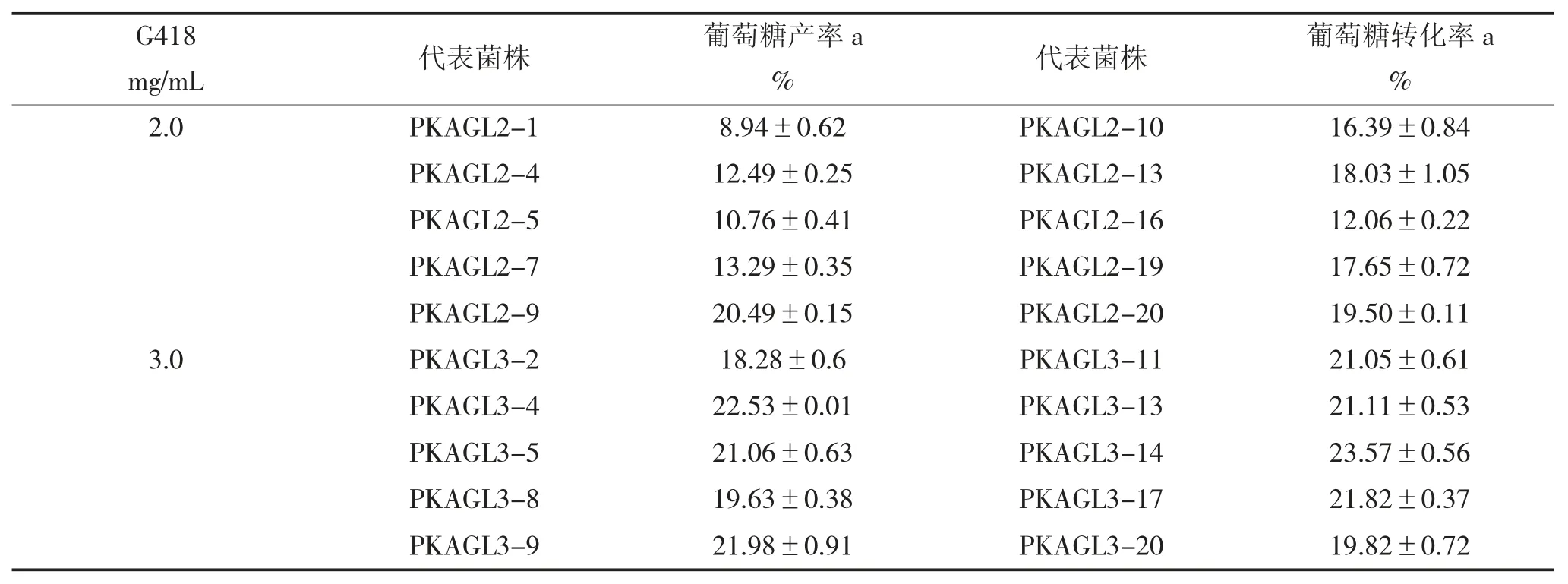
表1 AGL 基因高拷贝重组毕赤酵母的筛选
培养前期筛选的高拷贝转化子PKAGL3-14,定时取样测定酶活和菌体生长量,绘制该重组菌生长阶段的生长曲线和诱导阶段的发酵曲线,见图1。由图1 可知,该重组菌的发酵周期较长,在转接到发酵培养基的前2 天,菌体处于适应阶段,产酶量为0,之后随着发酵时间延长,酶活逐渐增加,在第7 天达到最高值1.22 U/mL。
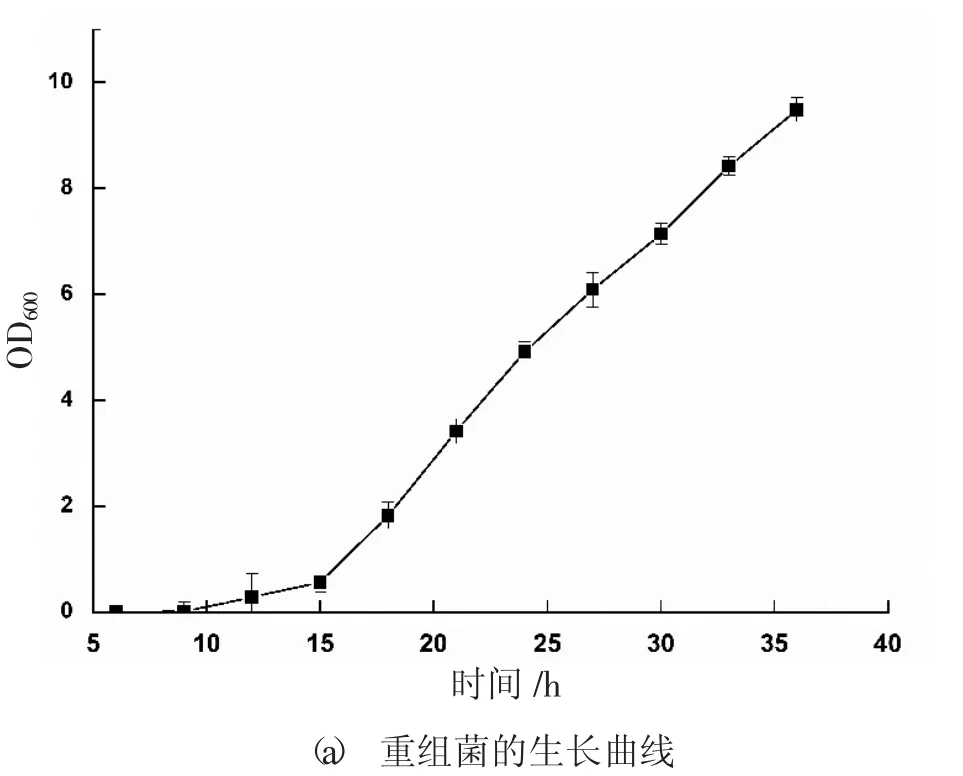

图1 重组菌生长及发酵曲线
2.2.1 接种量对重组P.pastoris GS115 生长的影响
对于一个特定的生长周期,接种量过小会延缓菌株到达对数期的时间,从而延长整个发酵周期,过大的接种量则会在短时间内消耗掉培养基中营养成分。不同接种量对重组毕赤酵母生长的影响结果见下页图2。
由图2 可知,培养前2 h,菌体生长缓慢,处于延滞期;12 h~30 h 期间,生长速度均持续加快,处于指数增长阶段,该阶段的菌体适宜于转接到发酵培养基进行诱导培养;30 h 过后,1%、3%、6%接种量菌体生长速度仍处于对数增长期,10%、15%接种量的菌体生长增速减缓,即将过渡到稳定期。因此,选取10%为最适接种量。
2.2.2 甘油含量对重组P.pastoris GS115 生长的影响

图2 不同接种量对重组毕赤酵母生长的影响
碳是微生物正常生命活动所必需的元素,能为微生物生长提供碳元素的营养物质均称为碳源,一方面,碳源可以为微生物的碳架构建以及细胞生长提供碳成分,另一方面,也可以为微生物的生命活动提供能量。
甘油作为酵母生长阶段的唯一碳源,是影响菌体生长的关键因素。将重组菌接种至甘油含量不同的BMMY 培养基中,每隔3 h 取样检测该重组菌的生长状况,测定结果见图3。

图3 不同甘油浓度对重组毕赤酵母生长的影响
由图3 可知,在开始阶段,甘油消耗较少,不同含量均能满足菌体生长的需要,因此对菌体量影响较小,之后随着时间延长,差异逐渐明显。甘油含量1%的培养基中菌体生长速度最慢,也最早进入平缓期,说明少量的甘油被快速消耗,后期已不能满足菌体生长需要;含量3%的培养基中菌体生长速度最快,甘油含量2%、4%、5%的培养基中菌体生长趋势差别不大,说明过高的碳源含量一方面会对菌体造成负担,延缓它的生长趋势,另一方面也会增加经济成本,因此,选取3%为最适甘油含量。
2.2.3 初始pH 值对重组P.pastoris GS115 生长的影响
微生物所处环境的酸碱度对其生长和繁殖有很大的影响,一方面,pH 可以通过激活或抑制某些特定酶的活性从而改变菌体的代谢途径,进而影响到菌体的生长;另一方面,pH 值可以通过改变细胞膜表面所带电荷的状态从而改变细胞膜的通透性,进而影响到菌体对营养物质的吸收利用以及代谢产物的排放等;此外,pH 还可以通过改变溶液中某些物质的离子化程度进而影响到菌体对该物质的吸收。
重组毕赤酵母菌在初始pH 值不同的BMMY 培养基中生长状况如图4 所示。

图4 初始pH 值对重组毕赤酵母生长的影响
由图4 可知,当初始pH 值为6.0 时,菌体生长状态最好,pH 5.0 和7.0 条件下对菌体生长状况影响较小,菌体生长量略有下降,但偏碱性环境(pH 8.0 和9.0)不适于菌体生长,生长量大幅度下降,说明菌体更偏好在弱酸性环境中生长,因此,选择pH 6.0 为重组毕赤酵母生长阶段的初始pH值。
通过对毕赤酵母生长阶段影响因素的研究,确定了最佳的生长阶段培养条件为:接种量10%,碳源(甘油)含量3%,初始pH 值6.0。为进一步确定合适转接到诱导培养基BMMY 的种龄,在上述最优培养条件下,测定了菌体在BMGY 培养基中的生长曲线,如图5 所示。

图5 重组毕赤酵母的生长曲线
由图5 可知,在发酵前6 h,菌体生长较慢,没有明显增长,为延滞期;6~24 h 期间,菌体生长迅速,呈指数增长,为对数期;24 h 以后,菌体量基本维持恒定,菌体生长进入了稳定期。因此,选取培养24 h 的菌体转接入后续BMMY 培养基进行发酵培养。
2.2.4 初始甲醇体积浓度对重组P.pastoris GS115 产酶的影响
在毕赤酵母的发酵过程中,甲醇既是碳源又是诱导剂,当菌体由生长阶段过渡到发酵阶段时,需要对含有甲醇的生长环境进行适应,因此,确定合适的甲醇初始体积浓度至关重要,过低会使菌体处于饥饿状态,延缓菌体的生长,不能达到足够的诱导效果,过高会对菌体产生毒害作用,抑制醇氧化酶的活性从而影响目的蛋白的表达甚至使菌体死亡。
初始甲酵体积浓度对α-葡萄糖苷酶的影响见图6。
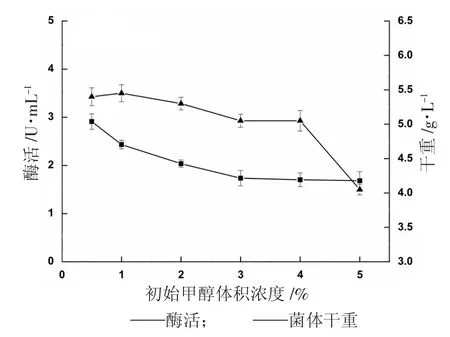
图6 初始甲醇浓度对产α-葡萄糖苷酶的影响
图6 反映了在甲醇初始浓度不同的BMMY 培养基中培养重组菌24 h 后的产酶情况,初始甲醇体积浓度1%的条件下,发酵24 h 酶活为2.912 U/mL,之后随着甲醇体积浓度的升高而降低,当甲醇体积浓度为5%时,酶活已降低了42%,但菌体量之间差异不超过10%,说明在诱导开始阶段,菌体还处于适应期,1%的甲醇已能满足生长和发酵产酶的需要,过高反而会影响目的蛋白的表达,因此,甲醇初始体积浓度选定为1%。
2.2.5 补加甲醇量对重组P.pastorisGS115 产酶的影响
随着发酵的持续进行,初始添加的甲醇被不断消耗,因此需要每隔24 h 补加一定量的甲醇,当补加量在0.25%~2.5%范围内时,结果如图7 所示。当补加甲醇量为0.5%时,发酵96 h 酶活达到最高4.301 U/mL,补加量低于0.5%时,甲醇无法同时完全满足菌体生长和诱导产酶的需求量,因此,虽然变化趋势相同,但所能达到的最高酶活有所差异,当甲醇体积浓度高于0.5%时,会在更短的时间内达到产酶的最大值,但由于过剩甲醇对于菌体的损伤作用,反而影响了目的蛋白的表达。

图7 不同浓度甲醇补加量对产α-葡萄糖苷酶的影响
2.2.6 装液量对重组P.pastoris GS115 产酶的影响
在摇瓶培养中,不同体积的装液量会导致溶氧水平的差异,装液量越少,传氧系数越大。重组毕赤酵母的发酵过程需要足够的氧气激活体内的过氧化氢酶体,进而诱导外源重组蛋白的表达,本试验研究了不同装液量条件下对菌体产酶的影响,结果如图8 所示,氧气含量对重组菌发酵酶活有显著的影响,装液量逐渐加大时培养基中氧气含量逐渐减少,菌体产酶效率降低,装液量小于20%时,菌体产酶较少,可能是因为菌体将大部分能量用于自身繁殖所致。装液量大于20%时,氧气含量不足,菌体生长与繁殖受到影响,产酶效率也很低;当装液量为20%时,发酵酶活达到最高,为4.442 U/mL。因此,选取20%的装液量为最适装液量。

图8 装液量对产α-葡萄糖苷酶的影响
2.2.7 诱导温度对重组P.pastoris GS115 产酶的影响
相较于最适生长温度30 ℃,已有多项研究表明,低温有利于酵母重组外源蛋白的分泌表达,低温对其产酶的影响主要分为几个方面:减轻甲醇对细胞的损伤作用,增加细胞存活率;延长目的蛋白在内质网中的滞留时间,使得到更好的加工从而增加目的蛋白的正确折叠率;降低胞内蛋白的活性,减少对目的蛋白的降解;促进毕赤酵母自身的物质和能量代谢,提高目的蛋白的表达速率;提高了胞内AOX 基因的活性,进而增加了甲醇的代谢速率,提升了目的蛋白的表达效率。

图9 温度对产α-葡萄糖苷酶的影响
为提升目的蛋白的表达效率,本试验设置了25 ℃、28 ℃、30 ℃3 个梯度进行诱导表达,结果如图9 所示。温度的降低虽然延长了发酵过程中到达最高酶活的时间,但同时也提升了外源蛋白的表达效率,在25 ℃条件下诱导120 h,酶活达到最高值4.782 U/mL。此外,28 ℃条件下的产酶效果与25 ℃相比没有明显区别,因此若应用于工业生产,为降低成本,只需适当降低温度即可。
2.2.8 山梨醇添加量对重组P.pastoris GS115 产酶的影响
在毕赤酵母诱导阶段,甲醇同时作为碳源和诱导剂,使得诱导阶段酵母菌生长速率较低,因此可以考虑采用复合碳源的方式提高菌体生长速度,加快产酶速率。据报道,对于Muts 型重组子,山梨醇不会对AOX 基因造成抑制,不会抑制醇氧化酶的表达,可用作甲醇诱导期的共同碳源,促进毕赤酵母的生长,提高细胞活力,增强甲醇诱导的效果,减轻甲醇以及代谢中有毒副产物对菌体的毒性作用,最终达到促进外源蛋白表达的目的。
山梨醇添加量对产α-葡萄糖苷酶的影响见图10。

图10 山梨醇添加量对产α-葡萄糖苷酶的影响
由图10 可知,向诱导培养基中添加不同量的山梨醇,均可以提升发酵液中重组α-葡萄糖苷酶的表达量,当添加量为6 g/L 时,重组α-葡萄糖苷酶酶活达到最高值7.80 U/mL,但当进一步加大山梨醇的添加量时,过多的山梨醇使得发酵液的渗透压上升,阻碍了菌体的正常生长与代谢产酶,使得酶活下降。因此,山梨醇的最适添加量为6 g/L。
3 结论
本研究实现了重组α-1,3-葡萄糖苷酶的毕赤酵母胞外表达,与其他表达系统相比,毕赤酵母表达系统具有自身表达蛋白简单、操作简便以及遗传稳定等特性。此外,通过单因素试验对培养过程中接种量、碳源浓度、初始pH、培养温度以及诱导过程中初始甲醇添加量、甲醇补加量、诱导温度、装液量等条件进行了优化,上清液中α-1,3-葡萄糖苷酶酶活由1.22 U/mL 提升至7.8 U/mL,提升了5.4 倍。目前关于α-1,3-葡萄糖苷酶的工程菌表达的报道还比较少,本试验为相关方面的研究提供了一定的数据。

