关于摩尔反应吉布斯自由能与反应进度关系的讨论
沈玉龙,杨笑春,刘立华
关于摩尔反应吉布斯自由能与反应进度关系的讨论
沈玉龙,杨笑春,刘立华
(唐山师范学院 化学系,河北 唐山 063000)
以简单的理想气体反应N2O4(g)2NO2(g)为例,通过定量和图示的方法,讨论了反应系统的总吉布斯自由能和摩尔反应吉布斯自由能随反应进度的变化,能促进学生深入地理解摩尔反应吉布斯自由能的涵义。
摩尔反应吉布斯自由能;吉布斯自由能;反应进度
摩尔反应吉布斯自由能是判断化学反应变化方向和反应是否达到平衡的重要判据。在介绍摩尔反应吉布斯自由能时,通常采用物理化学教材[1-4]普遍使用的反应系统的总吉布斯自由能与反应进度的关系曲线来进行讲解,但在教学实践中发现学生对摩尔反应吉布斯自由能的物理意义及其与反应系统的总吉布斯自由能的区别存在困惑。
本文以简单的理想气体反应为例对相关的教学内容进行教学设计,通过讨论理想气体反应系统中反应物化学势、生成物化学势、总吉布斯自由能、摩尔反应吉布斯自由能与反应进度的关系等内容[5,6],以促使学生深入理解摩尔反应吉布斯自由能的物理意义。
1 化学反应系统的描述
为方便起见,以简单的气体反应
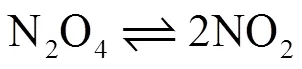
为例进行讨论。设想该反应在温度=298.15 K、压力=100 kPa的条件下进行。由于反应压力较低,N2O4、NO2气体均按理想气体处理。
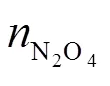
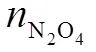
表1 和与的关系
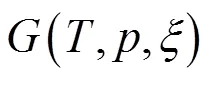
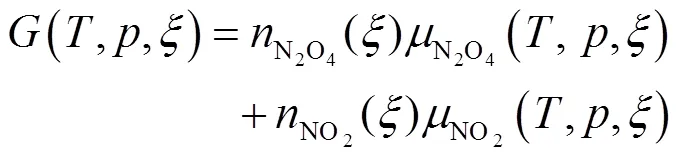
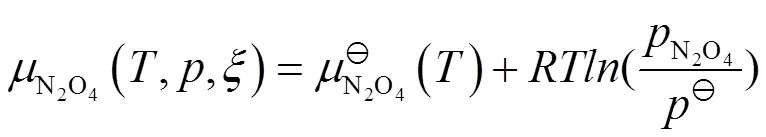
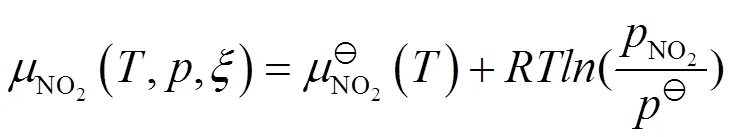
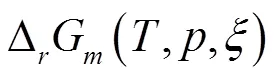
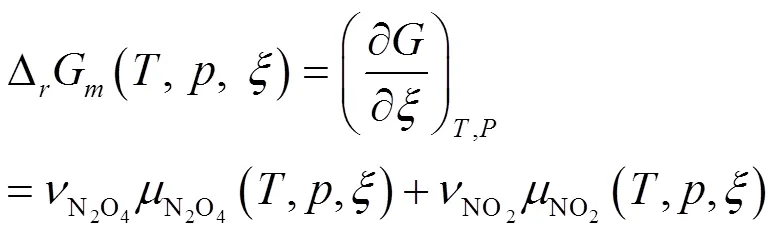
当反应进行到反应进度为mol时,
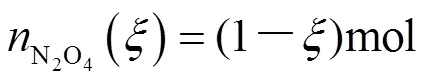

此时,
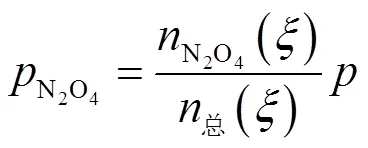
将式(5)代入式(6),得到
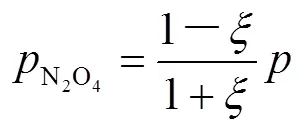
同理得到
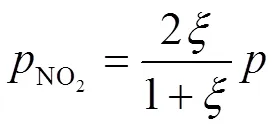
把式(7)、(8)分别代入式(2)、(3),得到:
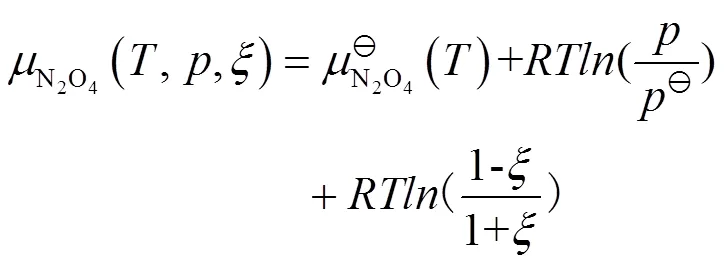
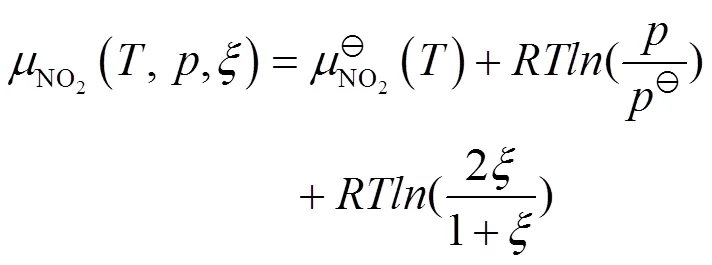
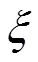
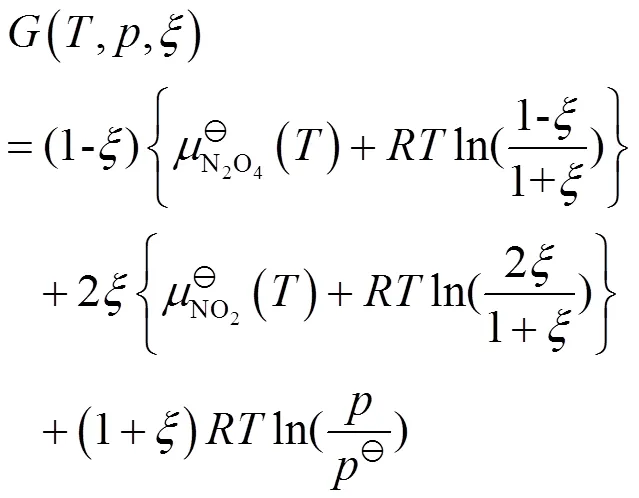
把式(9)、(10)代入式(4),可得:
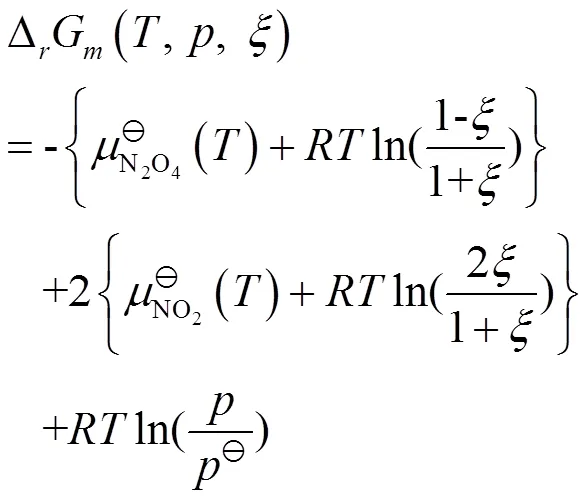
由于标准化学势的绝对值不能得到,通常选择一个参考基准,然后计算出标准化学势的相对值。选择不同的参考基准,计算出的标准化学势的相对值不同,但其变化的差值不变,并不影响相关问题的讨论。
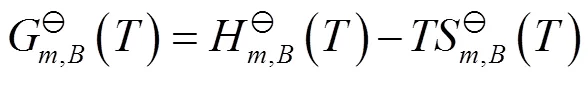
得到
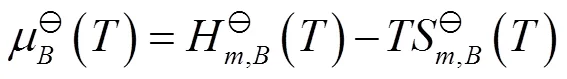
根据
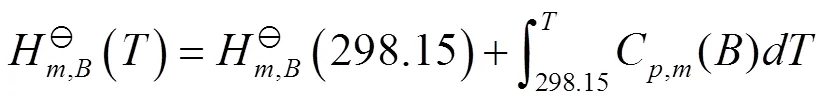
得到
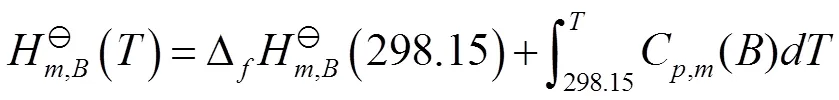
式(14)中C(B)为B的等压摩尔热容。
把式(14)代入式(13),得到
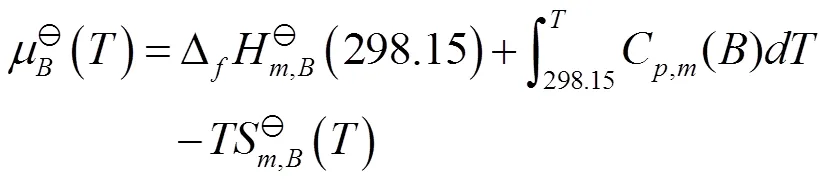
由热力学数据表[7,p1093-1097]查得N2O4和NO2的相关数据,代入式(15),计算得到298.15 K的N2O4和NO2的标准化学势,相关数据见表2。
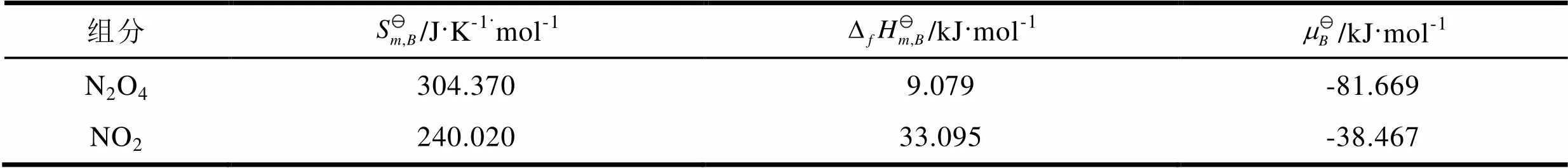
表2 298.15 K时N2O4和NO2的标准热力学数据
把=298.15 K、100 kPa和表2中的标准化学势数据代入式(9)-(12),分别得到
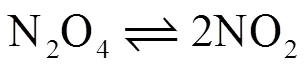
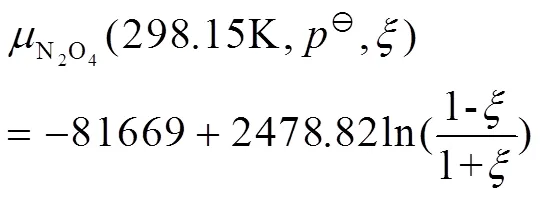
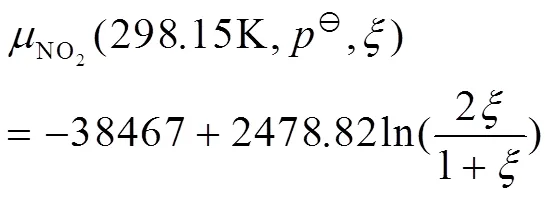

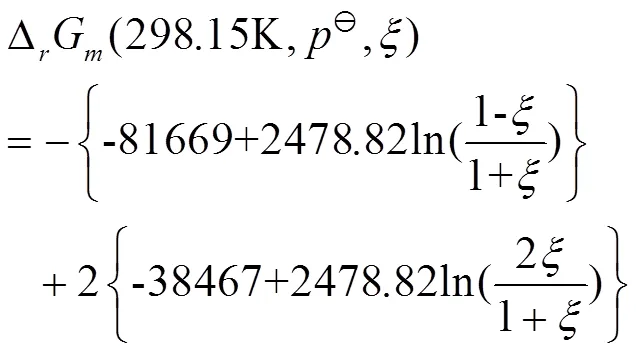
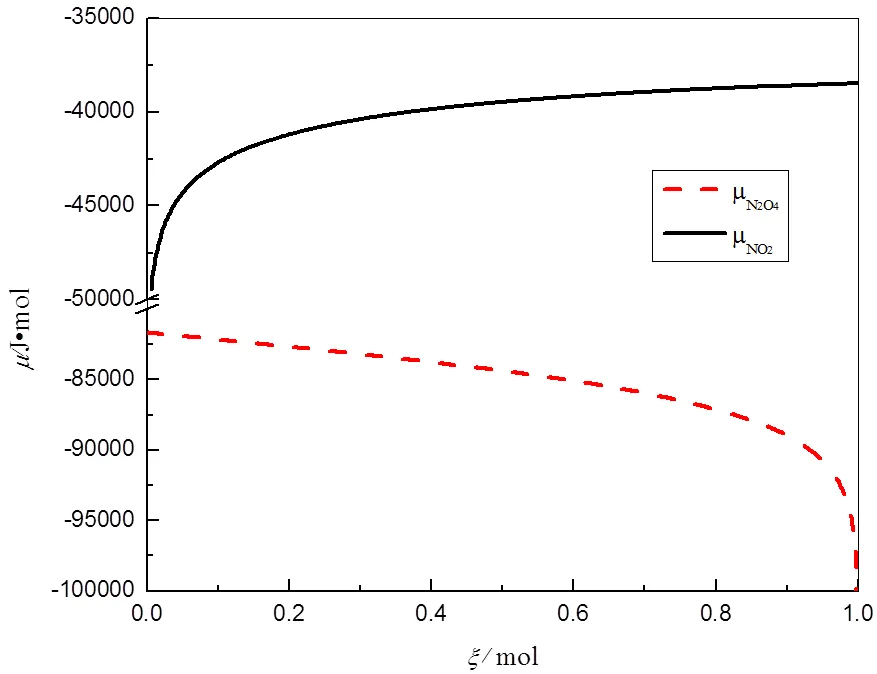
图1 298.15 K、p⊖下、与ξ的关系曲线
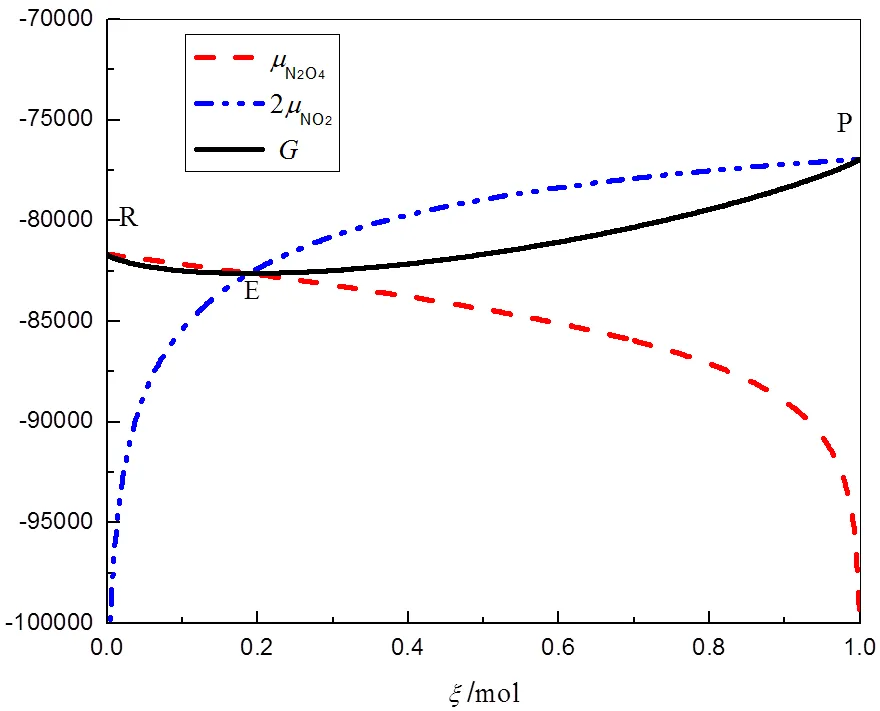
图2 298.15 K、p⊖下、2、G与ξ的关系曲线
由图2可见,从反应进度=0开始,在E点左侧,
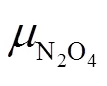
反应由N2O4向生成NO2方向进行;两条曲线相交于E点,此时
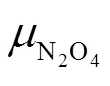
反应处于化学平衡状态;在E点右侧,
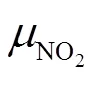
反应由NO2向生成N2O4方向进行。
由图2可以看出,反应系统的总吉布斯自由能从反应进度=0开始随反应进度的增大而减少,并与两条加权的化学势与的关系曲线相交于E点,在E点达到最小值,也说明E点是反应的化学平衡状态,进而随的增大而增大。E点对应的反应进度用E表示,当
式(19)描述的摩尔反应吉布斯自由能△G与反应进度的关系曲线见图3。
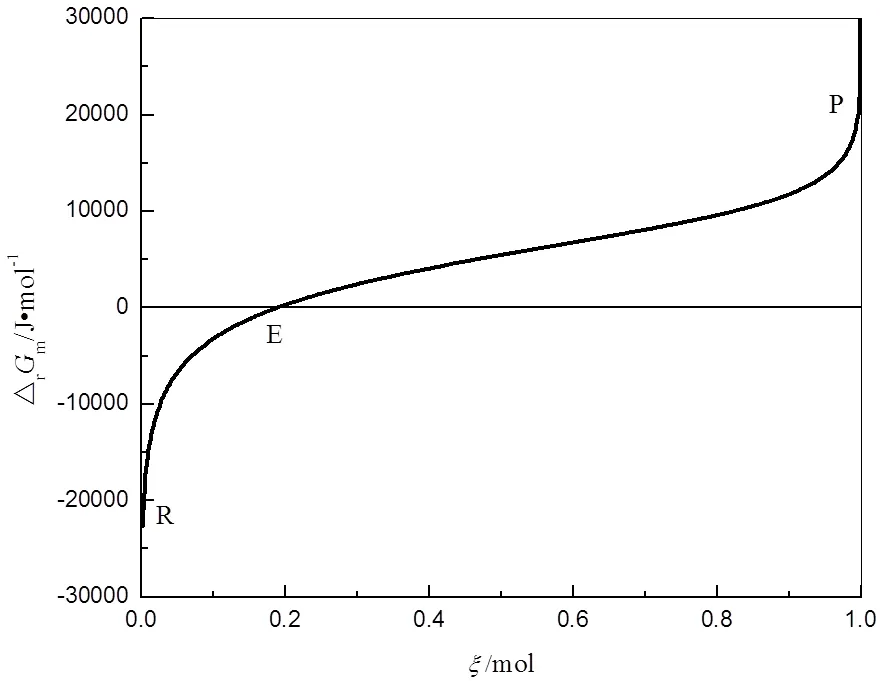
图3 298.15 K、p⊖下△rGm与ξ的关系曲线
由图3可见,反应温度和压力恒定时,摩尔反应吉布斯自由能△G随反应进度的增加而增大。在为0时△G趋于-∞;在RE区间内△G<0,反应由N2O4向生成NO2方向进行;在E点△G=0,反应达到平衡状态;在EP区间内△G>0,反应由NO2向生成N2O4方向进行;在为1时△G趋于+∞。
根据上述的分析,在温度和压力恒定的条件下,根据
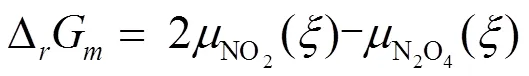
判断化学反应进行的方向和限度,即当反应进行到某一时刻时,也就是反应进度为一确定值时,依据此时反应系统中由化学计量系数加权的生成物的化学势与反应物的化学势之差来判断。进而△G的物理意义可理解为:△G就是等温等压条件下,在一个无限大的反应系统中,当化学反应进行到某一时刻时,保持此时刻反应系统的组成不变,按照反应计量式完成1 mol反应时,反向系统的总吉布斯自由能的变化。
5 结语
以简单的理想气体反应为例讨论了反应系统中反应物的化学势、生成物的化学势、总吉布斯自由能、摩尔反应吉布斯自由能随反应进度的变化趋势,其基本结论对于复杂的理想气体反应也是成立的。由于过程的具体化,使得学生更容易理解和掌握相关的教学内容。
[1] 傅献彩,沈文霞,姚天扬,侯文华.物理化学(上册)[M].北京:高等教育出版社,2005:343-347.
[2] 黑恩成,彭昌军.物理化学(上册)[M].北京:高等教育出版社,2014:96-97.
[3] 刘俊吉,周亚平,李松林.物理化学(上册)[M].北京:高等教育出版社,2009:196-198.
[4] 彭笑刚.物理化学讲义[M].北京:高等教育出版社,2012: 481-484.
[5] Borge J. Reviewing Some Crucial Concepts of Gibbs Energy in Chemical Equilibrium Using a Computer- Assisted, Guided-Problem-Solving Approach[J]. J. Chem. Educ., 2015, 92(2): 296-304.
[6] Raff J M. Spontaneity and Equilibrium: Why “ΔG < 0 Denotes a Spontaneous Process” and “ΔG = 0 Means the System Is at Equilibrium” Are Incorrect[J]. J. Chem. Educ., 2014, 91(3): 386-395.
[7] Barin I. Thermochemical Data of Pure Substances(3rd ed) [M]. New York: VCH Publishers, Inc., USA, 1995.
Discussion on the Relationship between the Reaction Gibbs Energy and the Extent of Reaction
SHEN Yu-long, YANG Xiao-chun, LIU Li-hua
(Department of Chemistry, Tangshan Normal University, Tangshan 063000, China)
A very simple ideal gas reaction (N2O4(g)2NO2(g)) has been fully studied (numerically and graphically) from different perspectives in the paper. This template is designed to help students develop a more nuanced understanding of the relationship between the Reaction Gibbs Energy and the extent of reaction through the creation of graphs of Gibbs free energy for a reaction mixture versus the extent of reaction and the Reaction Gibbs Energy versus the extent of reaction.
reaction Gibbs energy; Gibbs free energy; extent of reaction
O64
A
1009-9115(2019)03-0100-04
10.3969/j.issn.1009-9115.2019.03.026
河北省高校新工科研究与实践项目(2017GJXGK038),河北省高等教育教学改革研究与实践项目(2016GJJG181)
2019-01-21
2019-03-15
沈玉龙(1964-),男,河北沧州人,硕士,教授,研究方向为物理化学。
(责任编辑、校对:琚行松)

