氨基糖苷类抗生素治疗药物监测及其毒理机制研究进展
邓 阳,肖亦莎,李 昕,徐 兵,黄珺晨
(1.长沙市第三医院药学部,湖南 长沙 410015;2.长沙市抗菌药物临床应用研究所,湖南 长沙410015;3.长沙医学院药学院,湖南 长沙 410219)
氨基糖苷类抗生素(aminoglycoside antibiotics,AmAn)在临床上主要用于需氧革兰阴性杆菌引起的严重全身性感染,包括胆道感染、骨和关节感染、尿路感染、皮肤及软组织感染等[1]。较早应用的有链霉素(streptomycin)、庆大霉素(gentamicin)、妥布霉素(tobramycin)等天然来源的抗生素,但随着这些抗生素副作用越来越明显,如耳毒性和肾毒性,促使开发出第二代AmAn及半合成衍生物,如阿米卡星(amikacin)和依替米星(etimicin)等[2]。到20世纪末,随着更广谱、副作用更小的β内酰胺类抗生素的使用,AmAn在临床使用率逐渐下降,临床滥用现象少,耐药率较低。在越来越多的抗生素达不到治疗效果时,AmAn又重新受到了重视。近年来CHINET细菌耐药监测网结果显示,AmAn对耐药革兰阴性菌如铜绿假单胞菌、流感嗜血杆菌等保持良好的敏感率[3],推荐单药或联合用药用来治疗多药耐药菌引起的严重感染如败血症、呼吸系统感染、中枢神经系统感染等。
治疗药物监测(therapeutic drug monitoring,TDM)是一种对生物样本中药物及相关代谢物浓度进行检测的技术。以药动学(pharmacokinetics,PK)和药效学(pharmacodynamics,PD)基础理论为指导,借助分析技术检测患者体内药物浓度,评估患者给药方案是否合适,以提高疗效,降低毒性反应发生。对于治疗窗窄、易发生不良反应且个体差异较大的AmAn,尤其需要定期进行TDM,以提高用药安全,降低耳、肾毒性发生率,将临床用药从传统的经验模式提高到精准用药水平。因此,本文从AmAn的TDM和耳、肾毒性的研究现状出发,阐述AmAn的TDM主要分析方法、PK/PD、毒性机制及其毒性预防机制的研究进展,以期为AmAn的TDM方法的建立、合理用药和毒理机制的基础和临床研究提供参考。
1 治疗药物监测
1.1 药动学/药效学
AmAn属于静止期杀菌药,能与细菌核糖体中的30S亚基结合,抑制细菌蛋白质的合成,也可改变细菌细胞壁的通透性,使细胞内盐类及营养物质外漏,导致细菌迅速死亡[4]。其极性和解离度较大,口服很难吸收,在临床以肌注和静滴为主。同时该类药物血浆蛋白结合率多数<10%,穿透细胞膜能力很弱,主要分布于细胞外液,反复用药后易在肾皮质和内耳内、外淋巴液高浓度聚积,且不经肝代谢,主要以原形从肾排泄,在肾、耳组织清除半衰期(t1/2)远长于血浆t1/2。众所周知,药物的疗效、毒性均与血药浓度相关。有研究显示,依替米星在大鼠内耳和肾清除t1/2分别可达155.96±19.95和(83.11±26.60)h[5],表明其在体内清除缓慢、蓄积严重,这也就从PK角度阐述了该类药的可能毒性机制。此外,该类抗生素有较长的抗生素后效应和首剂效应,且是浓度依赖性抗生素,临床疗效与峰浓度(peak concentration,Cmax)/最低抑菌浓度(minimal inhibitory concentration,MIC)比值成正相关,当Cmax/MIC≥8~10,或药-时曲线下面积(area under the curve,AUC)/MIC≥100~125时对革兰阴性菌可获良好疗效,也可防止在治疗过程中产生耐药突变株。因此,患者体内AmAnCmax在安全范围内越高疗效越好,谷浓度(trough concentration,Cmin)越低毒性发生率越低。
性别、年龄、种族和烧伤等因素都会影响患者的表观分布容积,从而影响AmAn血药浓度,且该类药物治疗浓度与中毒浓度接近,在给予相同剂量药物后患者体内的血药浓度存在较大的差异,从而影响药物的疗效甚至发生毒性反应,尤其在特殊人群中。此外有报道,我国182万药源性聋哑儿童中,有50%~73%为AmAn所致[6]。另外一项庆大霉素在儿童中的安全性以及TDM对儿童患者的实用性的研究表明,每天1次给药治疗时,其肾毒性不常见且可逆,而耳毒性经常发生且不可逆,两者之间存在密切联系[7]。一般来说,肾毒性先于耳毒性发生,如在肾毒性发生之后立即停药,可有效避免耳毒性发生[8]。与成年人相比,该类药在儿童体内的t1/2更长,Cmin更高,更易引起肾、耳毒性的发生,其原因可能是儿童患者因肾小球、肾小管发育不全导致肾清除率降低。有研究发现,老年人使用阿米卡星t1/2明显较成年人长,这可能与老年人分布容积低于成年人,全身血管硬化,导致肾功能减退有关[9]。《抗菌药物临床应用指导原则》规定,对肾功能不全患者、老人以及新生儿等在使用氨基糖苷类药物均需要进行TDM[7],以提高疗效和降低不良反应。肾功能异常患者宜在用药后第2天测Cmax(给药后5 min);在用药第4~5天检测Cmin(给药前5 min),通过TDM指导临床合理用药,以避免浓度过高而引起毒性反应。
1.2 检测方法
AmAn化学结构中含有氨基醇环和氨基糖分子,由配糖键连接成苷,极性强,易溶于水,无典型紫外吸收[10]。因此,在使用HPLC-UV进行检测时,必须使用操作繁琐的衍生化法[11-12],实验结果易受衍生化试剂干扰。所以目前大多研究主要用LC-MS/MS进行检测,常用的分析方法见表1。从表1及结合AmAn药物本身性质可以得知,目前监测AmAn主要采用亲水作用色谱,色谱柱为HILIC柱,流动相为含酸的强极性溶剂,内标为化学结构相似同类抗生素,主要采用蛋白沉淀法进行样品处理。此类方法操作简单,价格低廉,基质效应和萃取回收率均符合要求,且稳定性好更易推广。
1.3 给药方案优化
在AmAn的合理用药过程中,临床常需要在经验性给药方案上根据TDM制定个体化给药方案(常规给药剂量见表2),来提高临床治愈率,降低抗生素耐药。但AmAn治疗浓度与中毒浓度接近,易发生毒性反应,使用时需要特别注意峰谷浓度值。该类抗生素治疗浓度与中毒剂量具体数值见表3。大多数研究推荐AmAn每天1次给药[15-17],主要在于该类药物对革兰阳性菌和革兰阴性菌均具有一定程度的抗生素后效应,可通过延长给药间隔、减少给药次数、适当增加给药剂量来降低耳、肾毒性,也可避免耐药突变菌株的产生。但由于其治疗窗较窄、毒性反应大,加上临床患者病理生理情况的多样性、复杂性,在没有更多的AmAn的科学理论与合理用药依据时,对于不同人群,临床医师更倾向于参考药品说明书推荐的每天≥2次用药方法,综合患者病理生理情况制订经验性的给药方案,因而亟需开展TDM以及不同人群的PK/PD等研究,为其合理使用提供参考。此外,相关研究也表明,每天1次给药方案,可以有效降低患者的Cmin,但Cmax会较高;而每天2次或3次给药方案患者Cmax会降低,但Cmin会升高,2种给药方案都是为了避免AmAn在人体内浓度过高而引起毒性反应[18]。临床具体使用哪一种给药方案,应结合患者具体情况做出判断,如果长期使用该类药,随着治疗时间延长,药物在体内蓄积增多,将更易发生毒性危险。因此,需要结合患者的疗效与相应检查结果与权威指南中推荐的PK/PD指数和患者血药浓度值进行比较分析,来调整给药剂量和给药间隔,优化临床给药方案,进行个体化给药治疗,达到提高疗效和降低不良反应的目的。
2 毒性机制与减毒
2.1 耳毒性机制与配伍减毒
AmAn耳毒性主要表现在前庭和耳蜗神经等内耳结构的损伤造成听觉障碍,而内耳结构又与平衡感有着密切的联系,其损伤常导致眩晕、恶心、呕吐、眼球震颤和平衡失调等不良反应[18]。近年来,对AmAn耳蜗毒性机制研究形成多种观点,如内淋巴液药物蓄积、氧化应激损伤和溶酶体破坏引起细胞自溶等[19-21]。当AmAn在体内蓄积到一定浓度后,耳蜗氧自由基大量产生,并超过耳蜗组织的抗氧化能力,导致超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物歧化酶(glutathione peroxidase,GSH-Px)表达降低[22-24]。也有研究认为,此类抗生素易与内耳感觉细胞的磷酸肌醇酯结合[25],结合后细胞内Ca2+释放出来,胞外 Ca2+增多从而激活胱天蛋白酶凋亡通路,增加活性氧(reactive oxygen species,ROS),进一步对细胞产生毒性,从而造成听觉系统损害。此外,分子遗传学观点提出,线粒体的A1555G和C1497T基因位点突变者易出现耳毒性反应,且有家族聚集现象[26-27]。因此,通过基因检测技术,方便临床医师获得患者基因型,从而预知哪些患者在使用AmAn时更易发生耳毒性。

表1 氨基糖苷类抗生素常见LC-MS/MS分析检测方法
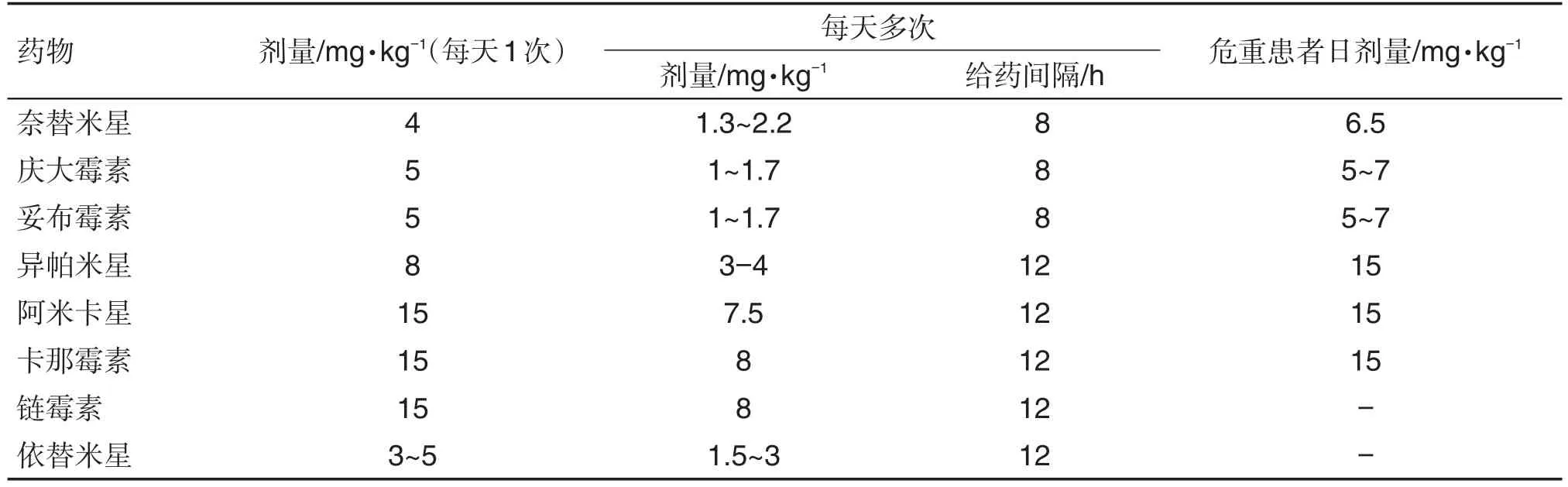
表2 氨基糖苷类抗生素的给药方案

表3 氨基糖苷类抗生素有效血药浓度和中毒浓度
综上,AmAn产生耳毒性最主要的原因是氧化应激所致损伤。目前大多研究主要从抵御氧化应激来拮抗其耳毒性:①中药拮抗AmAn氧化应激损伤。如川芎嗪可以通过增加豚鼠SOD和GSH-Px活性,减少丙二醛(malondialdehyde,MDA)的产生,抑制耳蜗细胞胱天蛋白酶的表达,以减少庆大霉素诱导的耳蜗细胞凋亡[23-24,28],具体机制有待进一步明确。于姝媛等[29]发现,红景天苷可通过激活大鼠体内核因子E2相关因子2-抗氧化反应元件途径,引起相关抗氧化酶如SOD和GSH-PX的表达水平增加,从而保护耳蜗螺旋神经元。有研究报道,绿茶酚活性物质表没食子儿茶素表没食子酸酯与阿米卡星合用,可以减轻阿米卡星诱导大鼠螺旋神经元的凋亡,对大鼠听功能有保护作用[30]。②化学药物拮抗AmAn氧化应激损伤。地塞米松和他克莫司可以缓解庆大霉素代谢物引起的氧化应激细胞损伤[31];非诺贝特通过恢复大鼠SOD活性,降低庆大霉素导致的听力阈值[32]。有研究通过细胞内铁离子滴定证明去铁离子螯合剂对AmAn耳损伤有保护作用,其主要机制与抗氧化有关[33]。此外,临床使用该类抗生素时,应尽量避免与其他潜在耳毒性药物合用或者先后局部及全身使用,避免造成更严重的损伤。
2.2 肾毒性机制与配伍解毒
一般肾毒性在用药后5~7 d发生,7~10 d肾毒性最强,可出现血尿、蛋白尿及肾功能不全,尿量减少或增多,大多数表现为非少尿性急性肾衰,通常表现为蛋白尿、管型尿和血尿,一般情况下停药后肾功能可逆转[8]。对AmAn的肾毒性进行研究后发现,首先药物通过胞饮作用被近端小管细胞吸收后被转运和聚集在溶酶体上,导致溶酶体磷脂变性,溶酶体破裂,出现磷脂尿,进一步导致肾小管细胞坏死,甚至肾衰竭。主要机制可能有:①AmAn诱发氧化应激导致肾损伤,如阿米卡星和庆大霉素可明显降低人肾小管上皮细胞系HK-2的SOD活性,升高MDA和乳酸脱氢酶含量,引发毒性[34-35];②AmAn诱发正常细胞凋亡和坏死导致肾损伤,如庆大霉素和依替米星可以增加大鼠体内白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等促炎症因子含量,导致肾小管上皮细胞凋亡[36-37]。
许多药物都具有抑制AmAn肾毒性的作用,在AmAn致肾损伤期间,可以通过服用药物减轻肾损伤程度,降低不良反应。①与中药配伍减毒。有研究表明,葛根素和芦丁等黄酮类及三七和人参等皂苷类化合物可以调节氧化平衡和降低炎症反应,减轻庆大霉素所导致的急性肾损伤[35,38-39];葛根素可以诱导大鼠体内SOD、GSH-PX及总氧化能力恢复,明显降低庆大霉素诱导大鼠肾损伤后的肌酐(creatinine,Cr)和血尿素氮(blood urine nitrogen,BUN)水平,从而减轻肾毒性损伤;椰子花序提取物可以抑制TNF-α和IL-6等促炎细胞因子表达,同时还可以增加SOD和GSH-PX活性,降低血清Cr和BUN水平,促进肾组织病理改变修复[40];姬松茸多糖可以降低小鼠BUN和Cr的含量[41],减轻庆大霉素所致肾损伤;川芎嗪明显抑制大鼠体内MDA表达,降低血清Cr和BUN水平,从而预防庆大霉素导致的肾损伤[42]。②与化学药物配伍解毒。如曲美他嗪可以通过预先给药,在大鼠体内与庆大霉素竞争Megalin受体,减少其在肾中的蓄积,减轻肾组织病理学改变[43];如水杨酸可与氧自由基反应生成2,3-二羟基苯甲酸清除庆大霉素诱发产生的氧自由基[17];C1q/TNF 相关蛋白 6[36]和双嘧达莫[44]可以通过预先给药,抑制庆大霉素所导致的大鼠急性肾损伤肾组织中的TNF-α和IL-6相关炎症体激活,从而减轻肾损伤,双嘧达莫还可以降低大鼠体内血尿酸升高保护肾组织;硝苯地平可以降低肌酐清除率[45];羟苯磺酸钙是一种强抗氧化剂,可以有效预防妥布霉素导致的氧化应激,增加SOD表达,降低MDA产生,抑制炎症反应,从而保护肾小球和肾小管[46],且有临床研究发现,羟苯磺酸钙治疗的肾移植患者,治疗后患者的Cr和BUN均较治疗前明显下降并维持稳定[47]。
因此,针对AmAn肾毒性,研究者提出临床上可以采取下列防护措施:①采用每天给药1次的方案,通过降低胞饮作用而减少吸收[48];②避免与其他肾毒性药物局部或全身合用;③改变给药途径、研究毒性更低的抗生素,已有雾化氨基糖苷类药物用于治疗慢阻肺[49],且伊娜等[37]发现,在大鼠中,第二代合成类依替米星导致的耳、肾组织病变比第一代庆大霉素轻;④与药物合用降低肾毒性,如上述提到的中药或者化药。
3 耐药机制和预防措施
细菌对AmAn产生抗性的机制主要有3种。①AmAn在细胞内浓度过低而产生抗性:大部分假单胞菌属、不动杆菌属可以通过高效主动排除系统将氨基糖苷类药物排出细胞外,使细胞内浓度减少而导致耐药[50]。②核糖体位点变化而产生抗性:铜绿假单胞菌、多药耐药鲍曼不动杆菌和肺炎克雷伯菌对AmAn耐药[50-51],主要原因是与细菌30S核糖体亚单位上的16SrRNA的甲基化阻碍细菌与药物结合而产生耐药。③耐药菌表达的AmAn修饰酶能对抗生素分子的氨基或羟基进行修饰[52],使AmAn与核糖体的亲和力下降而产生耐药,在细菌细胞内对抗生素进行修饰的修饰酶主要有3类,即氨基糖苷磷酸转移酶、氨基糖苷乙酰转移酶和氨基糖苷核苷转移酶[53]。目前主要采取以下几种措施来控制耐药性:①对原有AmAn在结构上进行改造[54],如1-N-取代衍生物和1-N-烷基衍生物等。②开发AmAn修饰酶抑制剂[55],如带正电荷的短肽可以吸引修饰酶负电荷中心,让修饰酶失去活性。③与其他抗生素联合用药,合理使用抗生素。
4 展望
综上所述,对AmAn进行TDM极有必要,通过TDM制定个体化给药方案,可以有效降低其耳、肾毒性和耐药,提高患者治愈率。随着生物检测的方法不断更新,生物分析方法灵敏度、精密度和选择性也在不断提高,迫切需要建立相应的检测方法,以满足临床TDM和研究需要。而耳、肾毒性是AmAn最常见的不良反应,其毒性预防机制比较复杂,中药和西药防治毒性措施均停留在动物实验阶段,缺乏临床研究资料。大多研究也显示,氧化应激是AmAn导致耳、肾毒性主要机制,提示拮抗耳、肾毒性可以从氧化应激角度进一步探讨,如利用具有抗氧化应激的藤茶二氢杨梅素和甘草等,通过激活氧化应激防御通路,起到相应的防治作用[56-57]。
目前抗生素的耐药问题比较严重,细菌耐药机制相当复杂,随着科研人员不断深入研究,不断完善细菌耐药机制,对此类抗生素耐药机制有了比较全面的认知。但临床上对于AmAn耐药率不断提高的问题值得深思,临床给药剂量是否合适、是否有此类药物用药指征以及是否考虑用中药提取物或主要活性成分预防其耐药性的产生等均待进一步研究。

