BAPTA-AM通过抑制炎症和氧化损伤改善脂多糖诱导的小鼠急性肺损伤
俞巧丽,莫泽君,宋必卫
(1.浙江医院药剂科,浙江 杭州 310007;2.浙江大学医学院附属第二医院药剂科,浙江 杭州 310009;3.浙江工业大学药学院药理学科,浙江 杭州 310014)
急性肺损伤(acute lung injury,ALI)是由严重感染、创伤、酸中毒、肠缺血和输血等引起的肺部炎症性疾病[1],临床表现为呼吸窘迫和难治性低血氧[2],具有极高的死亡率[3]。肺泡上皮紧密排列着肺泡Ⅰ型和Ⅱ型上皮细胞,肺泡Ⅱ型上皮细胞能分泌表面活性物质降低表面张力,使肺泡保持开放,促进气体交换[4]。ALI早期表现为肺泡毛细血管内皮细胞与肺泡上皮细胞损伤,肺泡屏障通透性增高,中性粒细胞大量积累并释放炎症介质,诱导炎症和氧化损伤[4-6]。目前ALI的临床治疗主要有机械通气、液体通气和体外膜氧合技术等[7-9],尚无有效的药物治疗方案。大量研究表明,抑制炎症[10]和氧化损伤[11]可改善ALI,因此具有抗炎和抗氧化损伤作用的化合物具有良好的治疗ALI前景。
1,2-双(2-氨基苯氧基)-乙烷-N,N,N’,N’-四乙酸〔1,2-bis(2-aminophenoxy)ethane-N,N,N’,N’-tetraacetic acid,BAPTA-AM〕是一种Ca2+螯合剂,能在细胞内被酶解生成BAPTA,已被证明可以保护神经元,抑制细胞氧化应激和凋亡[12-14],目前国内外尚未见BAPTA-AM抗肺损伤方面的报道。BAPTA-AM在水中溶解度低,本研究使用纳米颗粒作为脂质体载体,通过乙醚注射法制备BAPTAAM纳米脂质体(BAPTA-AM nano-liposome,BAPTA-AML)。纳米脂质体可保护BAPTA-AM的稳定性,并能选择性地在靶组织积累,提高药物疗效,减轻药物的不良作用[14]。鉴于减轻炎症和氧化损伤的ALI治疗有重要意义,本研究使用脂多糖(lipopolysaccharide,LPS)和缺糖缺氧复糖复氧(oxygen-glucose deprivation/recovery,OGD/R)建立小鼠和A549细胞ALI模型,探索BAPTA-AM的抗ALI作用及作用机制。
1 材料与方法
1.1 细胞、动物、试剂和主要仪器
A549细胞购自美国ATCC细胞库,接种RPMI-1640(含10%胎牛血清)培养液,置于37℃,5%CO2饱和湿度培养箱中培养。
清洁级健康雄性ICR小鼠,体质量20~22 g,购自浙江省医学科学院动物中心,许可证号:SCXK(浙)-2014-0001。实验小鼠于实验室条件饲养:恒温20~24℃,自由饮水,标准饲料喂食,光照周期12 h照明与12 h黑暗交替进行。待小鼠适应环境(约7 d)后,禁食12 h,进行实验。
BAPTA-AM和BAPTA-AML购自合肥恒星科技开发有限公司,噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)购自美国Sigma公司;RPMI-1640培养液和胎牛血清(fetal bovine serum,FBS)购自上海吉诺医药生物技术有限公司;LPS购自西亚试剂;罗丹明123(rhodamine 123,Rh 123)购自南京凯基生物技术有限公司;乳酸脱氢酶(lactic dehydrogenase,LDH)、一氧化氮(nitric oxide,NO)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和髓过氧化物酶(myeloperoxidase,MPO)测定试剂盒购自南京建成生物工程研究所;地塞米松(dexamethasone,Dex)磷酸钠注射液购自天津金耀药业有限公司;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)ELISA检测试剂盒购自武汉博士德生物工程有限公司。
NU-5510E CO2培养箱(Thermo,美国),荧光显微镜(尼康,日本),Synergy HI多功能酶标仪(BioTek,美国),LDZ5-2高速冷冻离心机(Heraeus,德国),HM325轮转式石蜡切片机(MICROM,德国)。
1.2 建立缺糖缺氧复糖复氧细胞模型及分组处理
取对数生长期A549细胞,以每孔1×104细胞接种于96孔板,分为正常对照组(含10%FBS的RPMI-1640)、OGD/R模型组(先用无糖RPMI-1640培养液,于持续通入氮气1 h的37℃培养箱中缺氧培养12 h;之后使用含2 g·L-1葡萄糖的RPMI-1640培养液并在正常含氧量培养箱内继续培养6 h);BAPTA-AM 0.005,0.05,0.5和5 nmol·L-1组加相应浓度BAPTA-AM培养30 min后同模型组方法进行培养。
MTT法检测96孔板中A549细胞存活,收集细胞培养液按试剂盒说明书检测LDH活性,裂解细胞按试剂盒说明书检测NO和MDA含量及SOD活性。
1.3 Rh123染色法检测线粒体膜电位
收集细胞后以每孔5×104细胞接种于24孔板,分组处理同1.2,培养结束后弃培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3次,加含Rh123 10 mg·L-1的无酚红RPMI-1640培养液,37℃孵育30 min,PBS清洗后加适量无酚红RPMI-1640培养液,荧光显微镜下观察、拍照,多功能酶标仪检测96孔板中荧光值(激发波长:507 nm,发射波长:527 nm)。Rh123为膜电位敏感的亲脂性阳离子荧光染料,能选择性地在活细胞线粒体内聚集,发出黄绿色荧光,其强度可间接反映线粒体膜电位(mitochondrial membrane potential,Δψ)的高低。
1.4 lCR小鼠ALl模型的制备及处理分组
健康ICR小鼠随机分成6组,每组8只:正常对照组、ALI模型组(尾静脉注射LPS 10 mg·kg-1)、Dex组(尾静脉先后注射LPS 10 mg·kg-1和Dex 5 mg·kg-1)和BAPTA-AML 25,50和100 μg·kg-1治疗组(尾静脉先后注射LPS 10 mg·kg-1和BAPTAAML 25,50或100 μg·kg-1)。正常对照组和ALI模型组注射同等容积的生理盐水,实验过程中各组小鼠均自由饮水,小鼠最后一次尾静脉注射6 h后,摘眼球取血,室温静置30 min,于1000×g离心10 min制备血清。
1.5 肺系数计算
取血后,小鼠快速处死取整肺,预冷PBS漂洗3次,吸干表面水分,称取整肺质量。新鲜左肺下叶称重后于60°C烘箱烘烤48 h至恒重,称量干重,计算肺组织湿干(lung wet/dry,W/D)比。肺系数=肺质量/体质量×100%。肺组织湿干比=肺湿重/肺干重。
1.6 试剂盒检测小鼠血清LDH活性,ELlSA检测小鼠血清TNF- α和lL-6的含量
按说明书测定小鼠血清LDH活性,使用ELISA检测小鼠血清TNF-α和IL-6含量。
1.7 试剂盒检测小鼠肺组织MPO和SOD活性及MDA的含量
右肺称重后按质量体积比1∶9加所需体积的预冷PBS,充分匀浆,4℃,1000×g离心20 min,取上清液,考马斯亮蓝法测定蛋白质浓度,按说明书检测MPO和SOD的活性及MDA的含量。MPO是中性粒细胞功能和激活的标志,本研究使用MPO活性反映小鼠肺组织中中性粒细胞的积累变化。
1.8 苏木精-伊红(hematoxylin-eosin staining,HE)染色观察小鼠肺组织的病理变化
左肺上叶经4%多聚甲醛固定后,石蜡包埋,切片,进行HE染色,显微镜下观察肺组织的病理变化,随机选取10个视野,采用Smith等[15]方法进行病理评分(表1)。重点评价:①肺充血及肺出血;②肺泡水肿;③肺泡及炎症细胞浸润;④肺泡间隔增厚及透明膜形成等。
Tab.1 Score of lung pathology in mice with acute lung injury(ALl)
1.9 统计学分析
实验结果数据用±s表示,采用GraphPad Prism 7.0处理及分析实验数据,采用单因素方差分析法检测均数差异显著性,以P<0.05为差异有统计学意义。
2 结果
2.1 BAPTA-AM改善OGD/R导致的A549细胞损伤
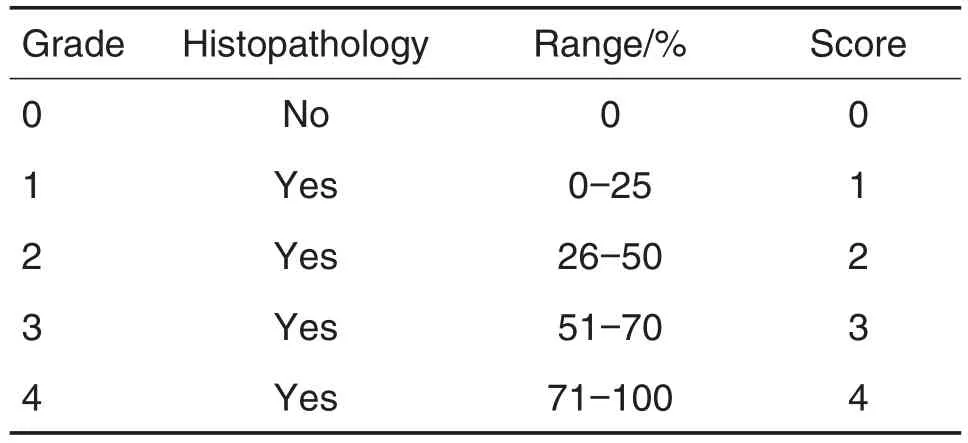
MTT结果(图1A)显示,与正常对照组相比,细胞经缺糖缺氧培养12 h,复氧复糖培养6 h后,OGD/R模型组细胞存活率下降(P<0.05),细胞培养液中LDH活性升高(P<0.05)(图1B),细胞中MDA和NO含量升高(P<0.05),SOD活性降低(P<0.05)(图1C-D);与OGD/R模型组相比,BAPTAAM 0.05,0.5和5 nmol·L-1组细胞存活率升高(P<0.05),培养液中LDH活性降低(P<0.05),SOD活性升高(P<0.05),而BAPTA-AM 0.005 nmol·L-1组与模型组相比无显著性差异;而不同浓度的BAPTAAM组都能降低细胞内MDA和NO含量(P<0.05),图1C和D显示,BAPTA-AM具有良好的抗氧化损伤能力。实验结果表明,BAPTA-AM改善细胞损伤、抗氧化应激作用,在0.5 nmol·L-1时效果最佳,浓度增大反而作用有所减弱。
2.2 BAPTA-AM降低OGD/R导致的线粒体膜电位
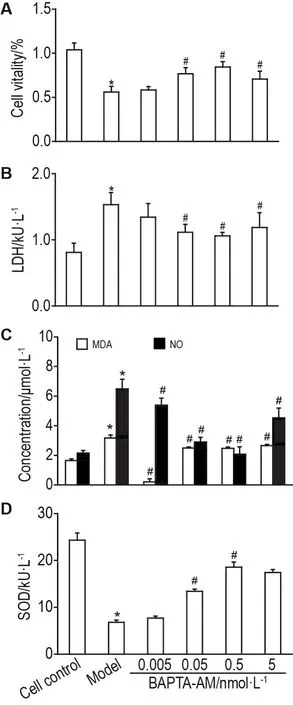
Fig.1 Effect of BAPTA-AM pretreatment on A549 cells injured by oxygen-glucose deprivation/recovery(OGD/R).A549 cells were cultured in the absence of serum and glucose in RPMI-1640,exposed to 95%N2and 5%CO2for 12 h.Then,the culture medium was replaced with RPMI-1640 containing normal glucose and 10%(V/V)fetal bovine serum under 5%CO2and normoxic condition for 6 h as OGD/R.BAPTA-AM 0.005,0.05,0.5 and 5 nmol·L-1was added to the cell cultures 30 min prior to ODG/R.A:survival rate of A549 cells detected by MTT assay;B:activity of lactic dehydrogenase(LDH)in culture medium of A549 cells;C:malondialdehyde(MDA),nitric oxide(NO)level;D:activity of superoxide dismutase(SOD)in A549 cells.±s,n=6,*P<0.05,compared with cell control group;#P<0.05,compared with model group.
线粒体膜电位结果(图2)显示,OGD/R模型组细胞线粒体膜完整性被破坏,黄绿色荧光强度降低(P<0.05)。BAPTA-AM 0.05,0.5和5 nmol·L-1组细胞线粒体黄绿色荧光强度升高(P<0.05),提示BAPTA-AM处理显著改善线粒体对Rh123的摄取能力,稳定Δψ,维持膜功能,有效保护线粒体;而BAPTA-AM 0.005 nmol·L-1组与模型组相比无显著性差异。
2.3 BAPTA-AML对ALl模型小鼠肺系数及肺W/D比的影响

Fig.2 Effect of BAPTA-AM on mitochondrial membrane potential of A549 cells injured by OGD/R and detected by fluorescence microscope.See Fig.1 for the cell treatment.A:fluorescence images of rhodamine123 staining detected by fluorescence microscope;B:quantitative analysis of fluorescence intensity in A.RFU:relative fluorescence unit.±s,n=6,*P<0.05,compared with cell control group;#P<0.05 compared with model group.

Fig.3 Effect of BAPTA-AM nanoliposome(BAPTAAML)on lung coefficient(A)and lung wet/dry(W/D)ratio(B)in ALl model mice induced by lipopolysaccharide(LPS).BAPTA-AML 25,50,100 μg·kg-1or dexamethasone(Dex)5 mg·kg-1was given through tail intravenous injection(iv)after LPS(10 mg·kg-1,iv)administration.After 6 h,the mice in each group were euthanized,and lung tissues and blood were harvested immediately.±s,n=8.*P<0.05,compared with normal control group;#P<0.05 compared with model group.
与正常对照组比,模型组小鼠肺系数及肺W/D比升高(P<0.05),不同浓度BAPTA-AML组以上指标显著降低(图3A,B);Dex 5 mg·kg-1组肺W/D比和肺系数降低(P<0.05),给药组与阳性对照组比较无统计学差异。
2.4 BAPTA-AML对ALl模型小鼠肺组织MDA含量和SOD活性及血清LDH活性的影响
结果(图4)显示,与正常对照组比,模型组小鼠血清LDH活性升高(P<0.05),肺组织MDA含量上升(P<0.05)和SOD活性降低(P<0.05),Dex 5 mg·kg-1和BAPTA-AML 25,50,100 μg·kg-1可逆转上述作用(P<0.05);其中BAPTA-AML 25和50 μg·kg-1降低血清LDH水平和肺组织MDA含量的作用优于Dex 5 mg·kg-1组(P<0.05),且BAPTA-AM各剂量升高SOD活性的作用优于Dex 5 mg·kg-1(P<0.05)。

Fig.4 Effect of BAPTA-AML on oxidative stress factors MDA(A)and SOD(B)in lung tissue,and LDH activity(C)in serum of ALl model mice.See Fig.3 for the mouse treatment.x±s,n=8.*P<0.05,compared with normal control group;#P<0.05 compared with model group;△P<0.05,compared with Dex 5 mg·kg-1group.
2.5 BAPTA-AML对ALl模型小鼠肺组织炎症因子的影响
结果(图5)显示,与正常对照组相比,模型组小鼠MPO活性、TNF-α和IL-6含量升高(P<0.05);与模型组比,Dex和不同浓度BAPTA-AML组以上指标降低(P<0.05);且BAPTA-AML 50 μg·kg-1组降低MPO活性和TNF-α含量的效果优于阳性对照Dex5mg·kg-1(P<0.05),BAPTA-AML25和50μg·kg-1降低IL-6含量的作用高于阳性对照Dex 5 mg·kg-1(P<0.05)。
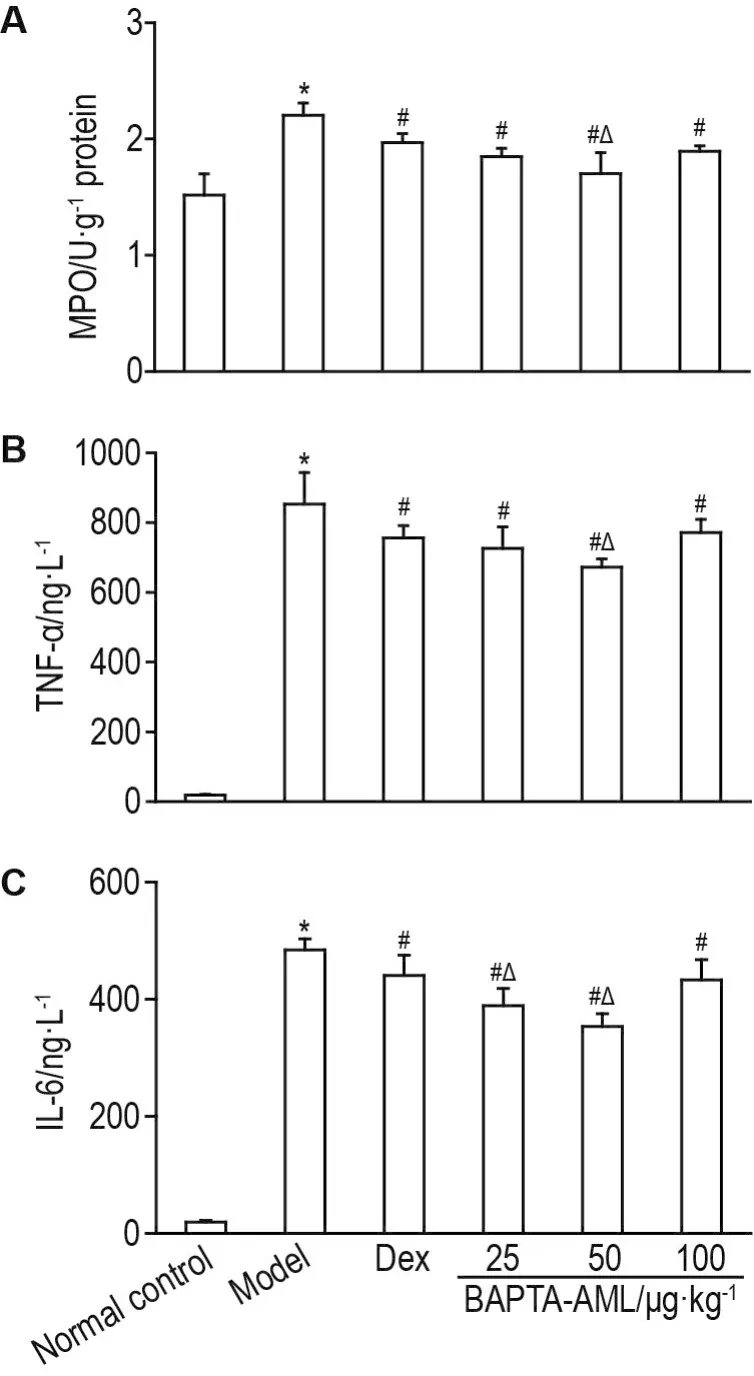
Fig.5 Effect of BAPTA-AML on myeloperoxidase(MPO)activity(A)in lung tissue and TNF- α(B),lL-6(C)levels in serum of ALl model mice.See Fig.3 for the mouse treatment.x ± s,n=8. *P<0.05,compared with normal control group;#P<0.05,compared with model group;△P<0.05,compared with Dex 5 mg·kg-1group.
2.6 BAPTA-AML对ALl小鼠肺组织病理变化的影响
HE染色(图6A)及肺损伤评分(图6B)结果显示,正常对照组肺组织结构完整,肺泡腔清晰,肺泡壁薄;而模型组肺泡结构严重破环,肺泡腔明显缩小,部分肺泡腔融合,肺组织内有大量散在的淋巴细胞和红细胞,肺间隔增厚,炎症细胞浸润,肺损伤评分明显高于正常对照组(P<0.05);BAPTA-AML 50 μg·kg-1治疗组肺组织损伤明显减轻,结构趋于正常,肺间隔较模型组变薄,肺泡腔融合消失,仅少量淋巴细胞和红细胞渗出,少见炎症浸润,肺损伤评分较模型组降低(P<0.05)。

Fig.6 Effect of BAPTA-AML on histopathology in lung tissues in ALl model mice by HE staining.See Fig.3 for the mouse treatment.A:HE staining.B:score of lung injury pathology in A.±s,n=8.*P<0.05,compared with normal control group;#P<0.05,compared with model group.The lung structure manifested pathological changes induced by LPS,which included structure despite a few lymphocytes or a little red blood cell exudation.Arrows show alveolar cavity shrinking,thickening alveolar septum,inflammatory cell infiltration and the formation of hyaline membranes.
3 讨论
A549细胞为亚三倍体肺泡基底上皮细胞,被广泛用作肺腺癌的模型以及肺泡Ⅱ型上皮细胞的体外模型。本研究通过OGD/R处理A549细胞,结果显示模型组细胞活力下降,LDH活性升高,产生氧化应激,促进NO释放,提示细胞损伤模型建立成功。
生理状态下,氧自由基不断产生也不断被清除,对细胞无损伤,而在一定外源因素的诱导下,细胞代谢过程中产生过多氧自由基,诱导细胞损伤。MDA是典型的脂质过氧化物,其含量的多少指示组织脂质过氧化的程度,SOD活性高低间接反映组织清除氧自由基的能力,同时测定MDA含量和SOD活性可反映肺组织氧化损伤程度。NO性质活泼,高剂量NO能降低肺表面活性物质功能,激活巨噬细胞,对肺上皮细胞产生氧化损伤[16],并能损伤线粒体[17-18],促使线粒体膜通透性改变,Δψ下降,释放细胞色素c并激活胱天蛋白酶3(cysteinyl aspartate specific proteinase 3,caspase 3),导致细胞凋亡[19-21]。Ca2+超载亦能引起氧化应激,并能通过线粒体细胞死亡通路调控细胞凋亡[22]。BAPTA是良好的Ca2+螯合剂,其乙酰氧甲基化物BAPTA-AM易进入细胞[23],并在细胞内水解生成BAPTA,有效络合细胞内Ca2+,且对细胞无毒性[24]。有研究报道BAPTA-AM能保护Ca2+超载介导的Δψ崩溃,减少胱天蛋白酶3和胱天蛋白酶9的释放,抑制细胞凋亡[14,25]。本研究体外实验结果表明,BAPTA-AM能提高OGD/R处理的A549细胞活力,抑制LDH活性,改善细胞氧化损伤,减少NO的合成,且BAPTA-AM能改善OGD/R诱导A549细胞的Δψ崩溃,维持线粒体膜功能,进而减少细胞凋亡,由此可见本文研究结果与研究报道一致。
本研究通过尾静脉注射LPS建立小鼠ALI模型,从血清中可发现小鼠炎症因子较正常对照组显著上升,且病理切片显示模型组小鼠肺泡结构被破坏,呈现肺水肿和炎症细胞浸润,提示造模成功。
ALI发生时,肺泡毛细血管内皮细胞和肺泡上皮细胞通透性增加,造成肺泡及间充质渗透性水肿,肺水肿发生。采用肺系数和肺W/D比测定可间接反映肺组织含水量,衡量肺水肿程度。本研究体内实验结果表明,BAPTA-AML能显著降低LPS诱导的ALI模型小鼠肺W/D比和肺系数,改善ALI小鼠肺水肿。进一步研究显示,BAPTA-AML能降低LDH的活性,抑制ALI小鼠氧化损伤。
ALI患者肺泡与肺间充质内积聚大量富含蛋白质及多种炎症细胞的水肿液,促进中性粒细胞向肺间充质和肺泡腔移行[4]。激活的中性粒细胞介导活性氧的产生,刺激NF-κB表达[11,26],释放大量促炎因子如TNF-α和IL-6等,促进细胞凋亡[27],进一步损伤肺泡上皮细胞屏障[4,9]。XU 等[28]和 SAKURADA等[29]报道,BAPTA-AM能减少NF-κB的激活,消除还原型辅酶Ⅱ介导的氧化应激。在肺泡Ⅱ型上皮细胞中,Ca2+作为信使参与肺泡表面活性物质的分泌,BAPTA-AM与Ca2+络合后,内质网结合型的Ca2+被释放,通过信号转导,维持胞内Ca2+浓度平衡,促进肺泡表面活性物质大量分泌,改善肺损伤。肺组织MPO活性,可反映组织中中性粒细胞的含量,间接反映肺组织炎症浸润程度,且MPO催化反应还会生成过量的氧化物,导致氧化应激和氧化性组织损伤。本文研究结果显示BAPTA-AML能降低LPS诱导的ALI模型小鼠MPO活性、血清TNF-α和IL-6含量,提示BAPTA-AML能减少中性粒细胞的积累,减轻肺部炎症;且从病理切片可见BAPTAAML能减少ALI小鼠淋巴细胞和红细胞渗出,改善肺部炎症,减轻肺组织病理损伤,保护肺组织。
细胞实验和体内实验结果表明,BAPTA-AM改善ALI具有浓度或剂量依赖性,细胞实验中0.5 nmol·L-1时效果最佳,体内实验中50 μg·kg-1时拥有最佳效果,作用效果与给药剂量不是成正比。
综上所述,BAPTA-AM具有抗炎和抗氧化损伤作用,能抑制损伤细胞NO的合成,提高细胞活性,减轻ALI小鼠肺水肿,改善肺组织病理变化,具有良好的治疗ALI效果,有望为ALI的临床治疗带来新的方案。

