小檗碱表观遗传药理作用研究进展
张舒晨,高 斌,尚文斌,2
(1.南京中医药大学代谢病中医研究重点实验室,江苏 南京 210023;2.南京中医药大学附属医院内分泌科,江苏 南京 210029)
表观遗传学是指在不改变原始DNA序列的情况下,通过多种修饰影响基因和蛋白活性并产生可遗传的性状。这些修饰主要包括DNA甲基化、组蛋白修饰(甲基化、乙酰化、磷酸化和泛素化等)及非编码RNA等[2]。这些修饰通过改变染色质局部结构,影响DNA复制、RNA转录、DNA损伤修复与重组、蛋白表达及活性等许多过程,影响众多疾病如癌症[3]、糖尿病及其并发症[4]和心血管疾病[5]等发生发展。表观遗传学改变在诸多生理病理中发挥了重要的作用[1]。
小檗碱为清热解毒药黄连的有效成分。多年来的临床和实验药理学研究表明,小檗碱具有抗炎、抗肿瘤、抗病原微生物、调节糖脂代谢、保护心血管和免疫抑制等多种药理作用,对癌症、肠道感染性疾病、糖尿病、心血管疾病和阿尔茨海默病等具有防治作用[6-7],其应用前景广阔。近年来研究发现,小檗碱能够通过改变表观遗传修饰过程发挥药理作用,对小檗碱在表观修饰层面的深入研究有助于阐明其药理作用的新靶点和新机制。
1 调控DNA甲基化
在真核生物中,DNA甲基化是从S-腺苷甲硫胺酸上转移一个甲基至启动子中富含CpG序列区域的胞嘧啶的5号位[8],这个过程被DNA甲基转移酶(DNA methyltransferases,DNMT)所催化。DNA甲基化最主要的功能是改变基因表达,总的来说,在基因表达区甲基化程度越高,基因的表达将会下降[2]。
DNA甲基化在肿瘤发生过程中常见,许多促癌基因由于甲基化降低而被激活,抑癌基因被高甲基化而沉默[9]。非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)和2型糖尿病(type 2 diabetes mellitus,T2DM)及其并发症在分子生物学水平也可检测到大量涉及糖代谢、炎症和氧化应激等通路上DNA甲基化改变[10-11]。目前研究表明,针对不同疾病或同一疾病不同治疗机制,小檗碱既可以提高特定区域DNA甲基化,又可以促进特定区域DNA去甲基化。
1.1 DNA甲基化作用
小檗碱可以提高促癌基因启动子区域的甲基化水平以抑制其表达。组成型雄甾烷受体(constitutive androstane receptor,CAR)可以调控肝糖异生,并促进肝癌发生。在过表达CAR的HepG2细胞上给予5~25 μmol·L-1不等的小檗碱后,可以检测到细胞内总的DNA甲基化程度增强,其中CAR及其靶基因细胞色素P450酶家族的CYP2B6和CYP3A4基因启动子区的甲基化水平升高,因此CAR和P450表达被抑制,其他抗肿瘤表现可见细胞凋亡增多、细胞周期停滞、活性氧生成减少,同时还可以提高代谢酶的稳定性,延缓肝癌的发生[12]。
1.2 DNA去甲基化作用
小檗碱的抗癌机制不仅表现在能够抑制促癌基因表达,而且还能通过抑制DNMT的表达及活性,降低抑癌基因启动子区域的甲基化程度,使抑癌基因表达增多,发挥抗癌效应。DNMT包含3种酶,其中DNMT1起到维持甲基化的作用,其异常表达对癌症发展有重要影响[13],DNMT1的失活会诱导转录因子P53蛋白的磷酸化以激活下游DNA损伤通路,促使癌细胞凋亡从而防止癌变。因此DNMT1是一个潜在的良好的癌症治疗靶点[14]。应用小檗碱干预人肿瘤细胞,细胞内DNMT1和DNMET3B基因表达及蛋白水平显著下降,由此带来全细胞尤其是P53及其下游与细胞凋亡相关基因的启动子区域甲基化程度降低,从而激活P53依赖的细胞凋亡过程发挥抗癌作用[15-16]。还有在人卵巢癌细胞SKOV3中应用小檗碱的研究,发现小檗碱可以降低错配修复基因hMLH1启动子的高甲基化状态,上调其表达,抑制卵巢癌细胞增殖,诱导细胞凋亡,同时小檗碱与顺铂联合应用对卵巢癌细胞有较强的协同抗癌作用[17]。
小檗碱治疗代谢性疾病中DNA甲基化的异常,主要是通过恢复代谢通路中的关键基因的表达,促进糖和脂类的利用与转化,缓解肝变性。现有研究证明,小檗碱可以恢复异常的L型丙酮酸激酶(L-pyruvate kinase,L-PK)和微粒体甘油三酯转运蛋白(microsomal triglycerides transfer protein,MTTP)甲基化。在NAFLD模型的SD大鼠中检测到由于LPK基因启动子区域DNA甲基化程度升高因而在肝的表达降低,L-PK对细胞增殖、葡萄糖利用和甘油三酯代谢有显著的促进作用。口服小檗碱可通过L-PK启动子去甲基化恢复L-PK的表达,促进代谢[18]。MTTP是一种主要分布于肝细胞、肠上皮细胞中的脂质转移蛋白,其在甘油三酯转运及极低密度脂蛋白组装和分泌中发挥着重要作用,并与血脂障碍和肝脂肪变性等疾病的发生发展关系密切[19]。在高脂饮食(high-fat diet,HFD)诱导的NAFLD小鼠肝中,MTTP启动子的甲基化水平明显升高,其表达被抑制;小檗碱可以逆转基因表达的下调,并抑制由于HFD导致的MTTP启动子甲基化的增加,从而增加肝甘油三酯的输出,改善HFD诱导的脂肪肝[20]。
2 调控蛋白乙酰化
组蛋白和各类转录因子上赖氨酸乙酰化是常见而重要的的蛋白质翻译后修饰,由组蛋白乙酰转移酶(histone acetyltransferases,HAT)和组蛋白脱乙酰酶(histone deacetylases,HDAC)共调控此过程的动态平衡[2]。在高等生物中,HDAC可分为4类,即依赖锌离子发挥作用的Ⅰ,Ⅱ,Ⅳ类HDAC(HDAC 1~11)和依赖烟酰胺腺嘌呤二核苷酸(NAD+)的Ⅲ类HDAC,又称为Sirtuins家族(SIRT 1~7)[21]。HDAC既可以在染色质水平上通过对组蛋白的去乙酰化而稳定核小体结构,抑制基因转录,也可以通过对转录因子等非组蛋白进行去乙酰化而中和HAT作用,并能促进HAT与沉默因子的结合而发挥抑制作用[22]。
由于HDAC与HAT表达水平显著改变,导致全细胞乙酰化水平的动态平衡被打破,各种转录因子能与促癌基因特异性结合,激活基因的转录促使癌症的发生。同样,在代谢性疾病中通路上关键酶的乙酰化状态也被改变,并可与DNA甲基化修饰协同或拮抗,对各信息分子产生沉默或激活作用,影响各代谢过程。小檗碱可以通过抑制HDAC和促进Sirtuins恢复乙酰化动态平衡,对HAT的调控研究尚且不足。
2.1 促进蛋白乙酰化
现有研究结果表明,小檗碱可能通过抑制HDAC的表达及活性改变肿瘤细胞内乙酰化水平发挥抗肿瘤作用。在人肺癌细胞A549中小檗碱通过抑制总HDAC,尤其是Ⅰ,Ⅱ和Ⅳ类HDAC的活性,使得组蛋白乙酰化程度急剧上升,并触发亚G0/G1细胞周期进展阶段的正向调控,抑制A549细胞生长[23]。将小檗碱给予HeLa细胞检测到HDAC1和HDAC2表达明显下降,通过分子模拟对接显示小檗碱在HDAC1和HDAC2上可能存在结合位点。在多种血液肿瘤细胞系中小檗碱的刺激提高了组蛋白乙酰化水平,这与CREBBP和EP300的表达上调和HDAC8的表达轻度下调等有关[24]。数据库分析结果显示,小檗碱可能抑制HDAC和AKT通路蛋白合成,诱导内质网应激和自噬,并显示小檗碱可以诱导细胞核内HDAC6的底物α-小管蛋白的乙酰化,阻碍HDAC6与其结合发挥功能,而非直接抑制HDAC活性[25]。此外,小檗碱和泛HDAC抑制剂SAHA共同作用,通过提高染色质特定区域组蛋白乙酰化,从而调控细胞凋亡及分化相关蛋白的表达和稳定性,协同抑制细胞增殖和诱导细胞周期停滞[25]。
上文所述的L-PK在NAFLD大鼠肝中的表达降低不但受到基因启动子区域的DNA高甲基化影响,与L-PK基因周围组蛋白乙酰化的降低也有关。口服小檗碱可通过L-PK启动子去甲基化并同时升高L-PK周围组蛋白H3和H4乙酰化来恢复L-PK的表达,改善糖尿病糖脂代谢紊乱[18]。
2.2 促进蛋白去乙酰化
Ⅲ类HDAC中的SIRT1参与了包括基因转录、能量代谢以及细胞衰老过程的调节等许多生理过程,连接了代谢和炎症等多通路的交互。大量研究表明,小檗碱可以促进SIRT1的表达,因此可以产生改善代谢、抗炎、保护心血管等多种效应。
在肥胖和糖尿病模型动物中SIRT1的表达下降,并且在SIRT1基因敲除小鼠中会出现胰岛素抵抗和糖脂代谢异常。小檗碱通过调节SIRT1及其下游过氧化物酶体增殖物活化受体γ共激活因子1α以激活AMPK和AKT通路,从而增加胰岛素敏感性;同时激活的SIRT1还可以去乙酰化肝激酶B1(liver kinase B1,LKB1),激活AMPK通路,最终改善胰岛素抵抗[26]。小檗碱对SIRT1的上调还可以抑制氧化应激所致的肝细胞凋亡,诱导细胞自噬,诱导产生成纤维细胞生长因子21(fibroblast growth factor 21,FGF21),以此增加肝胰岛素敏感性及维持体内葡萄糖稳态,刺激能量消耗,改善肝脂肪变性[27]。
SIRT1也在炎症反应中起到一定作用,慢性炎症作为一种防御反应,本身是一种独立的疾病,同时也参与了许多疾病的发生。与炎症密切相关的转录因子核因子κB(nuclear factor kappa-B,NF-κB)对机体损伤和感染的免疫和炎症反应起主要调节作用[28]。在慢性炎症期间,NAD+和SIRT1水平显著降低,其P65上第310位赖氨酸乙酰化可以完全活化NF-κB的功能[29-30],激活SIRT1可以对NF-κB/P65的去乙酰化,减轻炎症反应[31]。经脂多糖诱导的巨噬细胞内,P65的乙酰化水平明显上升,而给予不同浓度的小檗碱后通过SIRT1的去乙酰化作用,使得P65的乙酰化水平有一定程度的下降,并使NF-κB与DNA的结合能力减弱,从而抑制下游炎症信号通路的活动,发挥抗炎效应[32]。
SIRT1的表达和活性下降还会导致心血管疾病如动脉粥样硬化、高血压、心脏肥大和心力衰竭等的发生,这可能与引起的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和NF-κB的增加和促炎途径的激活有关。也有研究表明,SIRT1的下调会促进线粒体氧化应激的关键驱动因子p66Shc表达,发生持续性血管障碍[33]。小檗碱通过上调SIRT1、B淋巴细胞瘤2蛋白(B-cell lymphoma-2,BCL-2)表达以及下调BCL-2相关X蛋白(BCL-2 associated X protein,BAX)和胱天蛋白酶 3表达以发挥心脏保护作用;还降低心肌超氧化物生成和心肌炎症标志物水平,增加心肌超氧化物歧化酶(superoxide dismutase,SOD)水平,显著提高心梗后的心功能恢复,减少心梗面积,防止心梗损伤[34]。
3 调控组蛋白甲基化
组蛋白的甲基化修饰主要发生在H3和H4的赖氨酸和精氨酸残基上,由组蛋白甲基转移酶(histone methyltransferases,HMT)催化,其调控作用取决于甲基化位点和甲基化程度,较乙酰化更为复杂而稳定,能够影响长期表观遗传记忆,并常与乙酰化修饰相排斥,精密地调控着基因表达的过程[35]。
组蛋白甲基化的异常会影响细胞活动,导致多种癌症的发生。小檗碱可以修复这种异常,但相关研究目前还不深入。在多种血液肿瘤细胞中给予一定浓度小檗碱治疗后,H3K4,H3K2和H3K36等多个与基因沉默和转录活性有关的位点甲基化水平下降,有效促进了抑癌基因的转录翻译,这与细胞内组蛋白脱甲基酶KDM6A表达上调而组蛋白甲基转移酶WHSC1Ⅰ,WHSC1Ⅱ和SMYD3下降有关,并且有分子模拟对接结果显示,赖氨酸-N-甲基转移酶可能为小檗碱的潜在靶点[24]。
4 展望
国内外许多研究表明,小檗碱部分通过表观遗传学改变机制发挥多种药理作用(图1)。表观遗传修饰是许多疾病的重要病理机制,也是目前生物医药研究的热点。
根据现有的研究结果,可以发现:①小檗碱一定程度上可以改变DNA甲基化、蛋白乙酰化和甲基化水平,从而影响下游通路发挥效应。然而小檗碱在不同分子区域对同一种表观遗传修饰可能会产生增强和抑制2种相反的作用,其具体规律还需进一步论证。并且现有的研究中尚未明确小檗碱确切的作用靶点,如小檗碱是否与相关修饰酶直接结合,以及完整清晰的作用途径。②目前的研究范围较局限,小檗碱是否通过其他表观遗传改变产生作用的相关研究较少;由于小檗碱可以同时改变多种修饰状态,产生连续或叠加效应,但具体的交互调控关系等也不十分清楚。例如,DNMT1可以对去乙酰化酶类产生调控作用[36],而小檗碱作为可能的DNMT1抑制剂,是否可以通过调控DNMT1改变HDAC表达和活性尚待证明。同样小檗碱也是可能的HDAC抑制剂,是否可以通过调节其他表观修饰酶的乙酰化来发挥作用也可进一步探索。③目前的研究均在细胞和动物实验中展开,尚缺乏涉及表观遗传的临床试验的研究。如果可以改造并应用,将有可能成为治疗癌症等疾病的新药物,因此小檗碱还有广阔的研究前景。
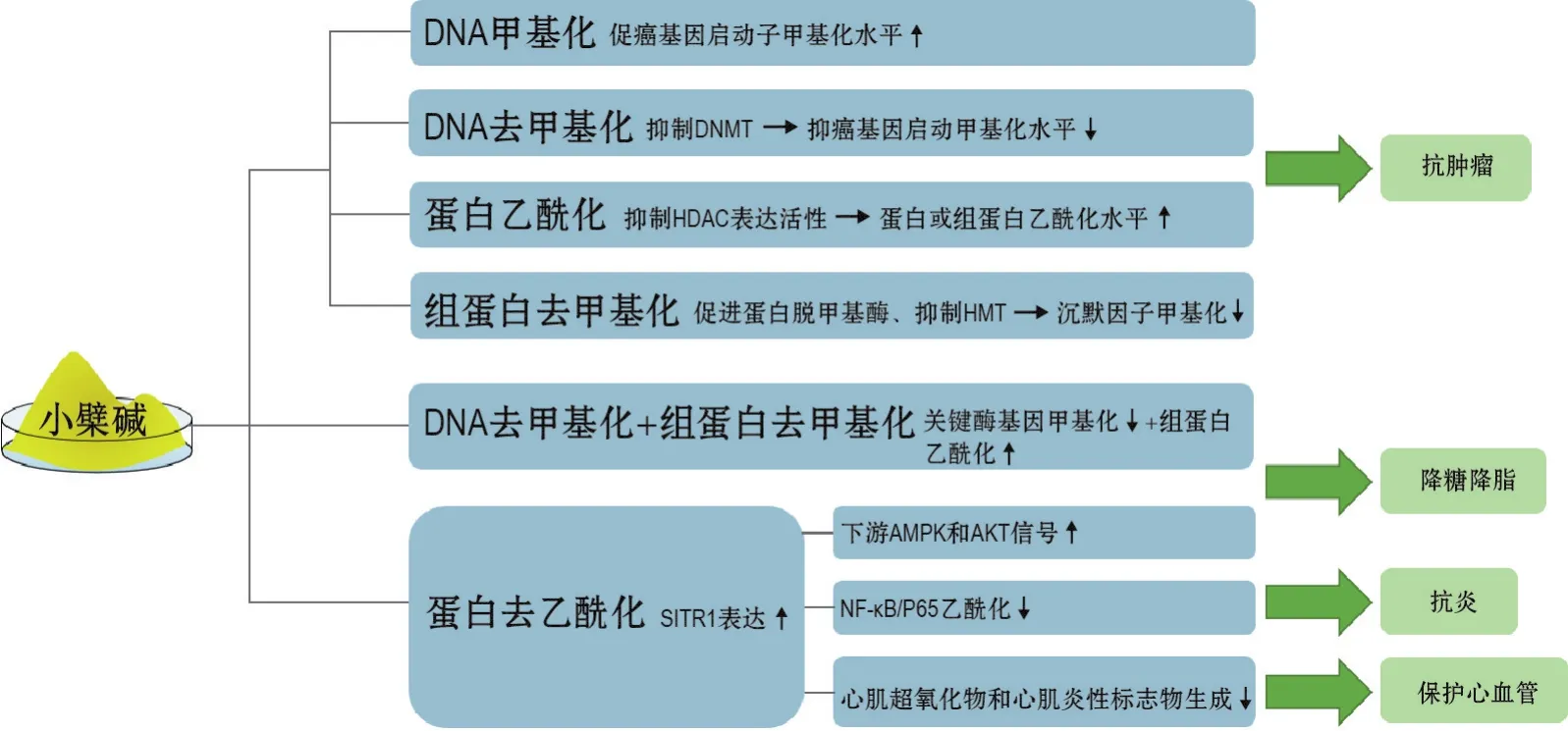
图1 小檗碱通过表观遗传修饰发挥药理作用的机制.DNMT:DNA甲基转移酶;HDAC:组蛋白脱乙酰酶;HMT:组蛋白甲基转移酶;SIRT1:沉默信息调节因子1;AMPK:AMP依赖的蛋白激酶;AKT:蛋白激酶B;NF-κB:核因子-κB.
鉴于小檗碱具有显著的药理作用,临床运用多样且疗效确切,而现有研究表观遗传作用机制可能是小檗碱药理作用分子机制的重要基础,其抑制DNMT1和HDAC的作用是明确的,在精准医学时代,小檗碱有可能成为表观遗传修饰作用靶点明确的治疗药物。所以,还需进一步对其表观遗传药理作用机制进行更加广泛而深入的研究,更快更好地阐明其明确的分子机制,并拓展其临床运用和潜在价值。

