野生型和酶活缺失型人乙酰肝素酶慢病毒表达载体的构建及其验证
万禄明,李素波,贠志敏,张 雪,高红伟,宫 锋,檀英霞
(军事科学院军事医学研究院卫生勤务与血液研究所,北京 100850)
1975年,Magnus等[1]在大鼠肝中发现了一种可以降解硫酸乙酰肝素(heparan sulfate,HS)的内切糖苷酶,随后其被命名为乙酰肝素酶(heparanase,HPA)。之后研究人员在人胎盘滋养层细胞、内皮细胞、血小板、白细胞、肥大细胞、黑素瘤和多种肿瘤细胞和组织中陆续发现有HPA的表达[2-9]。1999年,3个研究小组分别从人血小板、胎盘和黑素瘤中克隆出HPA基因[10-12]。HPA是目前已发现的哺乳动物体内唯一可以降解HS蛋白聚糖上HS侧链的内切糖苷酶,通过降解HS,HPA促进细胞外基质和细胞基底膜结构的降解和重塑[13-14]。
HPA在恶性肿瘤发生和发展中的酶活性作用已经被广泛深入地研究[15],其在乳腺癌、肝癌、卵巢癌、胰腺癌、脑部肿瘤、头颈部肿瘤、骨尤文氏肉瘤、胃癌、前列腺癌、肾癌、结肠癌、膀胱癌、多发性骨髓瘤和B淋巴细胞瘤等多种恶性肿瘤中的表达显著增多[16-18]。普遍观点认为,HPA的高表达与肿瘤患者的不良预后明显相关,其主要通过降解HS而促进肿瘤细胞的侵袭和转移。
关于HPA的非酶活性,虽然其受体仍未确定,但有报道HPA可以通过非酶活性发挥作用。例如,将HPA的酶活性位点(Glu225和Glu343)由谷氨酸突变为丙氨酸后,HPA可以通过激活Akt相关通路促进内皮细胞的黏附和迁移[19]。此外,在结肠癌和胶质瘤细胞中,无酶活性的HPA也可以通过促进Akt和Src的磷酸化,导致血管内皮生长因子A的上调[20-21]。
为了更好地研究HPA的病理生理功能,尤其是深入探讨其酶活性作用和非酶活性作用,本研究采用基因工程的手段构建了野生型和E225/343A突变型的HPA慢病毒表达载体,利用人红白血病细胞系HEL对其进行了生物学验证,为更好地研究HPA在体内的病理生理功能尤其是深入探讨其酶活性作用和非酶活性作用奠定了基础。
1 材料与方法
1.1 药物、试剂和仪器
DMEM和1640培养基,美国Hyclone公司;胎牛血清,上海吉泰依科赛公司;感受态细胞DH5α来自北京全式金生物公司;DNA分子质量标准物,美国Thermo Scientific公司;琼脂糖,北京赛百盛基因技术有限公司;CloneExpressTMⅡ一步法克隆试剂盒,南京诺唯赞生物科技公司;Taq酶和dNTP,美国Clontech公司;限制性内切酶,美国NEB公司;质粒抽提试剂盒,美国Promega公司;琼脂糖凝胶DNA回收试剂盒,北京天根公司;小鼠抗人HPA单克隆抗体和小鼠抗人GAPDH单克隆抗体,美国proteintech公司;HRP标记的抗小鼠IgG抗体(二抗),美国CST公司;检测多配体蛋白聚糖1的ELISA试剂盒来自武汉博士德公司;小鼠抗人的HS单克隆抗体(抗-10E4表位),英国amsbio公司;大鼠抗小鼠的PE偶联IgM(二抗),美国Ebioscience公司;lipo293TM转染试剂,碧云天公司;聚凝胺,北京索莱宝公司;嘌呤霉素,大连美仑公司。PCR仪来自美国AppliedBiosystems公司;电泳仪、转膜仪和凝胶成像仪来自美国Bio-Rad公司;细菌摇床来自美国Thermo Scientific公司;高速离心机来自德国Sigma公司;细菌培养箱来自上海一恒公司;流式细胞仪来自美国BD公司;ELISA洗板机来自美国BioTEK公司。
1.2 细胞、质粒和模板
HEK-293T细胞购自中国医学科学院基础医学研究所细胞资源中心,于含10%胎牛血清的DMEM培养基中培养;HEL细胞系购自上海酶研生物科技有限公司,于含10%胎牛血清的1640培养基中培养。过表达慢病毒质粒载体GV358来自上海吉凯基因化学技术有限公司,其元件顺序为Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin,酶切位点为AgeI/AgeI。辅助包装质粒psPAX2和pMD2.G保存于本实验室。基因扩增模板由上海吉凯基因化学技术有限公司提供:在NCBI的Genebank数据库中搜索人乙酰肝素酶(HPSE)的mRNA序列,其序列号为NM_006665,按照基因的CDS序列,设计全长引物,利用重叠延伸PCR方法形成模版DNA,然后将PCR产物转化克隆至pEGFP-N1质粒载体中。
1.3 引物设计
根据GV358质粒载体的序列信息,以pEGFPHPSE-N1质粒为模板,PCR扩增得到待与GV358质粒载体进行重组反应的野生型HPSE基因片段,扩增引物设计如下其中斜体部分为交换配对碱基,下划线部分为酶切位点,粗体部分为表达增强序列,小写部分为HPSE基因CDS区的扩增序列(交换配对碱基、酶切位点、表达增强序列均是GV358质粒载体上存在的序列,利于之后的重组反应;由于HPA后融合表达了3FLAG标签,所以下游酶切位点的数目以不引起移码突变为准)。所有引物由天一辉远公司合成。
1.4 定点突变
为了将野生型HPA第225位和343位的谷氨酸(GAA)突变为丙氨酸(GCA),根据重叠延伸PCR的思路,设计如下几条引物:P3:5’-CGAGCTCAAGCTTCGAATTCCGCCACCATGCTGCTGCGCTCGAAGCCTGC-3’;P4:5’-TGGTGGCGACCGGTGGATCCCGGATGCAAGCAGCAACTTTGGCATTTC-3’;P5:5’-ACTAGGCAATGCACCTAACAGTTTCCTTAAGAAGG-3’;P6:5’-CTGTTAGGTGCATTGCCTAGTTCCCAAGAAATG-3’;P7:5’-CTGGTTAGGAGCAACAAGCTCTGCATATGGAGGC-3’;P8:5’-AGAGCTTGTTGCTCCTAACCAGACCTTCTTGCCAG-3’。构建流程如下:①以pEGFP-HPSE-N1为模板,以P3和P6为引物进行PCR扩增,得到710 bp的片段a;②以pEGFP-HPSE-N1为模板,以P5和P8为引物进行PCR扩增,得到376 bp的片段b;③ 以pEGFPHPSE-N1为模板,以P7和P4为引物进行PCR扩增,得到635 bp的片段c;④以a+b+c为模板,以P3和P4为引物进行PCR扩增,得到1678 bp的片段d;⑤以d为模板,以P1和P2为引物进行PCR扩增,得到待与GV358质粒载体进行重组反应的HPSE(E225/343A)基因片段。
1.5 野生型和酶活缺失型HPSE慢病毒质粒载体的构建
利用AgeI内切酶对GV358质粒进行酶切,随后对酶切产物进行琼脂糖凝胶电泳,回收目的条带。然后线性化质粒载体和目的基因扩增产物,在ExnaseTMⅡ重组酶的作用下进行重组反应,实现线性化质粒载体和目的基因片段的体外环化。随后将重组产物转化入DH5α感受态细胞,分别挑取4个单克隆,扩增后进行菌液PCR鉴定,将阳性克隆送生工公司进行测序验证。将正确克隆菌扩大培养,提取高纯度质粒。转化子PCR鉴定引物:正向:5’-TCTTTGGAGCAGGAAACTACC-3’(针对插入片段序列);反向:5’-CCTTATAGTCCTTATCATCGTC-3’(针对质粒载体自有片段序列)。
1.6 慢病毒包装
慢病毒包装系统由吉凯基因GV358慢病毒质粒载体、psPAX2载体和pMD2.G载体3个质粒组成。GV358慢病毒质粒载体除携带目的基因序列外,还含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件。psPAX2载体中含有HIV病毒的gag基因,编码病毒主要的结构蛋白;pol基因,编码病毒特异性的酶;rev基因,编码调节gag和pol基因表达的调节因子。pMD2.G载体中含有单纯疱疹病毒来源的VSV-G基因,提供病毒包装所需要的包膜蛋白。
在10 cm培养皿中培养HEK-293T细胞,待细胞汇合度至80%~90%时,用lipo293TM转染试剂共转染 45 μg 质粒(GV358:psPAX2:pMD2.G=4∶3∶2)至HEK-293T细胞中。于感染48和72 h后收集细胞培养基,在4℃条件下,3 000×g离心15 min,然后0.45 μm过滤上清获得病毒感染液。
1.7 稳转细胞株构建
用新鲜培养基将生长在对数期的HEL细胞系种至6孔板中,每孔加入培养基的量为1 mL,加入浓度为10 g·L-1的聚凝胺1 μL作感染增强试剂,使其终浓度为10 mg·L-1;分别加入0,50,100,200,500和1000 μL的病毒感染液,轻轻混匀后放入37℃培养箱中培养;72 h后,于荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)的表达,拍照并计数5个视野内的细胞,选取GFP阳性率在80%的转染组,换液并按1∶1000的比例加入10 g·L-1的嘌呤霉素,即在终浓度为10 mg·L-1的嘌呤霉素培养基中扩大培养。
筛选约2周后,获得GFP阳性率接近100%的各组细胞,其中稳转空载体的对照细胞命名为HELCON,过表达野生型HPA的细胞命名为HEL-OE,过表达酶活缺失型HPA的细胞命名为HELMutant OE。
1.8 Western印迹法检测HPA过表达效果
收集1个10 cm培养皿的细胞,用800 μL的RIPA裂解液,于冰上充分裂解,加入0.25倍体积的5×蛋白上样缓冲液,混匀后于沸水中煮沸10 min使蛋白变性。随后进行SDS-PAGE电泳2 h以分离蛋白,电转1.5 h使蛋白转移至PVDF膜上,用5%的脱脂奶粉于室温封闭2 h后,4℃条件下过夜孵育一抗(小鼠抗人HPA单克隆抗体以1∶1000稀释、小鼠抗人GAPDH单克隆抗体以1∶3000稀释),TBST洗膜3遍后,室温条件下以1∶3000的比例孵育二抗,TBST再次洗膜3遍后,加入ECL发光液进行显影、拍照。最后用Bio-Rad凝胶成像软件分析条带积分吸光度值,以目标蛋白与内参条带积分吸光度值比值表示蛋白的相对表达水平。
1.9 过表达野生型/酶活缺失型HPA的HEL细胞中HPA酶活性的比较
1.9.1 流式细胞术检测细胞表面HS表达量的变化
作为一种内切糖苷酶,HPA特异性地降解细胞表面和细胞外基质上的HS。因此,利用针对HS上共有的10E4表位抗体[22-23],借助流式细胞术检测细胞表面HS的表达量。等量细胞分别种至10 cm培养皿中,正常培养3 d,收取细胞,PBS洗1遍后,用100 μL的0.2%BSA重悬,加入1 μL HS抗体,室温避光孵育15 min。PBS洗1遍后,用200 μL的0.2%BSA重悬,均分为2份,其中1份设为空白,另1份则加入大鼠抗小鼠的PE偶联IgM二抗5 μL,室温避光孵育15 min。PBS洗涤2遍后,用300 μL的2%多聚甲醛固定细胞,4℃避光保存,1周内流式细胞仪上样检测。用flowjo软件分析数据,通过几何平均荧光强度(Geo MFI)来表示细胞表面HS的表达量。
1.9.2 ELlSA法检测细胞培养基中多配体蛋白聚糖1的释放量
此外,作为细胞表面重要的HSPG,多配体蛋白聚糖1也会在HPA酶活性的作用下从细胞表面释放[24]。等量细胞分别种至10 cm培养皿中,正常培养3 d,收取细胞培养基,300×g离心收集。根据ELISA试剂盒说明书进行操作,检测多配体蛋白聚糖1在细胞培养上清中的含量。在450 nm的条件下读取各孔吸光度值,以标准品的浓度为横坐标、相应的A450nm值为纵坐标,绘制标准曲线,最后根据标准曲线的公式计算出样品的多配体蛋白聚糖1浓度。
1.10 统计学分析
实验结果数据以±s表示,所有实验均经过3次独立重复实验。组间比较用非配对t检验。使用PrismGraphPad软件进行数据分析和作图,P<0.05认为差异有统计学意义。
2 结果
2.1 野生型和酶活缺失型的HPA慢病毒质粒载体的验证
琼脂糖凝胶电泳结果(图1A)显示,野生型重组产物(1,2,3和4号)和酶活缺失型重组产物(5,6,7和8号)的PCR结果均为阳性。随后的测序结果显示,与NCBI上HPSE的CDS序列相比,1,2,3和4号重组产物的序列与HPSE基因完全一致,而5,6,7和8号重组产物在Glu225(图1B)和Glu343(图1C)位点上的序列均由GAA突变为GCA,实现从谷氨酸到丙氨酸的突变。
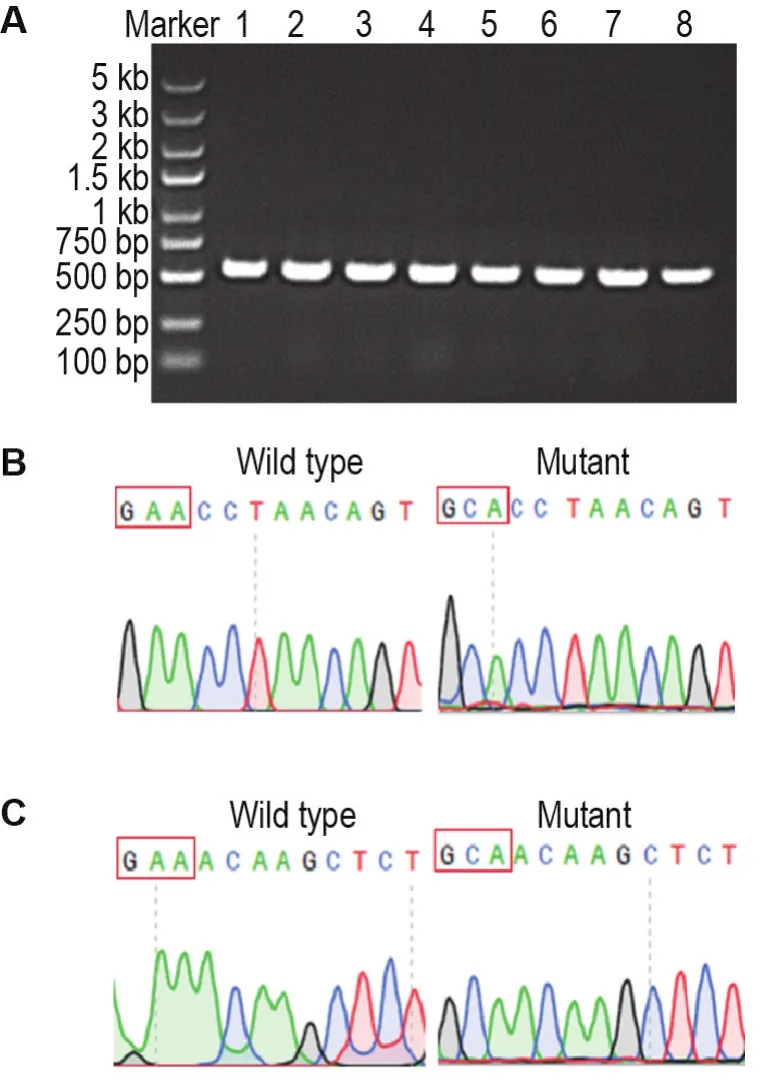
Fig.1 Construction of wild type and enzymatic activity deficiency heparanase(HPA)lentiviral expression vectors.A:PCR identification results of positive recombinant products(1→4:wild type,5→8:E225/343A mutant);B:sequencing identification results of E225A(left:wild type,right:mutant);C:sequencing identification results of E343A(left:wild type,right:mutant).
2.2 稳定过表达野生型和酶活缺失型HPA的HEL细胞系的建立
Western印迹结果(图2A)显示,HEL-OE和HEL-Mutant OE均检测到了HPA蛋白的过表达,其中既包括分子质量为65 ku的HPA前体蛋白,也包括分子质量为50 ku的HPA成熟蛋白,此结果与预期结果相符。半定量结果(图2B)显示,HEL-OE细胞和HEL-Mutant OE细胞中65 ku和50 ku的HPA表达量相当。
2.3 过表达野生型和酶活缺失型HPA的HEL细胞中HPA酶活性的比较
细胞表面HS的检测结果(图3A和B)显示,HEL-OE细胞表面HS表达量的几何平均荧光强度(Geo MFI)为 160.0±8.0,较 HEL-CON 细 胞(345.0±15.2)显著降低(P<0.01);而HEL-Mutant OE细胞表面HS表达量的Geo MFI则为353.0±14.0,与HEL-CON细胞表面HS的表达量相当。
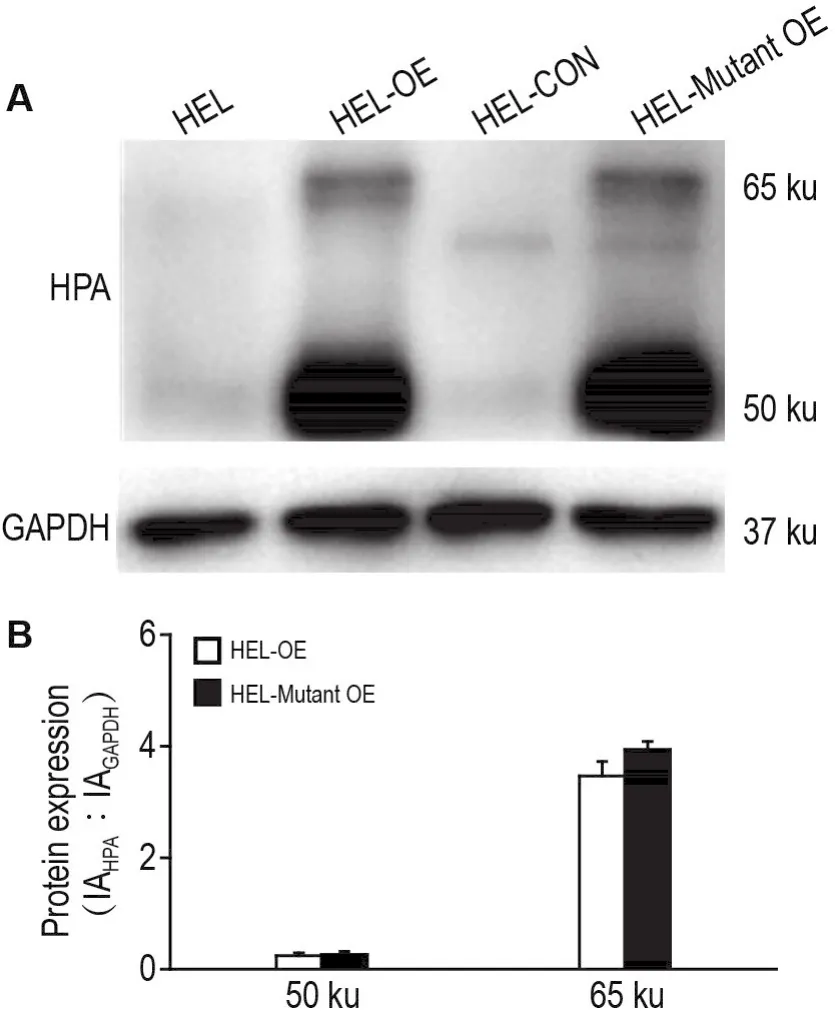
Fig.2 Expression of HPA in HEL cells.A:a representative Western blotting result of the expression of HPA(pre-HPA:65 ku;mature-HPA:50 ku);B:semi-quantitative result of A.HEL:normal cells;HEL-OE:HEL cells overexpressing wild type HPA;HEL-CON:vector control cells;HEL-Mutant OE:HEL cells overexpressing E225/343A mutant HPA.±s,n=3.

Fig.3 Validation of constructed wild type and enzymatic activity deficiency HPA lentiviral expression vectors in HEL cell line.A:a representative flow histogram for the amounts of heparan sulfate(HS)on cell surface.B:geometry mean fluorescence intensity(Geo MFI)of HS on cell surface.±s,n=3.**P<0.01,compared with HEL-CON.C:amounts of syndecan-1 in cell culture supernates.±s,n=3.**P<0.01,compared with HEL-CON.
细胞上清中多配体蛋白聚糖1的检测结果(图3C)显示,HEL-OE细胞培养基中多配体蛋白聚糖1为(59.0±3.8)ng·L-1,较HEL-CON细胞培养基中的释放量(32.2±3.9)ng·L-1明显增多(P<0.01),而HEL-Mutant OE细胞培养基中的释放量为(30.9±2.9)ng·L-1,与HEL-CON细胞培养基中的释放量相当。
3 讨论
HS蛋白聚糖是广泛存在于细胞膜和细胞外基质中的一类生物大分子,它由核心蛋白和以共价键方式连接在核心蛋白上的HS糖链构成,参与机体多种生命活动的发生、发展与调控。因此,作为哺乳动物体内唯一可以降解HS蛋白聚糖上HS侧链的内切糖苷酶[25],HPA在机体的生理病理活动中发挥多种重要作用。
早在2000年,Hulett等[26]就鉴定出HPA的酶活性存在于Glu225和Glu343位点,随后Goldshmidt和 Nadir等[27-28]通过基因编辑的手段将 Glu225和Glu3432个位点的谷氨酸突变为丙氨酸(E225/343A),在不影响HPA蛋白表达的同时,成功清除了HPA的酶活性。此后,虽然研究者逐渐注意到除了酶活性作用,HPA的非酶活性作用也具有重要研究价值[19-21],但大部分区分HPA酶活性作用和非酶活性作用的研究都是通过放射性同位素标记HS的方法来作出判定,方法繁琐并存在安全隐患;相比之下,直接构建野生型和酶活缺失型的HPA过表达载体,可以更加便捷清晰地区分和判定HPA的酶活性作用和非酶活性作用,并有助于对HPA的酶活性作用和非酶活性作用展开系统性研究。
因此,为了更深入地研究HPA的生理病理作用,本研究以基因工程技术为基础,借助慢病毒感染技术的优势,成功构建了野生型和酶活缺失型的HPA慢病毒表达载体。慢病毒载体是以人类免疫缺陷病毒为基础发展起来的基因治疗载体,它可以将外源基因有效地整合到宿主染色体上,对分裂细胞和非分裂细胞均具有感染能力,可实现目的基因的长时间稳定表达,是细胞实验的首选。本研究以pEGFP-HPSE-N1质粒为模板扩增HPA基因,用重叠延伸PCR的方法实现了HPA蛋白序列上第225位和第343位谷氨酸向丙氨酸的突变;利用无缝克隆的方法将目的基因片段与GV358慢病毒质粒载体进行拼接;随后用PCR和进一步的测序实验对序列进行鉴定和验证。最后,用构建好的野生型和酶活缺失型的HPA慢病毒感染HEL细胞,并利用Western印迹实验证明了野生型和酶活缺失型HPA蛋白的正常表达,而酶活性检测实验也证实,相对于能够有效切割HS的野生型HPA,酶活缺失型的HPA失去了切割细胞膜表面HS的能力。
综上所述,本研究为深入探讨HPA酶活性作用和非酶活性作用提供了慢病毒表达工具,考虑到HPA是机体唯一可以切割HS的内切糖苷酶,这一工具将有助于揭示HPA在调控细胞微环境中发挥的重要作用及其机制。

