2-吲哚啉酮衍生物预防给药对放射性肺纤维化模型小鼠的防护作用
李婉莹,高慧英,刘金芳2,,高 瑞,陈 慧,詹轶群,杨晓明3,,李长燕
(1.安徽医科大学,安徽 合肥 230032;2.北京正旦国际科技有限公司,北京 102206;3.军事科学院军事医学研究院辐射医学研究所,北京 100850;4.军事科学院军事医学研究院生命组学研究所,北京 102206)
肺是照射敏感器官[1],照射对肺造成的损伤为进展性的,分为2个阶段。前一阶段是放射性肺炎,主要表现为照射造成的DNA断裂损伤,Ⅰ型肺泡上皮细胞直接死亡,氧自由基增多,炎症细胞和炎症因子浸润等[2-4]。后一阶段是放射性肺纤维化(radiation pulmonary fibrosis,RPF),这一阶段至今仍被认为是不可逆转的[3]。在临床上,大量肺癌患者,尤其是非小细胞性肺癌患者需要采用放射治疗,通常会伴随肺部放射性损伤[1,5]。除此之外,暴露于照射环境也会造成肺部急、慢性损伤[5]。RPF为不可逆过程,现有治疗如糖皮质激素治疗、氧疗和抗肺纤维化药物(吡非尼酮、尼达尼布)等仅能延缓或改善症状[4,6-7],严重制约了肺癌患者放疗效果,降低患者生存率。如何减轻放射对肺造成的损伤,提高患者生存质量,是亟待解决的临床问题。2-吲哚啉酮衍生物〔3-(3-pyridylmethylidene)-2-indolinone,PMID〕是基于核因子类红细胞2相关因子2(nuclear factor erythroid 2-related factor 2,Nfr2)/Keap1通路筛选出的小分子化合物(C14H10N2O,相对分子质量为222.24),为无定型结晶黄色粉末,具有抗氧化的作用[8-9]。本研究采用小鼠全胸单次放射的方法制备RPF模型,并设置给药组和对照组,在长期观察后通过肺功能检测和病理学等方法对小鼠肺纤维化程度进行分析,进而评估PMID对RPF的防护作用。
1 材料与方法
1.1 动物、药品、试剂和主要仪器
6~8周龄C57BL/6J雌性小鼠72只,SPF级,购于北京维通利华(北京)生物技术有限公司,许可证号:SCXK(京)2006-0006,平均体质量约为(18.7±0.8)g。
PMID(军事医学研究院辐射医学研究所合成),批号为20160901,纯度99.22%;吡非尼酮(pirfenidone,PFD)(大连美仑生物有限公司);Masson三色染色试剂盒(货号G1340,北京索莱宝科技有限公司);4%多聚甲醛、羧甲纤维素钠(CMC-Na)、戊巴比妥钠和生理盐水注射液(石家庄四药有限公司);兔抗Ⅰ型胶原蛋白(alpha 2 chain of typeⅠcollagen,COL1A2)抗体(货号A5786,武汉爱博泰克生物科技有限公司);兔二步法检测试剂盒(货号PV-9001)和DAB显色液(货号ZLI-9017)(北京中杉金桥有限责任公司)。
AniRes2005动物肺功能分析系统(北京贝兰博科技有限公司),NanoZoomer 2.0-HT(日本滨松),Olympus IX71显微镜,Co60照射源(军事医学研究院)。
1.2 小鼠放射性肺纤维化模型的制备及处理
72只6~8周龄C57/6J雌性小鼠随机取60只进行造模,其中12只为正常对照。造模前禁食12 h,用1%戊巴比妥钠麻醉小鼠,麻醉剂量为0.6 mg·kg-1,麻醉后将小鼠固定,使其胸部基本位于同一水平,暴露其两腋下至胸骨剑突部位,照射部位面积约2 cm×2 cm,其余部位铅砖屏蔽,采用Co60经前胸单次照射,照射剂量为17.5 Gy,照射剂量率为104.53 cGy·min-1。
造模后,随机分为模型对照组(0.5%CMC-Na)、PMID7.5,15.0和30.0mg·kg-1组及PFD15.0mg·kg-1组。实验前1周ig给药,每天2次,间隔6 h,连续给药2周。同时设立正常对照组(0.5%CMC-Na),以上小鼠均饲养于军事医学研究院动物饲养中心屏障环境中,实验室饲养设施合格证号:SYXK(军)-2007-004。
1.3 肺功能检测
用力肺活量(forced vital capacity,FVC)和肺动态顺应性(pulmonary dynamic compliance,Cydn)是评估肺纤维化的2个经典肺功能指标。照射后26周,1%戊巴比妥钠麻醉小鼠,麻醉剂量为0.75 mg·kg-1,麻醉后切开小鼠喉部正中,钝性分离至气管暴露,在第3~4软骨环处做T型切口,插入气管插管后用缝合线在气管外打结固定,与体描箱气路相连后关闭体描箱,采集数据。
1.4 HE染色检测小鼠肺泡病理变化及Masson染色检测胶原沉积
左肺浸泡于4%多聚甲醛溶液中固定,常规脱水、浸泡、包埋和切片(5 μm),对切片进行HE染色,经扫描后,根据Ashcroft肺纤维化评分标准[10-11],在10倍镜下以组织学特征为依据对HE片进行全片连续评分,将肺纤维水平分为0~8个等级,取平均值为该片评分并进行统计学分析,评分标准见表1。
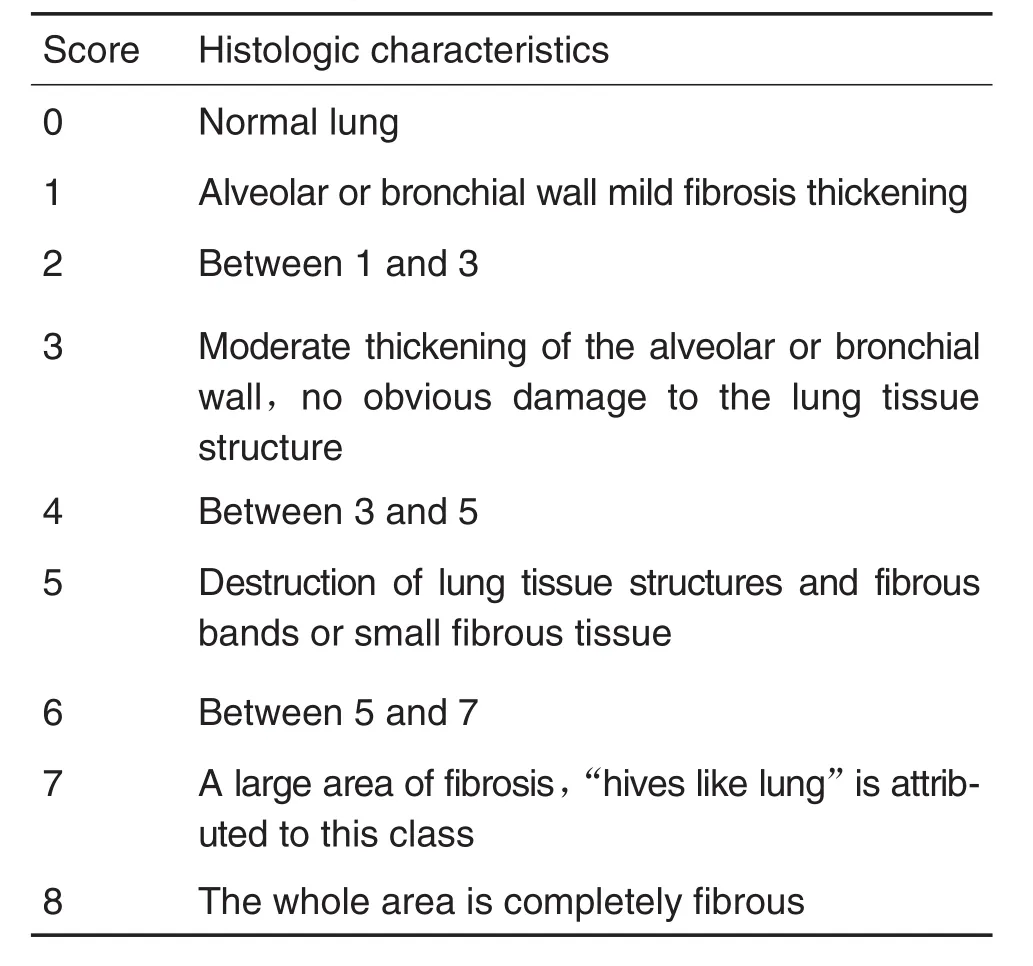
Tab.1 Criteria for grading lung fibrosis(HE staining)
Masson染色常用于评估胶原沉积,大分子如胶原纤维被染成蓝色,而小分子如肌纤维、胞浆等则被染成红色。对小鼠肺组织切片进行Masson染色,并运用Image J软件对蓝染组织面积比例进行量化分析。
1.5 免疫组织化学检测肺组织中Ⅰ型胶原蛋白的表达
COL1是上皮间充质转化的标志性蛋白产物,可作为肺纤维化程度评估的重要指标,采用免疫组织化学染色的方法特异性染COL1A2检测COL1的表达,对肺组织病理切片进行常规脱蜡处理、抗原修复、阻断过氧化物酶处理、BSA封闭后,一抗(1∶300)工作液37℃孵育1 h,孵育对应的二抗工作液37℃,1 h后进行DAB显色,显微镜下控制显色时间,苏木素染核后脱水封片,扫描。
1.6 RT-PCR检测COL1A2 mRNA的表达
用RT-PCR定量检测COL1A2mRNA的表达,从肺组织中提取总RNA,采用Thermo Scientific Revert Aid RT试剂盒进行逆转录后进行实时定量PCR,COL1A2引物F:ATGTGCCACTCTGACTGGAA;R:TCCATCGGTCATGCTCTCTC。使用Agilent Mx3000P qPCR System实时荧光定量PCR仪进行实时监测,采用2-△△Ct法表示待测基因mRNA相对表达水平。
1.7 统计学分析
实验结果数据以±s表示,通过GraphPad Prism 7软件进行统计分析,组间差异采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠放射性肺纤维化模型的鉴定
模型组小鼠经过全胸单次照射后4~6周,照射区域毛发开始变白,持续至26周(图1A)。解剖后可见正常对照组小鼠肺呈淡粉色,形态正常,而模型组小鼠肺则有不同程度损伤,部分有发白、萎缩的情况出现(图1B)。照射后小鼠生存率呈2个阶段性下降,在终点第27周,模型组小鼠生存率为45%,中位生存期为178 d(图1C),照射后2周小鼠体质量呈现明显下降,之后有所回升,照射后第26周,模型组小鼠平均体质量低于20 g,明显低于正常对照组(P<0.01)(图1D和E)。评估了照射26周后小鼠肺功能情况。结果显示模型组小鼠肺功能受到严重损伤,相较于正常对照组小鼠,FVC明显下降(P<0.01)(图1F),Cydn也显著下降(P<0.01)(图1G)。HE染色可见未照射小鼠肺泡结构完整,Masson染色未见明显胶原沉积,而照射小鼠则出现严重肺病理损伤,丧失肺泡正常结构,出现大片融合现象,局部表现为完全的纤维化阻塞,Masson染色可见大片蓝染区域(胶原沉积部位),说明照射小鼠肺部出现严重胶原累积(图1H和I)。总之,照射后小鼠肺受到明显损伤,呈现明显纤维化改变,表明造模成功。
2.2 PMlD预处理可改善放射性肺纤维化小鼠的生存率和体质量下降
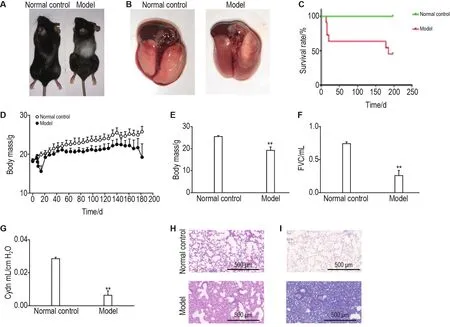
Fig.1 Establishment of radiation pulmonary fibrosis(RPF)mouse model.Totally 72 female C57/6J mice aged 6-8 weeks were randomly divided into two groups:the normal control group(n=12)and the model group(n=60).The mice were fasted for 12 h before anesthesia,and the mice were anesthetized with 1%sodium pentobarbital 0.6 mg·kg-1,exposed from underarms to the sternal process of the sternum.A single dose of Co6017.5 Gy whole chest irradiation was performed with a radiation dose rate of 104.53 cGy·min-1.A:appearance of irradiated and non-irradiated mice.After irradiation,the hair in the irradiated area of the mouse turned white,and there was hair loss to different degrees;B:lung appearance of mice(left);C:survival rate of mice(right);D:body mass of mice;E:body mass of mice at the 26thweek after irradiation(the end stage).±s.*P<0.05,**P<0.01,compared with normal control group;F:forced vital capacity(FVC)at the end stage;G:pulmonary dynamic compliance(Cydn)at the end stage;H:HE staining;I:Masson staining.
照射后,各照射组小鼠出现不同程度的死亡,至27周终点期间,模型组小鼠生存率下降至45%,中位生存期为178 d;PMID 7.5 mg·kg-1组小鼠生存率下降至40%,未见改善;而PMID 15.0 mg·kg-1组、PMID 30.0 mg·kg-1组和PFD组小鼠中位生存期均>189 d(图2A)其中,PMID 15.0 mg·kg-1组小鼠在终点生存率为73%,较模型组生存率高28%,较PFD阳性对照组生存率高15%(图2B)。小鼠的死亡主要集中在照射后4周内及第20周后,而在前一阶段,PMID 15.0 mg·kg-1组和PMID 30.0 mg·kg-1组小鼠并未出现死亡(图2A)。照射后1周内各组小鼠体质量出现明显下降,并在1周后回升,25周后,模型组小鼠再次出现较明显体质量下降(图2C)。至27周终点,各照射组小鼠平均体质量均低于正常对照组小鼠平均体质量,各照射组中模型组平均体质量最低(图2D)。
2.3 PMlD预处理可提高放射性肺纤维化小鼠的肺FVC和Cydn值
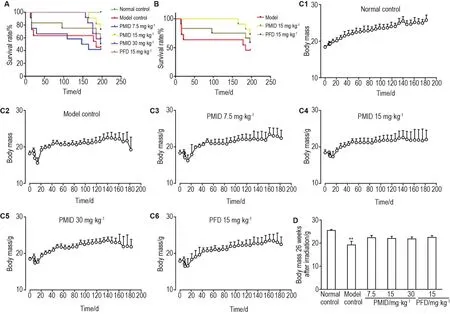
Fig.2 Effect of 3-(3-pyridylmethylidene)-2-indolinone(PMlD)on survival rate and body mass of RPF mice.PMID was given 1 week before the experiment,twice a day,at intervals of more than 6 h,for 2 weeks.A:survival rate of each group,staged declines happened within 4 and 20 weeks after irradiation;B:survival rate of model,PMID 15 mg·kg-1and PFD 15 mg·kg-1group;C1-C6:body mass of each group,irradiation mice showed staged declines in 1 to 25 weeks after radiation;D:body mass of each group.±s,n=12,*P<0.05,**P<0.01,compared with normal control group;#P<0.05 ,##P<0.01,compared with model control group.
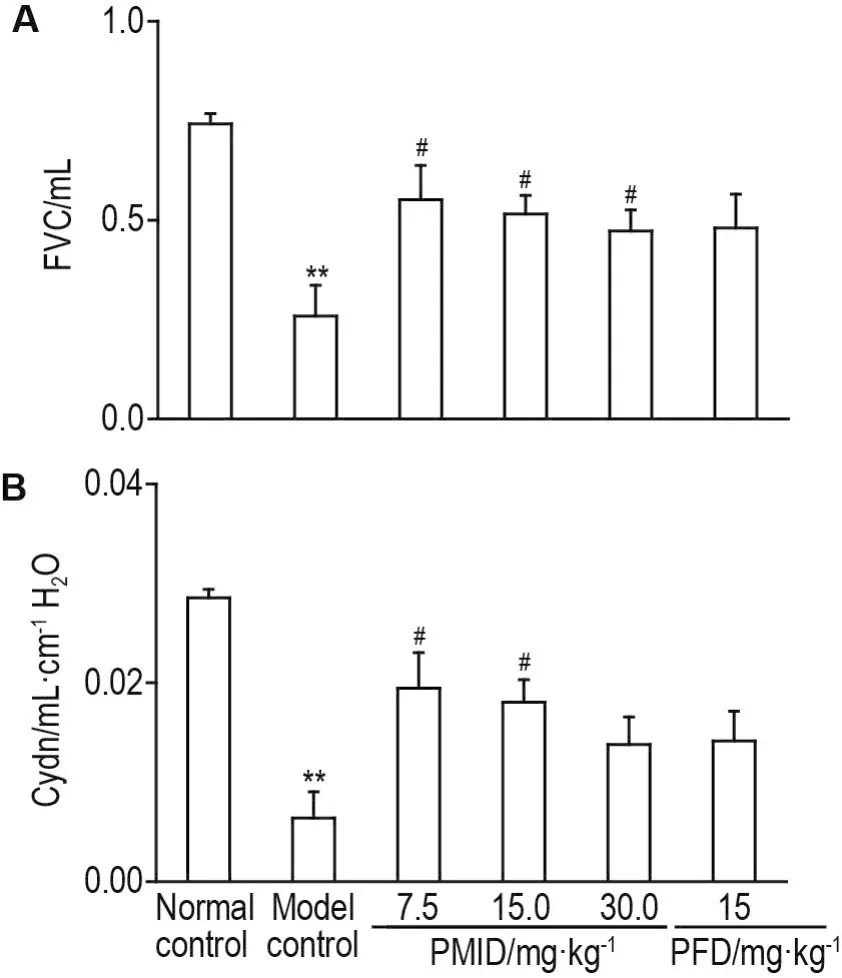
Fig.3 Effect of PMlD on lung respiratory function of RPF mice at 26 weeks after irradiation.See Fig.2 for the mouse treatment.x ± s,n=12,*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
肺功能检测结果(图3)显示,Co60照射后26周后,与正常对照组相比,模型对照组小鼠FVC值〔(0.26±0.08)mL〕和 Cydn值〔(0.006±0.002)mL·cm-1H2O〕明显下降(P<0.01);与模型对照组相比,PMID各组小鼠肺功能下降情况得到明显改善,其中PMID 7.5和15.0 mg·kg-1组小鼠FVC值分别为0.55±0.09和(0.52±0.05)mL(图3A),Cydn值分别提升至0.019±0.004和(0.018±0.002)mL·cm-1H2O(P<0.05)。
2.4 PMlD预处理可减轻放射性肺纤维化小鼠的肺病理损伤
HE染色结果(图4)显示,正常对照组小鼠肺部结构正常,肺泡间隔无增厚,血管周围无明显细胞浸润。模型对照组小鼠肺泡结构遭严重破坏,失去正常肺泡结构,出现大面积纤维化,血管周围有大量炎细胞浸润,甚至有“蜂窝肺”表现。与模型对照组相比,PMID各剂量组肺损伤有一定程度缓解,PMID 15.0和30.0 mg·kg-1组肺部基本可见正常结构,肺泡壁有不同程度增厚,偶可见纤维带或小纤维团块。
肺组织纤维化评分结果显示,与正常对照组肺组织纤维化评分0.84±0.19相比,模型对照组肺组织纤维化评分明显升高,为5.99±0.69(P<0.01)。与模型对照组相比,PMID 7.5和15.0 mg·kg-1组肺组织纤维化评分分别为2.75±0.45和2.65±0.42,明显低于模型对照组(P<0.01)。
2.5 PMlD预处理可降低放射性肺纤维化小鼠的肺胶原含量
正常对照组肺泡间隔几乎无胶原沉积(13.54±3.42)%,仅小血管周围有一定胶原沉积。模型对照组则可见大量胶原物质沉积(52.17±8.39)%(P<0.01)。PMID各给药组胶原沉积情况相较于模型对照组有明显减轻,主要沉积于血管周围沉积,肺泡壁仅有少量胶原沉积。其中,PMID 15.0 mg·kg-1组〔(15.55±3.40)%〕、30 mg·kg-1组〔(17.94%±4.70)%〕和PFD组〔(12.92±3.50)%〕蓝染组织面积比例较模型对照组明显下降(P<0.01)(图5)。
2.6 PMlD预处理可减少放射造成的Ⅰ型胶原形成
免疫组化结果(图6A)显示,正常对照组小鼠肺仅气管周围有少量COL1A2阳性表现,而模型对照组视野内可见大量COL1A2阳性区域染色,PMID给药组和PFD组COL1A2表达均有所下降,其中,PMID 7.5 mg·kg-1组阳性反应最弱。
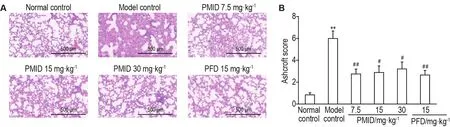
Fig.4 Effect of PMlD on lung histopathological damage of RPF model mice at the 26thweek after irradiation by HE staining.See Fig.1 for the mouse treatment.B:the semi-quantitative result of A.±s,n=12,*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
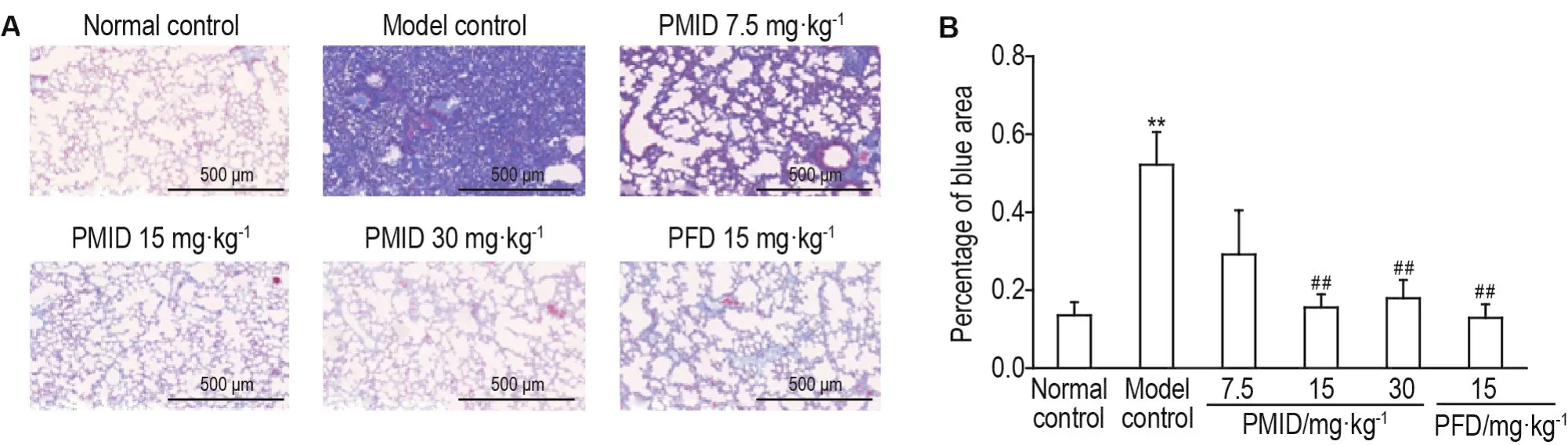
Fig.5 Effect of PMlD on lung collagen deposition of RPF model mice at the 26thweek after irradiation by massion staining.See Fig.2 for the mouse treatment.B:the semi-quantitative result of A.±s,n=12,*P<0.05,**P<0.01,compared with normal control group;#P<0.05 ,##P<0.01,compared with model control group.
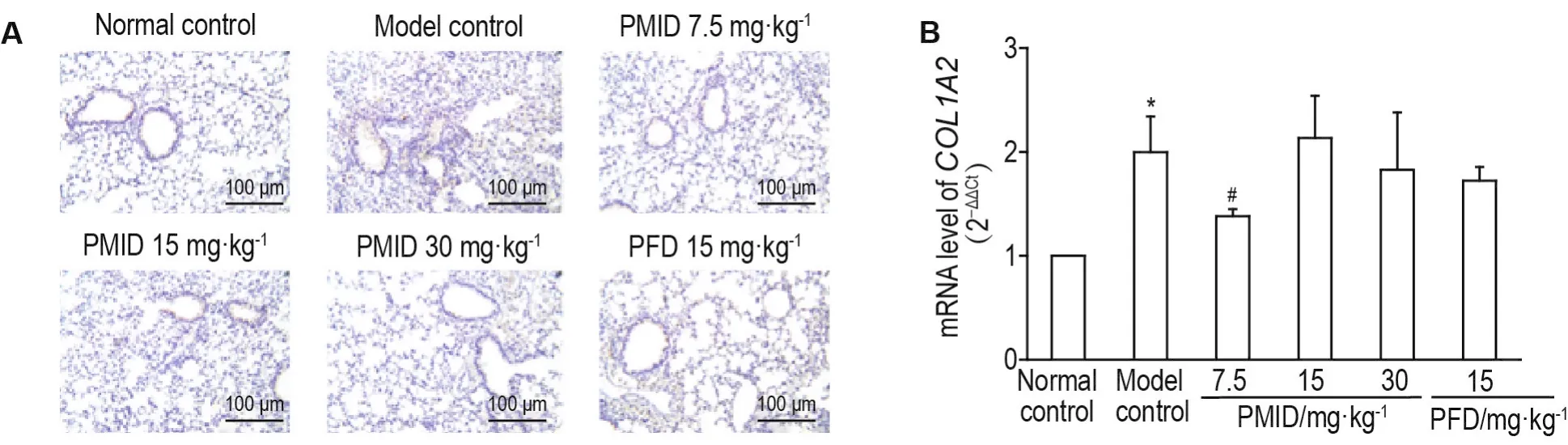
Fig.6 Effect of PMlD on expression of COL1A2 of RPF model mice by immunohistochemical staining(A)and RT-PCR(B).See Fig.2 for the mouse treatment.±s,n=4,*P<0.05,compared with normal control group;#P<0.05,compared with model control group.
RT-PCR的结果(图6B)显示,照射后,各组小鼠COL1A2mRNA均有升高。其中,与正常对照组相比,模型对照组COL1A2mRNA表达上升(P<0.05)。与模型对照组相比,PMID 7.5 mg·kg-1组COL1A2mRNA表达下降(P<0.05),与免疫组织化学染色的结果相符,说明PMID预处理可减少辐射造成的COL1形成。
3 讨论
17.5 Gy Co60单次全胸照射后2周内及24周后,照射小鼠体质量下降,活动减少,严重者甚至出现死亡。在照射后4周,被照射小鼠开始出现照射区域皮毛变白的情况。长期观察小鼠生存率及体质量变化,可见照射小鼠体质量始终低于正常对照组小鼠体质量,给予PMID或PFD可在一定程度上减轻小鼠的体质量下降;照射后26周,模型组小鼠死亡过半,解剖发现小鼠肺出现局部肉眼可见损伤,甚至发白、萎缩;给予小鼠不同浓度的PMID可避免照射后小鼠的早期死亡发生。侵入性肺功能检测结果说明,给予PMID能显著改善照射造成的小鼠肺功能下降,并且,PMID 15 mg·kg-1组无论生存率还是肺功能的改善方面,效果均优于PFD。HE染色可见,PMID预防给药小鼠肺结构较为正常,肺泡间隔增厚情况相较于模型组有明显减轻,病理损伤评分由模型组的5.99±0.69降至2.88±0.60,说明对其病理损伤有明显改善。Masson染色结果也说明,给予PMID预处理能有效减少照射后小鼠肺胶原物质沉积。总之,PMID预防给药能明显减轻RPF小鼠肺纤维化病变,且效果优于PFD。
RPF是一种进展性肺损伤,伴有慢性炎症和异常器官修复[4,7],其特征包括肌成纤维细胞增生、胶原累积、肺泡间隙增厚和正常肺结构的破坏[12]。模型组小鼠中表现为HE染色片中肺正常结构损坏,肺泡间隔增高;Masson染色片中可见大量胶原纤维累积。异常修复过程会使肺失去正常结构,原有的肺泡结构和血管组织遭到破坏,影响肺正常呼吸功能,引起肺功能下降、血氧饱和度下降以及肺动脉高压等[6]。在RPF小鼠模型中可观察到肺纤维化关键指标FVC与Cydn的下降。慢性放射损伤本质上是一种异常的伤口愈合,越来越多的证据表明,损伤表型由慢性炎症维持,导致转化生长因子β的过度表达和激活,从而导致实质细胞耗竭和过度纤维化[13-14]。
Nrf2在纤维化病变中起到重要作用。一方面,氧化应激是RPF的主要机制之一[4,7,15-16],Nrf2可与抗氧化反应元件结合,促进下游抗氧化酶如NADPH醌氧化还原酶和血红素加氧酶1的表达,发挥抗氧化作用,起到保护细胞的作用[9,17]。除此之外,Nrf2可阻断Smad2/3磷酸化,阻碍其复合物形成,从而抑制转化生长因子β/Smad信号通路[18-20],减少下游纤维化产物如COL1等的形成,发挥其抗纤维化作用[21-22]。本研究结果显示,PMID发挥抗肺纤维化作用可能也与Nrf2对该通路的抑制作用有关。
综上所述,PMID在RPF模型小鼠中表现出很好的防护作用,有望成为放射性肺纤维化的新型药物,具有极大的临床开发价值。

