磷酸肌酸钠通过miR-25-3p/肌浆网Ca2+泵-2a信号通路改善多柔比星诱导大鼠心肌损伤
张雪洁,尧 青,胡 玲,柯志强,张 波,3,孟祥雯,杨晓松
(湖北科技学院1.药学院,2.糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100;3.三峡大学第二人民医院,湖北 宜昌 44300)
临床上常单独使用多柔比星(doxorubicin,DOX)或与其他抗肿瘤药物联合用于治疗实体肿瘤、淋巴瘤和儿童白血病[1],但因其严重的心脏毒性限制其在临床的应用[2]。研究结果显示,DOX心脏毒性主要因其介导活性氧自由基(reactive oxygene species,ROS)大量产生引起心肌组织脂质过氧化,而抗氧化活性的下降,最终导致氧化应激和细胞凋亡[3]。此外,DOX还能刺激心肌细胞线粒体和肌浆网释放Ca2+从而加剧胞浆内Ca2+超载[4]。肌浆网 Ca2+泵-2a(sarco/endoplasmic reticulumCa2+ATPase,SERCA2a)是分布在哺乳动物心肌中的重要Ca2+泵,在心动周期中控制Ca2+的输运,通过水解ATP获得的化学能源输运Ca2+进入肌浆网内[5]。SERCA2a通过维持Ca2+平衡确保心肌细胞的正常生理活动。当心肌细胞内肌浆网Ca2+吸收不够,将会导致心肌细胞收缩,可用的Ca2+减少,最终导致心脏收缩和舒张功能出现障碍[6]。已有研究表明,DOX在心肌细胞中产生的H2O2会抑制SERCA2a的mRNA转录和蛋白表达,SERCA2a摄取Ca2+的能力显著下降[7]。因此,SERCA2a在DOX心脏毒性中发挥重要调控作用,具体调控机制还不清楚。
微RNA(microRNA,miRNA,miR)作为基因表达的重要调节物,通过与目的基因mRNA的3’UTR区域结合,在转录后或翻译水平抑制基因表达,在许多生理及疾病的发生发展过程中发挥重要作用[8]。在多种心血管疾病如心律失常、左心室肥厚和重构中[9]都可检测到miR-25的异常表达,如在心力衰竭的心肌组织中miR-25高表达,抑制miR-25的表达可增强心脏收缩力从而改善心力衰竭[10]。据报道,在主动脉缩窄术诱导小鼠心衰模型中,miR-25靶向SERCA2a mRNA3′UTR,抑制SERCA2a的表达,是主动脉弓缩窄(transverse aortic constricition,TAC)诱导心衰的重要因素[11]。也有研究认为,miR-25在离体心肌细胞延迟Ca2+的摄取,抑制miR-25表达可以提高SERCA2a表达水平,从而达到改善心脏功能的目的[12]。
磷酸肌酸钠(creatine phosphate sodium,CP)是一种小分子高能磷酸化合物,也是心肌细胞最主要和最直接的功能物质,可快速进入细胞并在短时间内即达到有效浓度。具有保护细胞结构,稳定心肌细胞电生理平衡的功能[13],在临床上作为心肌保护药物,主要用于治疗心力衰竭和心肌梗死等的治疗药物[14-15],近年来也在临床上用于DOX所致心肌损伤的保护药物[16],但其保护机制目前还不清楚。本研究采用DOX诱导SD大鼠心肌损伤以及诱导心肌细胞H9C2损伤作为体内外模型,采用CP进行干预,评价CP对DOX所致心肌损伤的保护作用,并探讨其可能的作用机制。
1 材料与方法
1.1 试剂和主要仪器
DOX粉末和CP(美国Sigma公司);N-乙酰半胱氨酸(N-acetyl-L-cystine,NAC)(中国Meilunbio公司);DMEM培养基和胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);HE染色试剂盒和Masson三色染色试剂盒(北京索莱宝科技有限公司);Trizol试剂(美国Ambion公司);TUNEL细胞凋亡检测试剂盒(TUNEL Apoptosis Detection Kit FITC)(上海翊圣生物科技有限公司);RT-PCR试剂盒(日本Takara公司);细胞裂解液、蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)、BCA蛋白定量/浓度测定试剂盒(中国Meilunbio公司);化学发光(electro-chemilumines-cence,ECL)显影液,蛋白酶抑制剂(protease inhibitor cocktail)(美国Thermo Fisher公司);兔抗人SERCA2a多克隆抗体(中国ABclonal公司),小鼠抗人超氧化物歧化酶2(superoxide dismutase 2,SOD2)单抗(美国Abcam公司),兔抗人活化的胱天蛋白酶3多克隆抗体(美国Cell Signaling Technology公司);辣根过氧化物酶标记山羊抗兔IgG和山羊抗小鼠IgG抗体(二抗)(美国Biosharp公司)。
1.2 动物和DOX诱导大鼠心肌损伤模型制备
40只SD雄性大鼠,实验动物合格证号:SCXK(京)2016-0011,体质量180~200 g,购自北京维通利华实验动物技术有限公司。SD大鼠随机分为3组,以下给药均为隔天1次(给药持续26 d)。正常对照组(n=10),ip给予生理盐水 5 mL·kg-1;DOX组(n=15),前3次ip给予生理盐水5 mL·kg-1,之后ip给予生理盐水30 min后,再ip给予DOX 2 mg·kg-1,共给药7次;CP+DOX组(n=15),前3次ip给予CP 200 mg·kg-1,之后ip给予CP 200 mg·kg-130 min后,再ip给予DOX 2 mg·kg-1,共7次,之后ip给予CP 200 mg·kg-13次,停药后继续喂养7周,处死大鼠取心肌组织-80℃冰箱保存备用。
1.3 HE染色观察大鼠心肌组织病理变化
固定后的心脏组织按照常规方法进行组织脱水、透明、浸蜡、包埋以及切片。之后将石蜡切片放入二甲苯中脱蜡10 min,经100%~70%梯度乙醇浸泡5 min,使用PBS冲洗5 min,滴加50 μL苏木精染色15 min后用自来水冲洗,滴加1%盐酸乙醇分化数秒后,使用1%氨水返蓝1 min,自来水冲洗,接着滴加50 μL伊红染色5 min,在80%~95%梯度乙醇中快洗,100%乙醇浸泡10 min(处理2次),二甲苯透明10 min(处理2次),中性树胶封片,显微镜下观察并拍照。
1.4 Masson染色检测心肌组织胶原纤维沉积
将心尖组织切片脱蜡后放在二甲苯Ⅰ、Ⅱ各10 min,再分别用95%,90%,80%,70%乙醇浸泡5 min,之后滴加Bouin液在湿盒中过夜,第2天流水冲洗至黄色消失,天青石蓝染色液滴染2~3 min后稍水洗,之后用Mayer苏木素染色液滴染2~3 min后水洗,酸性乙醇分化液分化约10 s,接着流水冲洗10 min,丽春红品红染色液滴染2 min,蒸馏水冲洗;磷钼酸溶液处理约10 min,倾去上液,直接滴入苯胺蓝染色液染6 min,0.1%~0.3%冰醋酸溶液处理约30 s,100%乙醇脱水2 min,二甲苯透明10 min,吹干后用中性树胶封片,显微镜下观察胶原累积。
1.5 TUNEL染色法检测大鼠心肌组织细胞凋亡
石蜡组织切片常规脱蜡至水,用PBS轻轻润洗切片并用滤纸小心吸干玻片上样本周围多余的液体;每个样本上滴加100 μL蛋白激酶K工作液,室温孵育20 min;滴加100 μL 1× Equilibration 缓冲液室温孵育10~30 min,加入50 μL TdT孵育缓冲液37℃孵育60 min,用PBS洗5 min,共2次;在暗室中将载玻片浸入DAB溶液中,室温孵育5 min,用H2O终止反应;封片,在普通光学显微镜下观察拍照。采用Image Pro软件对图片结果进行分析,选取阳性染色部位光密度(intensity absorbance,IA)值与图片的面积之比即为平均光密度值,以此值来半定量细胞凋亡。
1.6 H9C2心肌细胞培养和分组
大鼠心肌细胞系H9C2(上海复旦IBS细胞资源中心);H9C2细胞在37℃5%CO2条件下培养于含10%FBS及1%青、链霉素混合液(100×)的DMEM培养基中,细胞融合度为80%~90%时传代。将处于对数生长期的H9C2细胞种于6孔细胞培养板内,培养24 h后给药。分组① DOX 1 μmol·L-1处理心肌细胞H9C2不同时间(0,3,6,12和24 h),收集细胞。分组② 细胞分为5组:细胞对照组(0.1%DMSO),DOX 1 μmol·L-1组,CP 1 mmol·L-1组,CP 1 mmol·L-1+DOX 1 μmol·L-1组,NAC 0.5 mmol·L-1+DOX 1 μmol·L-1组,处理24 h后收集细胞。
1.7 CCK8检测H9C2心肌细胞存活率
取1.6分组②前4组的细胞,置37℃CO2培养箱培养24 h后,每孔加入10 μL CCK8试剂,然后置培养箱中继续培养2 h后,采用酶标仪测定450 nm处的吸光值(A450nm)。细胞存活率(%)=(实验组A450nm-空白孔A450nm)/(细胞对照组A450nm-空白孔A450nm)×100%。
1.8 荧光定量PCR检测大鼠心肌组织和H9C2心肌细胞中miR-25-3p的表达
取1.2分组大鼠心肌组织0.2~0.4 μg,加入1 mL Trizol,采用电动匀浆机将组织磨碎,然后加入1/5体积的氯仿,涡旋振荡混匀后静置10 min,4℃条件下12 000×g离心5 min,将上清转移至另一离心管内,加入等体积异丙醇,涡旋振荡后静置10 min,12 000×g,4℃条件下离心10 min,弃上清,加入1 mL 75%乙醇洗涤沉淀,12 000×g,4℃条件下离心5 min,吸干乙醇,通风橱内吹干,加入适量无RNA酶无菌水溶解沉淀,超微量核酸分光光度计测定RNA浓度及纯度,-20℃保存以备后续荧光定量分析。1.6分组①和分组②的细胞采用Trizol裂解H9C2细胞,后续总RNA提取同上;以抽提的总RNA作为模板,采用茎环引物rno-miR-25-SLP合成cDNA,再以cDNA为模板,SYBR Green I作为荧光染料,U6作为内参,rno-miR-25-3p和UDP作为正反引物检测miR-25-3p的表达水平,用2-△△Ct法计算待测基因的相对表达。引物序列见表1。
1.9 Western印迹法检测大鼠心肌组织和H9C2心肌细胞SOD2、SERCA2a和活化的胱天蛋白酶3蛋白表达
取1.2分组大鼠心肌组织,加入含蛋白酶抑制剂的RIPA,冰浴条件下采用电动匀浆机打碎组织,冰浴10~20 min,4℃条件下以12 000×g,离心10 min,将上清转移至另一干净离心管,采用BCA法测定蛋白浓度;1.6分组②前4组细胞加入含蛋白酶抑制剂的RIPA,充分裂解细胞,后续蛋白抽提方法同上;SDS-PAGE蛋白电泳分别采用4%的浓缩胶和10%的分离胶,上样量为25 μg总蛋白,电泳结束后转至PVDF膜,5%脱脂牛奶封闭1 h,然后更换为一抗(1∶1000)溶液于4℃孵育过夜;TBST洗膜3次,每次10 min,二抗(1∶5000)溶液室温孵育1 h,TBST洗膜3次,每次10 min,用ECL显影液显影,经Bio-Rad凝胶成像系统进行图像采集,Image J软件进行半定量分析,用目的蛋白条带和内参蛋白条带IA值的比值表示目的蛋白相对表达水平。

Tab.1 Sequence of primers for RT-PCR
1.10 统计学分析
实验结果数据采用±s表示。采用GraPhPad Prism 5 Project软件进行数据分析,用单因素方差分析和t检验进行分析处理,以P<0.05为差异有统计学意义。
2 结果
2.1 磷酸肌酸钠对多柔比星诱导大鼠心肌组织病理损伤的影响
大鼠心肌组织HE和Masson染色结果(图1)所示,DOX组心肌组织肌纤维排列紊乱,甚至部分肌原纤维溶解、断裂,胶原纤维增多;相对于DOX组,CP+DOX组心肌组织肌纤维排列较为整齐,肌纤维较完整,胶原沉积量减少,心肌组织病理病变得到改善。
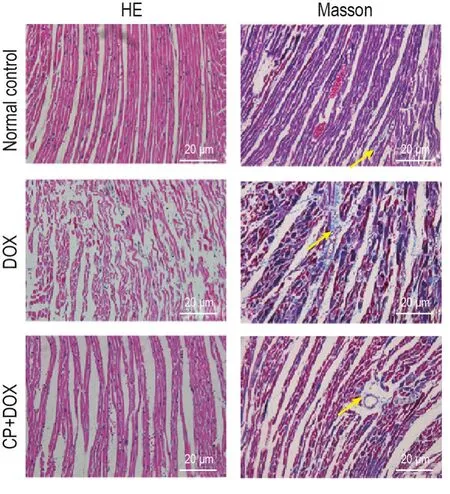
Fig.1 Effect of creatine phosphate sodium(CP)on pathological changes in myocardial tissues of rats with myocardial injury induced by doxorubicin(DOX).Rats were ip injected with normal saline(5 mL·kg-1)or DOX(2 mg·kg-1),or CP(200 mg·kg-1)+DOX once every other day,for 7 times,and then were fed for another 7 d after the last injection.Arrows show the collagen accumulation in rat myocardial tissue.
2.2 磷酸肌酸钠对多柔比星诱导大鼠心肌组织细胞凋亡的影响
TUNEL染色结果(图2)所示,与正常对照组比较,DOX组心肌组织的棕黄色阳性细胞核增多,约为正常对照组的4倍(P<0.05);CP+DOX组阳性染色细胞核明显少于模型组,约为DOX组的1/2(P<0.05),表明CP能够减轻DOX诱导的心肌细胞凋亡。
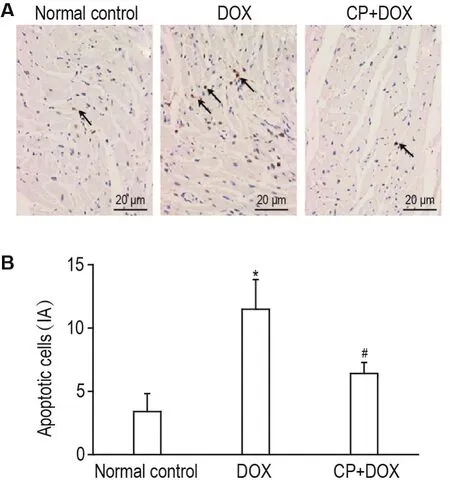
Fig.2 Effect of CP on apoptotic rate of myocardiocytes of rats with myocardial injury induced by DOX(TUNEL staining).See Fig.1 for the rat treatment.Arrows show apoptosis cells in the rat myocardial tissues.B:semi-quantitative result of A.IA:intensity absorbance.±s,n=5.*P<0.05,compared with normal control group;#P<0.05,compared with DOX group.
2.3 磷酸肌酸钠对多柔比星诱导大鼠心肌和H9C2细胞miR-25-3p mRNA表达的影响
荧光定量PCR法检测结果(表2)显示,与正常对照组比较,DOX组大鼠心肌组织中miR-25-3p表达上升了4.57倍(P<0.05),而CP+DOX组miR-25-3p表达水平相对DOX组下降77.3%(P<0.05),基本恢复到正常对照组的水平。

Tab.2 Effect of CP on miR-25-3p mRNA in myocardial tissue of rats with myocardial injury induced by DOX
荧光定量PCR分析结果(图3A)显示,H9C2细胞miR-25-3p表达水平随着DOX刺激时间的延长而持续升高,呈时间依赖性上调(r=0.9681,P<0.05)。与 DOX 1 μmol·L-1组比较,NAC+DOX 组和CP+DOX组miR-25-3p表达水平均显著下调(P<0.05)(图3B)。
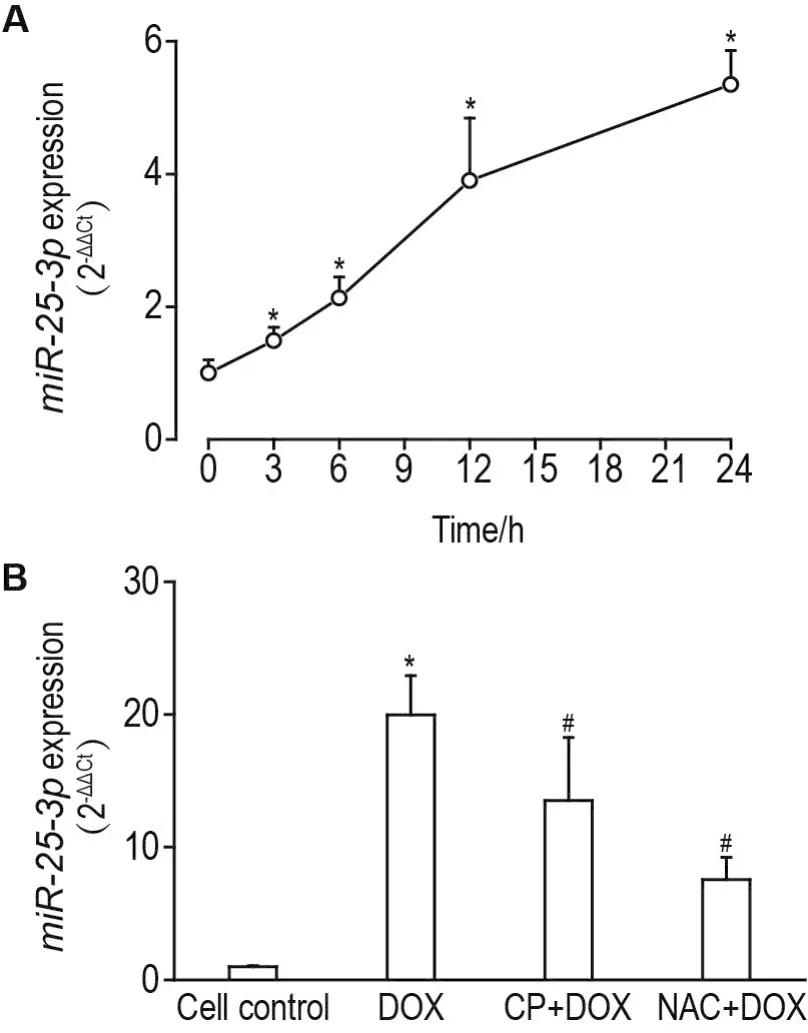
Fig.3 Effect of CP or N-acetylcysteine(NAC)on miR-25-3p mRNA expression in H9C2 cells induced by DOX by quantitative real-time PCR(qRT-PCR).A:H9C2 cells were treated with DOX 1 μmol·L-1for 0,3,6,12 and 24 h.±s,n=3.*P<0.05,compared with cell control group(0 h).B:H9C2 cells were pretreated with CP 1 mmol·L-1or NAC 0.5 mmol·L-1 for 1 h,then DOX 1 μmol·L-1for 24 h.±s,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with DOX group.
2.4 磷酸肌酸钠对多柔比星诱导H9C2心肌细胞活力的影响
CCK8检测结果(图4)显示,DOX 1 μmol·L-1组H9C2细胞存活率显著降低(P<0.05);与DOX组相比,CP+DOX组细胞存活率升高(P<0.05),表明CP 1 mmol·L-1能够明显改善DOX对H9C2细胞存活的抑制作用。
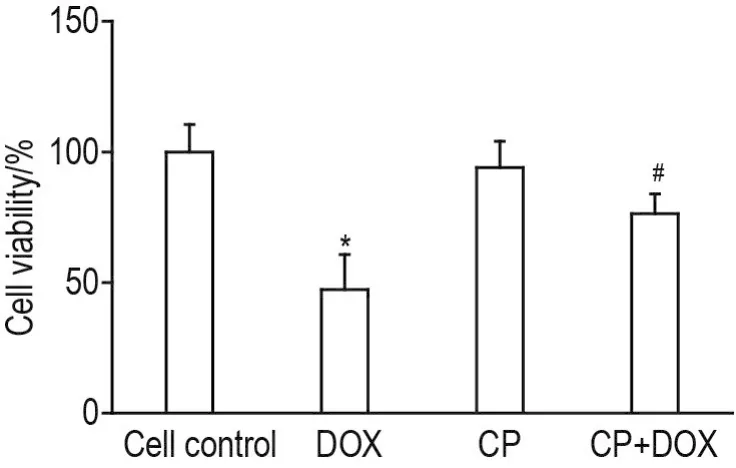
Fig.4 Effect of CP on H9C2 cell viability incluced by DOX.See Fig.3 for the cell treatment.±s,n=5.*P<0.05,compared with cell control group;#P<0.05,compared with DOX group.
2.5 磷酸肌酸钠对多柔比星诱导大鼠心肌组织和H9C2细胞SOD2、SERCA2a和活化的胱天蛋白酶3蛋白表达水平的影响
Western印迹法检测结果(图5A和B)显示,与正常对照组比,DOX组SOD2和SERCA2a蛋白表达水平分别下降了约30%和20%(P<0.05),而活化胱天蛋白酶3蛋白上升了约50%;与DOX组比较,CP+DOX组SOD2和SERCA2a蛋白表达上调(P<0.05),显著降低了活化的胱天蛋白酶3蛋白表达水平。
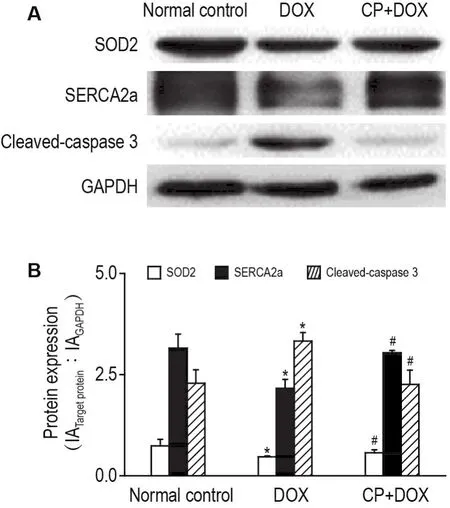
Fig.5 Effect of CP on protein expressions of superoxide dismutase 2(SOD2),sarco/endoplasmic reticulum-Ca2+ATPase(SERCA2a)and cleaved-caspase 3 in rats with myocardial injury induced by DOX by Western blotting.See Fig.1 for the rat treatment.B:semi-quantitaive results of A.±s,n=5.*P<0.05,compared with normal control group;#P<0.05,compared with DOX group.
Western印迹结果(图6A和B)显示,DOX刺激H9C2细胞3 h,SERCA2a蛋白表达上升,随后开始下降,直至24 h,其表达水平远低于0 h;而活化的胱天蛋白酶3蛋白表达水平呈时间依赖性上升(r=0.8124,P<0.05)。当CP 1 mmol·L-1预处理H9C2细胞1 h后,再加生理盐水或DOX 1 μmol·L-1继续处理24 h,结果如图(图6C和D所示),与细胞对照组相比,CP组SOD2,SERCA2a和活化的胱天蛋白酶3蛋白表达均无明显变化;与DOX组比较,CP+DOX组SOD2和SERCA2a蛋白表达上调(P<0.05),而活化的胱天蛋白酶3蛋白表达下调(P<0.05)。
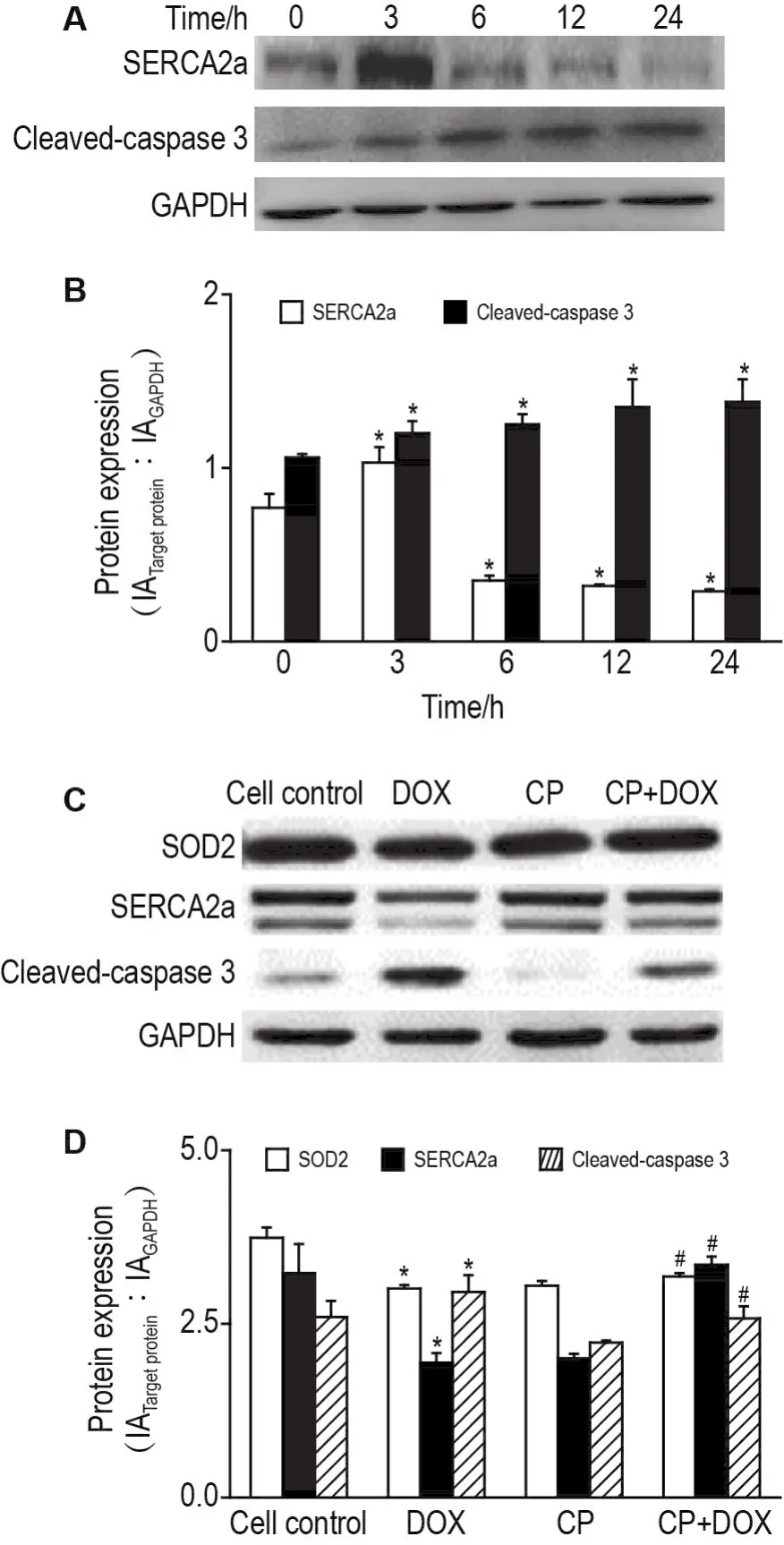
Fig.6 Effect of CP on protein expressions of SOD2,SERCA2a and cleaved-caspase 3 in H9C2 cells induced by DOX by Western blotting.See Fig.4 for the cell treatment.B:semi-quantitative result of A.±s,n=3.*P<0.05,compared with 0 h.D:semi-quantitative result of C.±s,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with DOX group.
3 讨论
本研究结果显示,CP在一定程度上改善DOX所致大鼠心肌组织肌原纤维紊乱,减少胶原蛋白的累积和心肌组织细胞凋亡;另一方面,DOX减弱心肌组织抗氧化活性蛋白SOD2和涉及Ca2+动态平衡调控的SERCA2a蛋白的表达,上调凋亡信号活化胱天蛋白酶3蛋白和miR-25-3p表达。CP的干预部分缓解DOX诱导SOD2和SERCA2a的表达下调,降低活化的胱天蛋白酶3蛋白和miR-25-3p的表达水平。以上结果表明,CP的干预改善DOX诱导的氧化应激和细胞凋亡,同时miR-25-3p/SERCA2a信号通路发生相应的变化。由此,CP缓解DOX诱导的大鼠心肌损伤,可能机制涉及CP对DOX诱导miR-25-3p/SERCA2a信号通路的抑制,改善心肌细胞内Ca2+动态平衡,减少心肌细胞凋亡。
DOX处理H9C2细胞3 h,miR-25-3p的表达水平无变化,从第6 h开始,miR-25-3p的表达水平呈时间依赖性上升;miR-25-3p靶基因SERCA2a的表达水平在DOX刺激3 h时急剧增加,随后随着时间的延长而逐渐下降,24 h的表达水平要远低于0 h,在最初3 h的急剧增加可能是细胞应激反应,起到自我保护的作用,随后SERCA2a受到miR-25-3p的干扰而表达水平逐渐下降;CP预处理1 h后再给予DOX刺激H9C2 24 h,结果同动物实验结果一致,CP改善DOX诱导SOD2和SERCA2a蛋白表达下调,抑制活化的胱天蛋白酶3蛋白和miR-25-3p表达增加;我们之前报道NAC的干预减轻DOX诱导的氧化应激[17]。本研究CCK8实验结果表明,NAC和CP都能显著改善DOX的心肌细胞毒性作用。以上结果说明,CP具有较好的抗氧化活性的同时,可能通过抗氧化作用来抑制DOX诱导miR-25-3p/SERCA2a信号通路的活性,改善心肌细胞内Ca2+动态平衡,减轻DOX的心肌毒性。
DOX所致心肌损伤的机制主要涉及β肾上腺素受体途径、细胞内Ca2+途径和氧化应激介导的细胞凋亡,SERCA2a的表达上调能够减轻DOX心肌毒性[18-19]。CP在临床上应用于心脏手术或癌症患者化疗前的心脏保护作用,但其作用机制并不明确。本研究体内外实验结果表明,CP具有较好的抗氧化活性,并显著改善DOX心脏毒性。深入研究发现,CP抑制DOX诱导miR-25-3p表达上调,SERCA2a的表达下调。综上所述,CP有可能通过调控miR-25-3p/SERCA2a信号通路改善细胞内Ca2+动态平衡,减轻DOX诱导的心脏毒性,揭示了CP改善DOX心脏毒性的可能调控机制,为临床预防和改善DOX的心脏毒性提供一定的理论基础和研究思路。

