免疫雏鹅发生小鹅瘟的原因分析
(中国农业大学动物医学院农业部动物流行病学重点实验室,北京海淀 100193)
小鹅瘟是危害养鹅业的重要传染病,以精神萎顿、食欲废绝和严重下痢为主要临床症状,以肠道出现栓子状物为特征病变[1]。3 周龄以内雏鹅对本病高度易感,如果未进行免疫,1 周龄以内雏鹅死亡率可达90%以上[2]。该病病原是鹅细小病毒(Goose parvovirus,GPV),目前归属为细小病毒科细小病毒亚科依赖细小病毒属(http://www.ictvonline.org/virusTaxonomy.asp)。GPV 为无囊膜的病毒,其基因组为单股DNA,含2 个开放阅读框(Open reading frame,ORF),左侧ORF 编码病毒的非结构蛋白(NS),右侧ORF 编码结构蛋白(VP1、VP2 和VP3)[3]。免疫接种是控制小鹅瘟的有效措施[1-2],通常用弱毒疫苗免疫种鹅,通过母源抗体对后代提供保护,但母源抗体的保护往往不够,还需在后代雏鹅出壳后用小鹅瘟抗体制品进行被动免疫。在有些鹅场,则仅依靠小鹅瘟抗体制品对本病进行控制。
2018 年6 月22 日,安徽某鹅场9 日龄和12 日龄的鹅群发生小鹅瘟,这两批雏鹅在出壳时均接种过小鹅瘟抗体。发病时,用2 种不同来源的小鹅瘟抗体产品进行控制,效果存在明显差异。本试验旨在对其病原进行分子鉴定和抗原性分析,并对抗体产品的效价进行检测,以便为小鹅瘟的防控提供科学依据。
1 材料与方法
1.1 病例 8 只病死鹅用于本试验,包括9 日龄鹅5 只、12 日龄鹅3 只,由安徽某鹅场于2018 年6 月26 日送检。
1.2 毒株和抗体 GPV H 株和JS1 株由本实验室保存,2 种不同来源的小鹅瘟病毒精制蛋黄抗体(编号为A 和B)由养殖户提供,用于抗原相关性分析和抗体效价测定。
1.3 样品采集与处理 采集病死鹅肝脏和肾脏样品,按1∶5(w/v)比例加入生理盐水,研磨制成匀浆,在4 ℃条件下用12 000 g 离心15 min,收获上清液,用于DNA 提取,其中2 份(AC1 和AC2)作为待检抗原,用于琼脂扩散沉淀试验(Agar gel precipitin,AGP)。
1.4 PCR 检测 用组织/细胞基因组DNA 快速提取试剂盒(北京艾德莱生物科技有限公司)提取DNA。取DNA 5 μL,加入2 ×TaqMaster Mix 12.5 μL、上游和下游引物(表1)各1 μL、ddH2O 5.5 μL。在95 ℃预变性10 min,按95 ℃30 s、50 ℃30 s、72 ℃30 s 的程序运行35 个循环,在72 ℃延伸10 min。用1.2%琼脂糖凝胶电泳观察PCR 产物。用文献[4-5]报道的引物(表1)分别扩增539 bpVP3 和645 bpVP1 序列。

表1 PCR 检测所用引物
1.5 克隆、测序和序列分析 按文献[5]报道的方式回收PCR 产物、克隆至pCloneEZ 质粒、转化DH10b 感受态细胞,取阳性菌液,委托天一辉远(北京)生物科技有限公司测序。按文献[5 -6]报道的处理方式,从VP1 序列中截取443 bp 序列,从Gen-Bank 下载12 株GPV 分离株的VP1 序列作为参考序列,用CLUSTALW(http://www.genome.jp/tools/clustalw/)进行在线比对,用MEGA6.0 软件[7]进行演化分析。
1.6 琼脂扩散试验(AGP) 称取1 g 琼脂糖、8 g NaCl,溶于100 mL 蒸馏水,加热溶解,稍冷却后倒入培养皿。待琼脂糖凝固后,用梅花打孔器打孔,在中央孔加入GPV 抗原,用生理盐水将小鹅瘟A 抗体和B 抗体分别进行2 倍系列稀释,并依次加入到外围孔,以出现沉淀线的抗体最高稀释倍数为该抗体的效价。在中央孔加入GPV B 抗体(1 ∶4稀释),在外围孔加入GPV H 株、JS1 株和待检抗原,以此分析待检毒株与参考毒株之间的抗原相关性。
2 结果
2.1 病理剖检 病死鹅有小鹅瘟典型病变,即在小肠见有一处肠段外观膨胀,剖开见有栓子样物,中插彩版图1 为1 只12 日龄病死鹅的肠道病变。

图1 12 日龄病死鹅的肠道病变
2.2 PCR 检测 用引物对VP3 F/VP3 R 进行PCR检测,从16 份组织样品中均扩增出预期长度的条带(图2)。

图2 临床样品中GPV 的PCR 检测
2.3 序列同源性分析和遗传演化分析 测定了8株GPV 的部分VP1 序列。CLUSTALW 分析结果显示,在443 ntVP1 区,所测毒株之间的序列同源性为100%,与亚洲强毒分支的序列同源性可达99%,与匈利亚强毒分支、疫苗和低毒力分支的序列同源性均为96%,与GPV 西欧分支毒株的序列同源性为94%。用443 ntVP1 序列进行遗传演化分析,如图3所示,所测8 株GPV 聚为GPV 亚洲强毒株分支。
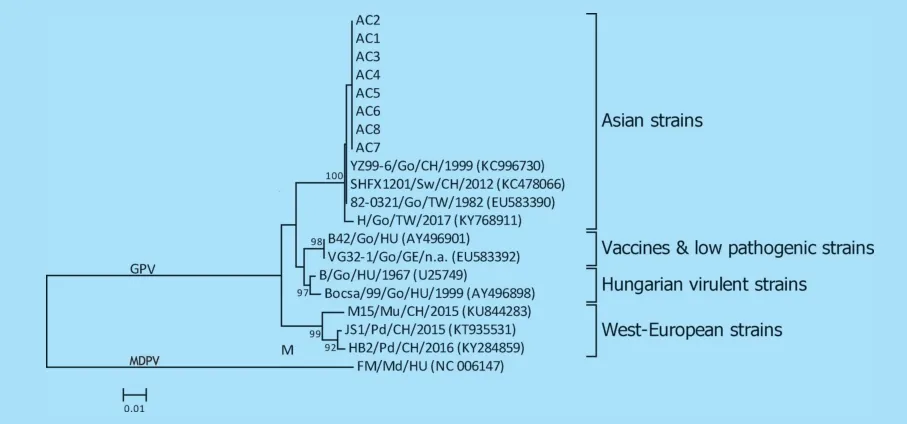
图3 GPV 遗传演化分析
2.4 AGP 用GPV JS1 株作为抗原进行检测,B抗体与抗原之间形成清晰可见的沉淀线,效价为1∶16。而A 抗体与抗原之间仅见微弱的沉淀反应,抗体效价为1 ∶2左右。将B 产品作为抗体进行检测,待检样品AC1 和AC2 与GPV H 株和JS1 株抗原之间形成的沉淀线彼此融合(图4)。

图4 GPV 的抗原性分析
3 讨论
送检病例具有小鹅瘟的特征性肠道病变,据此可初步诊断为小鹅瘟。用水禽细小病毒的特异性PCR[4]进行检测,从8 只病例的肝脏和脾脏样品中均检出GPVVP3 序列,因发病雏鹅及其种鹅均未免疫小鹅瘟弱毒疫苗,因此,可认为所检出的GPV 均属强毒株。按文献[5]报道的方式对VP1 部分序列进行遗传演化分析,可将所测毒株归属于GPV 亚洲强毒分支。结合沉淀反应模式,结果表明,用小鹅瘟抗体制品进行免疫仍未能彻底控制疾病发生,并非源自病毒变异。
琼脂扩散试验可用于GPV 抗体的评估[8]。用该法进行检测的结果表明,A 抗体产品比B 抗体产品的效价低3 个滴度,此结果可解释这2 种抗体制品在控制小鹅瘟时的效果差异。据养殖户介绍,用A 抗体进行紧急接种,鹅群日死亡率仍在5%左右;用B 抗体免疫后,鹅群日死亡率明显降低,但需增加免疫剂量。由此可见,确保抗体制品的效价对于小鹅瘟的控制至关重要。由于GPV 可经卵垂直传播,或经孵化器污染而传播[1-2],加强种鹅场和孵化环节的卫生管理与消毒,特别是做好种鹅的疫苗免疫,对于后代雏鹅小鹅瘟的控制是有益的。

