SDBS改性桑杆吸附剂对Cd2+的吸附机制试验研究
韦岩松,李秀玲,梁小满,陈冬梅
(河池学院 化学与生物工程学院,广西 河池 546300)
重金属污染治理是环境污染防治的一个重要方面,开发和探寻新型重金属分离方法一直是业界的研究热点。
近年来,以农林废弃物为原料制备对环境友好的生物吸附剂[1-5]受到高度关注。桑杆是农林废弃物的一种,经过改性可用于吸附处理含重金属离子的废水。在前期桑杆吸附剂改性研究[6]中,对比了氢氧化钠、十二烷基苯磺酸钠(SDBS)、磷酸的改性效果,也考察了各因素对改性后的吸附剂对Cd2+的吸附效果的影响。其中,用SDBS改性效果较好,适宜条件下,SDBS改性吸附剂对Cd2+的吸附率可达96%以上。
试验以SDBS改性制备桑杆吸附剂,研究了改性后吸附剂的表面结构和吸附性能,以及官能团结构的变化。初步考察了SDBS改性吸附剂吸附Cd2+的动力学及吸附等温线,以期为桑杆等农林废弃物的资源化利用探索新途径,也为含重金属废水的处理提供参考方法。
1 试验部分
1.1 试验材料及仪器
试验原料:以SDBS改性的桑杆吸附剂[6]。
试验仪器:AA-7020型原子吸收分光光度计(北京东西分析仪器有限公司),NICOLET6700型傅里叶红外变换光谱仪(美国赛默飞世尔有限公司),ZWY-1102C型恒温培养振荡器(上海智诚分析仪器制造有限公司),pHS-3C型pH计(上海仪电科学仪器股份有限公司)等。
1.2 试验方法
1.2.1 改性和吸附Cd2+前后桑杆吸附剂的表征
采用溴化钾压片,对改性前后、吸附Cd2+前后的桑杆吸附剂表面官能团进行红外光谱分析,比较官能团结构的变化情况[7]。
1.2.2 改性桑杆吸附剂吸附Cd2+
称取一定量改性桑杆吸附剂6份,分别置于50 mL塑料瓶中,加入20 mL一定初始浓度和pH的含Cd2+溶液,在一定温度下于摇床中摇荡一定时间,改变吸附时间、吸附温度、Cd2+初始质量浓度、溶液pH和吸附剂用量进行单因素试验,用原子吸收分光光度计测定Cd2+质量浓度,计算Cd2+吸附容量(qt)和吸附率(η)。
(1)
(2)
式中:ρ0为Cd2+初始质量浓度,mg/L;ρt为吸附t时间时溶液中Cd2+质量浓度,mg/L;V为溶液体积,L;m为改性桑杆吸附剂质量,g;qt为吸附t时间时改性桑杆吸附剂对Cd2+的吸附容量,mg/g。
1.2.3 改性桑杆吸附剂吸附Cd2+的动力学
称取0.10 g改性桑杆吸附剂于50 mL塑料瓶中,瓶中装有Cd2+初始质量浓度为15 mg/L的溶液20 mL,控制温度为30 ℃,每隔一定时间取1次液体样品,用原子吸收分光光计测定Cd2+质量浓度,计算吸附量(qt),以qt对t作图,得出吸附平衡时间与平衡吸附量之间的关系。用准一级和准二级动力学方程对吸附动力学数据进行拟合[8-11]。
(3)
(4)
式中:t为反应时间,min;qt和qe分别为吸附t时间和吸附平衡时改性桑杆吸附剂对Cd2+的吸附量,mg/g;k1、k2分别为准一、二级反应速率常数。
1.2.4 改性桑杆吸附剂吸附Cd2+的等温线
称取0.10 g改性桑杆吸附剂于50 mL塑料瓶中,分别对不同初始质量浓度的含镉溶液20 mL进行吸附,吸附温度30 ℃,吸附至平衡,取样测定吸附尾液中Cd2+质量浓度,计算平衡吸附量,用Langmuir和Freundlich方程拟合吸附等温线[12-14]。
(5)
(6)
式中:ρe为吸附平衡时溶液中Cd2+质量浓度,mg/L;qe为吸附平衡时改性桑杆吸附剂对Cd2+的吸附容量,mg/g;qm为改性桑杆吸附剂对Cd2+的饱和吸附量,mg/g;b、kF为常数;1/n为吸附剂的吸附强度或表面不均匀性,0<1/n<0.5对吸附有利,若1/n>1对吸附不利。
2 试验结果与讨论
2.1 改性及吸附前、后桑杆吸附剂的红外光谱
改性前、后桑杆吸附剂的红外光谱如图1所示,吸附Cd2+前、后改性桑杆吸附剂的红外光谱如图2所示。

图1 改性前、后桑杆吸附剂的红外光谱

图2 吸附Cd2+前、后改性桑杆吸附剂的红外光谱

由图2看出:改性桑杆吸附剂吸附Cd2+前后,红外光谱曲线总体结构变化不大,但在3 408、1 425、1 062 cm-1附近的吸收峰变强变宽,说明桑杆吸附剂表面的羟基和C—O官能团是吸附反应的结合点位[17],对Cd2+的吸附作用确实在这些点位上发生。
2.2 改性桑杆吸附剂对Cd2+的吸附性能
2.2.1 吸附时间对吸附量的影响
在改性桑杆吸附剂用量为5 g/L、Cd2+初始质量浓度为15 mg/L、溶液pH为6、吸附温度为30 ℃条件下,吸附时间对吸附剂吸附量的影响试验结果见表1。

表1 吸附时间对吸附量的影响
由表1看出:反应前3 h,改性桑杆吸附剂对Cd2+的吸附量呈规律性增大;吸附3 h后,吸附容量变化不明显。说明3 h时吸附达到饱和,饱和吸附容量为2.91 mg/g。
2.2.2 吸附温度对吸附量的影响
在改性桑杆吸附剂用量为5 g/L、Cd2+初始质量浓度为15 mg/L、溶液pH为6、吸附时间为3 h条件下,吸附温度对吸附剂吸附量的影响试验结果见表2。

表2 吸附温度对吸附量的影响
由表2看出:温度在30~40 ℃范围内,改性桑杆吸附剂对Cd2+的吸附量随温度升高逐渐提高;继续升高温度,吸附量提高幅度变小,至50 ℃时达最大2.96 mg/g;之后再升高温度,吸附量反而稍有下降。这是因为温度升高可加速溶液中离子的运动,有利于吸附过程进行;但温度过高,离子运动速度过快,会使已被吸附的离子重新解吸出来,导致吸附量降低。
2.2.3 溶液中Cd2+初始质量浓度对吸附量的影响
在改性桑杆吸附剂用量为5 g/L、溶液pH为6、吸附时间为3 h、吸附温度为30 ℃的条件下,溶液中Cd2+初始质量浓度对吸附剂吸附量的影响试验结果见表3。

表3 溶液中Cd2+初始质量浓度对吸附量的影响
由表3看出:溶液中Cd2+初始质量浓度较低(5~25 mg/L)时,吸附剂的吸附量与Cd2+初始质量浓度呈正相关,吸附能力随Cd2+增多逐渐增大,吸附量提高;Cd2+初始质量浓度为25 mg/L时,吸附量达最大,为5.71 mg/g;继续增大Cd2+初始质量浓度,吸附量反而略有下降,这说明吸附过程已达饱和状态,Cd2+过量,相对吸附量降低。
2.2.4 溶液pH对吸附量的影响
在改性桑杆粉吸附剂用量为5 g/L、Cd2+初始质量浓度为15 mg/L、吸附时间为3 h、吸附温度为30 ℃条件下,溶液pH对吸附剂吸附量的影响试验结果见表4。

表4 溶液pH对吸附量的影响
由表4看出:pH<3时,桑杆吸附剂对Cd2+的吸附量较小;随pH增大,吸附能力逐渐增强,pH在5~7时,吸附量维持在较高水平,达2.725 4~2.834 9 mg/g。这是因为,pH较低时,H+较多,溶液中的正电荷会与Cd2+竞争吸附位点,故吸附率较低;随pH增大,H+相对减少,这种抢夺吸附位点的效应减弱,同时酸性减小能促进羟基、酰胺基螯合能力的提高和羧基的电离,导致双电层被压缩减小[18],有利于对Cd2+的吸附,故吸附量提高。
2.2.5 吸附剂用量对吸附效果的影响
在Cd2+初始质量浓度为15 mg/L、溶液pH为6、吸附时间为3 h、吸附温度为30 ℃条件下,吸附剂用量对Cd2+吸附率的影响试验结果见表5。

表5 吸附剂用量对Cd2+吸附率的影响
由表5看出:吸附剂用量从2.5 g/L增加至7.5 g/L,Cd2+吸附率从93.32%提升至96.88%,提升幅度较大;之后,再增大吸附剂用量,Cd2+吸附率变化不明显,表明吸附已达平衡。
2.3 吸附动力学
根据1.2.3给出的吸附动力学研究方法,选择在30 ℃条件下考察改性桑杆吸附剂对Cd2+的吸附动力学,并绘制准一级和准二级动力学曲线,分别如图3、4所示,动力学拟合参数见表6。
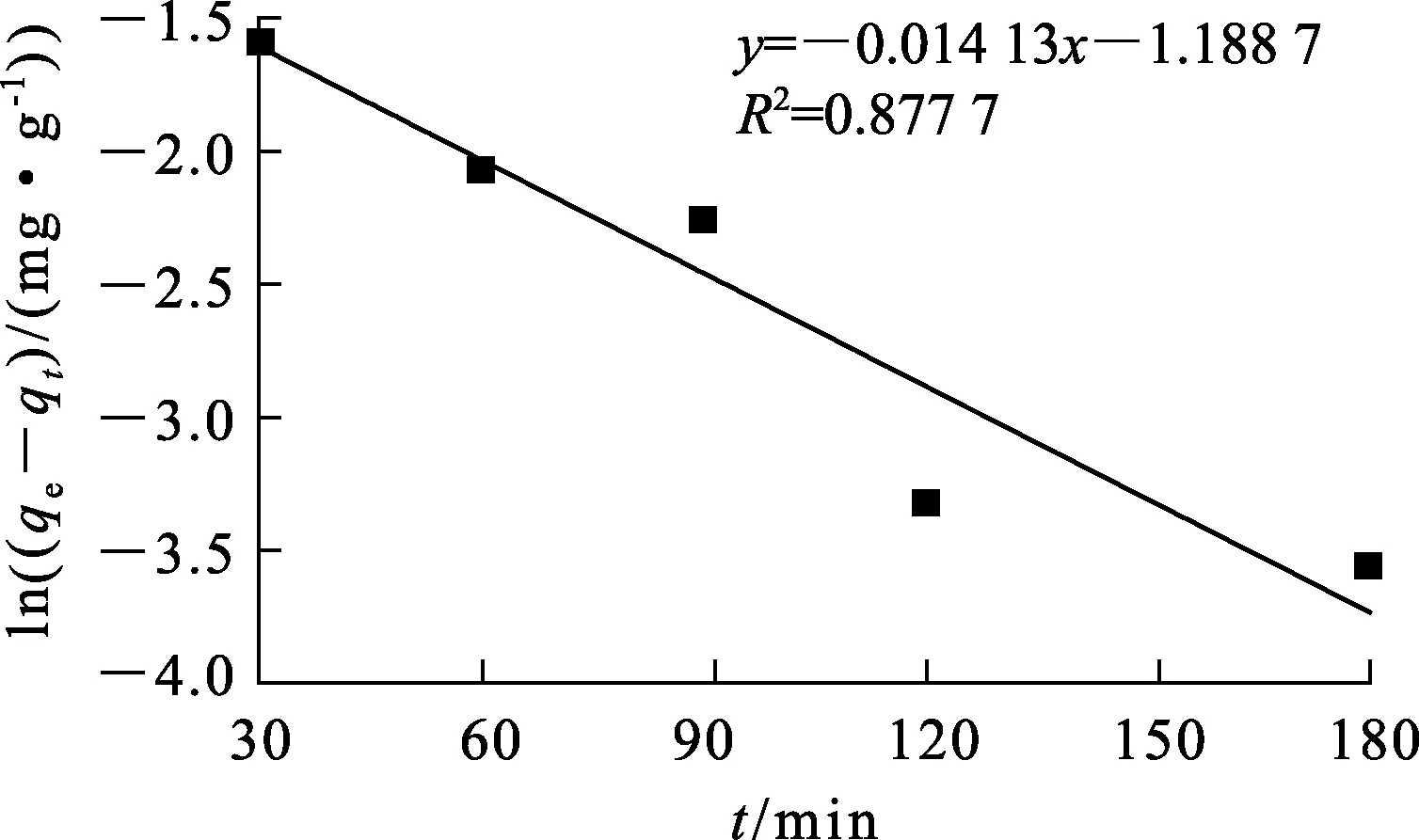
图3 改性桑杆吸附剂吸附Cd2+的准一级动力学曲线

图4 改性桑杆吸附剂吸附Cd2+的准二级动力学曲线

ρ0/(mg·L-1)k1qe/(mg·g-1)R2k2qe/(mg·g-1)R2150.0140.385 50.877 70.012 72.930.999 8
由表6看出:在30 ℃条件下,准一级和准二级动力学拟合曲线的线性相关系数R2分别为0.877 7和0.999 8,准二级动力学方程的相关性更好;准一级动力学方程拟合得到qe=0.385 5 mg/g,准二级动力学方程拟合得到qe=2.93 mg/g,而试验测定qe=2.91 mg/g,后者与试验值相近,表明吸附过程更符合准二级动力学方程。
2.4 吸附等温线
根据1.2.4的吸附等温线试验方法,选择30 ℃条件下的数据,采用Langmuir等温吸附模型和Freundlich等温吸附模型进行拟合,相关参数见表7,拟合曲线分别如图5、6所示。

表7 Langmuir和Freunndlich等温模型拟合参数

图5 改性桑杆吸附剂对Cd2+的Langmuir吸附等温线

图6 改性桑杆吸附剂对Cd2+的Freunndlich吸附等温线
由表7看出:在30 ℃条件下,Langmuir等温吸附方程的线性相关系数R2=0.958 7,qe=16.01 mg/g,与试验所得qe=5.71 mg/g相差很大;而Freunndlich等温吸附方程的线性相关系数R2=0.997 5,1/n=0.115 1,介于0~0.5之间。说明改性桑杆吸附剂对水中Cd2+的吸附更符合Freunndlich等温吸附方程,吸附易于进行,吸附过程为多分子层吸附。
3 结论
用SDBS改性桑杆吸附剂,SDBS结合在桑杆粉颗粒表面,改性有效,更有利于吸附水中的Cd2+,羟基和C—O官能团为吸附反应结合点。
改性桑杆吸附剂对溶液中的Cd2+有较大吸附容量,在吸附时间3 h、温度50 ℃、Cd2+初始质量浓度25 mg/L、溶液pH=7、吸附剂用量7.5 g/L条件下,吸附率达96.8%以上。
改性桑杆吸附剂对Cd2+的吸附过程可用准二级动力学吸附模型描述,符合Freunndlich等温吸附方程,吸附易于进行。

