用乙酸从废锂电池电极材料中浸出有价金属试验研究
屈莉莉,何亚群,付元鹏,李金龙,谢卫宁
(1.中国矿业大学 化工学院,江苏 徐州 221116;2.中国矿业大学 现代分析与计算中心,江苏 徐州 221116)
废锂离子电池中含有重金属和有害电解质,如Co和LiPF6等,对环境有潜在危害,需要回收处理[1-3]。典型的锂离子电池由正极、负极、有机电解质、隔膜和金属外壳构成,由涂覆有金属氧化层(如钴酸锂)的铝箔制成的正极材料中富集有大量有价金属[4],具有回收价值。目前,从废弃锂离子电池中回收有价金属主要有火法[5]、机械化学法[6]和湿法[7-14]。火法是通过高温热处理除去物料中的有机组分,同时熔融重塑金属氧化物,不仅资金成本高,而且排放有害气体(HF),煅烧后的铝箔被氧化成氧化铝,后续收集回收更加困难。机械化学法能耗低,效率高,但回收效果相对较差。湿法技术选择性好、金属回收率高,对环境污染小,能耗低。其中从电池正极材料中回收有价金属最常用的方法是酸浸法,所用的酸除无机酸,如盐酸、硝酸和硫酸外,一些有机酸,如枸橼酸、草酸及酒石酸、琥珀酸等也被使用。酸浸过程中,如果可以不改变铝箔形状而使其与黏在其表面的活性物质钴酸锂粉末分离,不仅可以达到分离钴锂和铝的目的,还可使铝箔保持单质形式回收。电池正极材料组成相对简单,仅由钴酸锂、乙炔黑、黏结剂和铝箔组成,而钴酸锂、乙炔黑是靠黏结剂的作用与铝箔紧密结合,因此,只要破坏黏结剂的黏结作用,就可以实现活性物质粉末与铝箔的分离[15]。
试验针对废锂离子电池正极材料,研究采用乙酸浸出钴酸锂,高效分离铝箔,从而简化传统处理工艺流程。铝箔经清洗后直接回收。
1 试验部分
1.1 试验材料与试剂
试验材料为废三星锂电池。将废锂电池置于质量浓度5 g/L的氯化钠溶液中放电48 h,并在干燥箱中自然风干24 h。手工剥离外壳,分离出正极、负极和隔膜。将正极材料中的活性物质从铝箔上刮下,研磨后进行XRD分析,结果如图1所示。正极材料中的活性物质结晶相为钴酸锂[4]。用王水溶解正极材料,以激光剥蚀-等离子质谱仪(LA-ICP-MS)测定金属质量分数,结果见表1。

图1 浸出前正极活性材料的XRD图谱

表1 废锂离子电池正极材料金属组成 %
试验所用试剂:乙酸、过氧化氢(上海沃凯生物技术有限公司),硝酸(西陇化工股份有限公司),盐酸(西陇科学股份有限公司),均为分析纯。
1.2 试验方法与仪器
试验在有回流冷凝装置的250 mL三颈圆底烧瓶中进行。将正极材料剪切成0.5 cm×0.5 cm碎块,取一定质量加入到200 mL乙酸和双氧水混合液中,恒温水浴加热并搅拌,反应一定时间后,对浸出液进行过滤,收集滤液及浸出渣。
用激光剥蚀-等离子质谱仪(LA-ICP-MS,7900,Agilent,美国)测定浸出液中钴、锂、铝质量浓度,用X射线衍射仪(XRD,D8 Advance,Bruker,德国)分析浸出前正极材料物相,用傅立叶变换红外光谱仪(FTIR,Vertex 80v,Bruker,德国)测定浸出前正极材料和浸出残渣的组成,用扫描电子显微镜(SEM,Quanta250,FEI,美国)观察浸出前后物料的形貌。
2 试验结果与讨论
2.1 浸出剂乙酸浓度对金属浸出率的影响
在60 ℃、固液质量体积比20 g/L、双氧水体积分数4%、反应时间60 min、搅拌速度400 r/min条件下,乙酸浓度对锂、钴、铝浸出率的影响试验结果如图2所示。

图2 乙酸浓度对金属浸出率的影响
由图2看出:乙酸浓度为3.5 mol/L时,锂、钴浸出率均达最大,分别为82.93%、97.10%;随乙酸浓度增大,锂、钴浸出率均先提高后降低。这可能是随乙酸浓度增大,溶液中H+增多,增加了溶液中反应物的碰撞概率,使化学反应速率加快;但乙酸浓度再增大,溶液黏度增大,反而会抑制反应进行,不利于锂、钴的浸出。乙酸浓度的增大几乎不改变铝浸出率,这可能是铝的金属活性较弱、在乙酸溶液中相对稳定的缘故。
乙酸浓度较低时,分离出的铝箔表面残留有很多黑色附着物,这是正极材料中的活性物质和黏结剂,分离效果不很理想;但乙酸浓度过高,浸出后的铝片上有许多小孔,铝有一部分被溶解。高强度的搅拌和摩擦也会使铝箔卷曲,高浓度乙酸也会溶解少量铝箔。综合考虑,确定适宜的乙酸浓度为3.5 mol/L。
2.2 固液质量体积比对金属浸出率的影响
在乙酸浓度3.5 mol/L、反应时间60 min、反应温度60 ℃、双氧水体积分数4%、搅拌速度400 r/min条件下,液固体积质量比对金属浸出率的影响试验结果如图3所示。
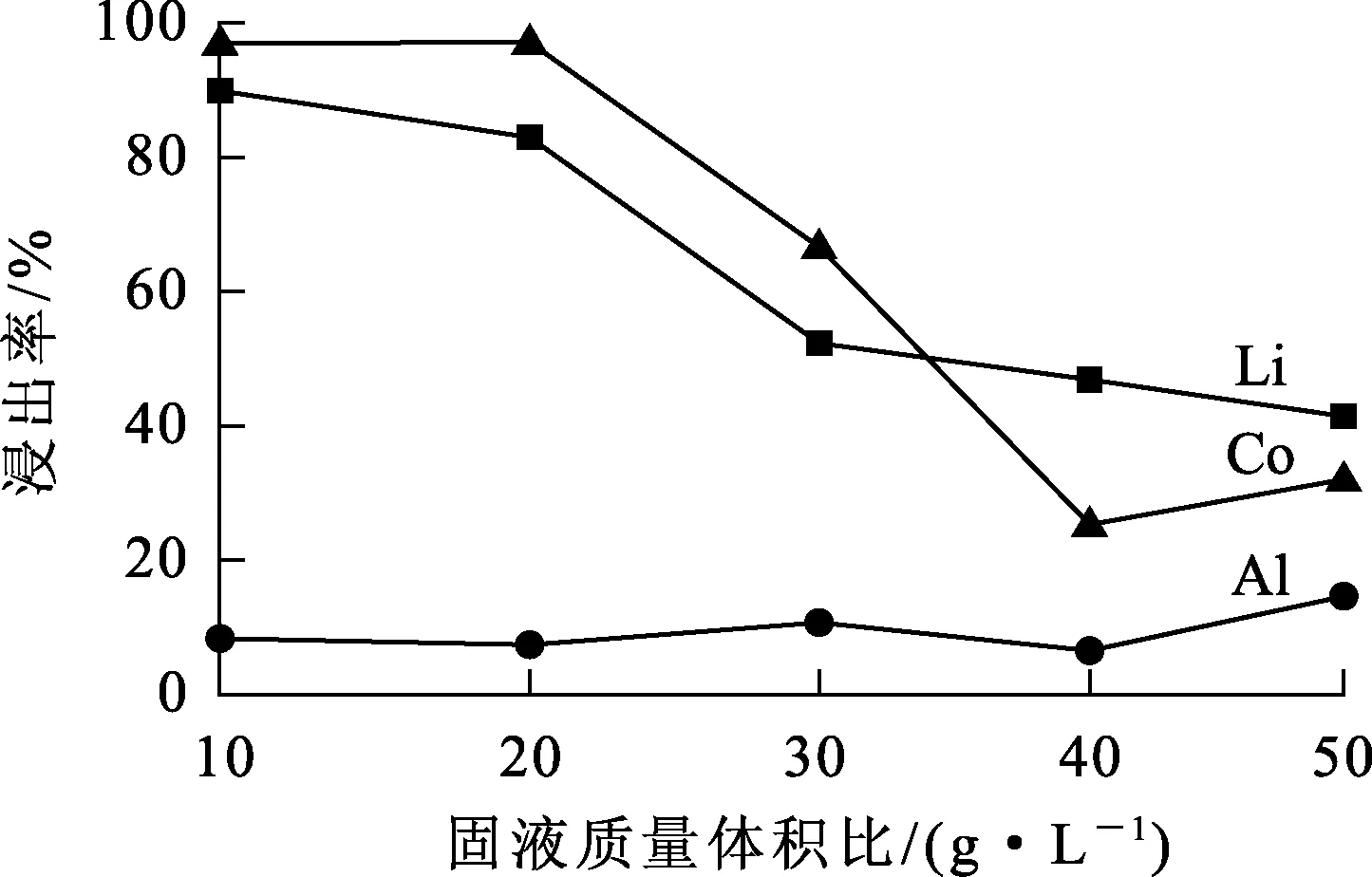
图3 固液质量体积比对金属浸出率的影响
由图3看出:随固液质量体积比从10 g/L提高到40 g/L,锂、钴浸出率明显降低,表明固液质量体积比增大不利于锂、钴的浸出;而铝的浸出几乎不受固液质量体积比的影响。综合考虑,确定适宜的固液质量体积比以20 g/L为宜。
2.3 双氧水用量对金属浸出率的影响
在乙酸浓度3.5 mol/L、反应时间60 min、反应温度60 ℃、搅拌速度400 r/min、液固体积质量比20 g/L条件下,双氧水用量对金属浸出率的影响试验结果如图4所示。

图4 双氧水用量对金属浸出率的影响
由图4看出:不添加还原剂双氧水时,钴、锂浸出率分别为8.24%、12.22%,铝浸出率为9.53%;随双氧水用量增加,钴、锂浸出率显著提高。反应过程中,过氧化氢起还原剂作用,特别是在乙酸浸出过程中,削弱了钴酸锂中的Co—O键,使其分解;另外,在酸性溶液中,钴酸锂的层状结构被破坏,产生的Co3+易从双氧水负一价氧中获得电子还原为Co2+,Co2+迅速溶解在酸中,从而提高Co2+浸出率。当继续增大双氧水用量时,钴、锂金属离子浸出率趋于稳定,而铝浸出率在双氧水质量分数为4%时最低。综合考虑,确定双氧水质量分数以4%为宜。
2.4 反应温度对金属浸出率的影响
在乙酸浓度3.5 mol/L、固液质量体积比20 g/L、双氧水体积分数4%、搅拌速度400 r/min条件下,反应温度对钴、锂浸出率的影响试验结果如图5所示。可以看出:随温度升高,钴、锂浸出率明显提高;温度为60 ℃时,钴、锂浸出率最高;继续升高温度,钴、锂浸出率反而下降。此现象说明:乙酸和钴酸锂之间的反应是吸热反应,升高温度,有利于反应进行;但温度过高,钴、锂离子水解反应加剧,并且双氧水变得不稳定,加速分解,从而使金属离子浸出率下降。因此,反应温度以60 ℃较为适宜。

图5 反应温度对金属浸出率的影响
2.5 反应时间对金属浸出率的影响
在乙酸浓度3.5 mol/L、双氧水质量分数4%、反应温度60 ℃、固液质量体积比20 g/L、搅拌速度400 r/min条件下,反应时间对金属浸出率的影响试验结果如图6所示。

图6 反应时间对金属浸出率的影响
由图6看出:随反应进行,锂、钴浸出率提高;浸出40 min时,二者浸出率均达最高,分别为84.7%、97%;继续延长反应时间,金属浸出率略有下降趋势,表明金属离子有水解反应发生;而铝浸出率随反应时间延长而提高。理论上看,在足够长反应时间内,体系中的乙酸能将正极材料中的锂、钴完全浸出;但铝浸出率也会越来越高。试验中发现,反应时间越长,浸出后铝箔表面的小孔越多。综合考虑,确定反应时间以不超过40 min为宜。
2.6 乙酸浸出钴、锂机制
如式(1)所示,乙酸分子在水中电离释放出H+,而H+浓度对钴、锂浸出起关键作用。在有双氧水存在条件下,乙酸与钴酸锂发生反应,使钴、锂被溶出,见式(3);同时,铝箔也会与乙酸发生反应,生成乙酸铝和氢气,见式(4)。
(1)
(2)

(3)

(4)
电池正极材料和乙酸浸出体系下的浸出渣的SEM照片(放大8 000倍)如图7所示。可以看出,钴酸锂在浸出前、后有显著变化:浸出前,钴酸锂粉末颗粒是具有相对规则结构的层状晶体,表面光滑,并且黏结在一起;浸出后,浸出渣颗粒表面被腐蚀成不规则结构,说明大部分活性物质钴酸锂被浸出,剩余的残余物为黏结剂和乙炔黑。综上所述,乙酸可与钴酸锂发生反应,不与铝箔和黏结剂发生反应。与传统工艺相比:该工艺大大降低了工艺的复杂程度,铝箔经清洗后可完整回收;同时,乙酸成本低,二次污染小。

a—浸出前;b—浸出后。
正极材料钴酸锂和黏结剂聚偏氟乙烯(PVDF)混合黏附在铝箔上。PVDF表面能极低,具有极强的疏水性,分子结构如图8所示。浸出过程中,乙酸首先与PVDF发生反应,破坏PVDF表面的C—F键,使其脱去表面的部分氟原子,在PVDF表面形成一些极性基团[16]。
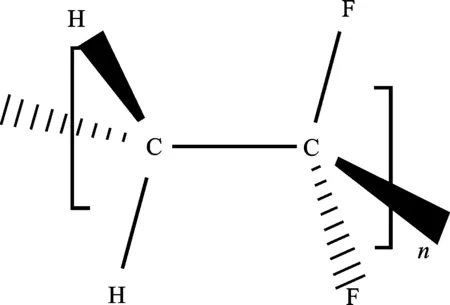
图8 PVDF分子结构
废弃钴酸锂浸出前、后的红外光谱分析结果如图9所示。可以看出,曲线a中1 392 cm-1与1 190 cm-1是PVDF中C—F键的特征吸收峰,PVDF在乙酸浸出液中反应后,引入了新的官能团羧基,羧基中的—OH会导致分子间的氢键作用增强,使C—F键振动峰偏移到低波数1 179 cm-1(曲线b);反应后的PVDF表面引入羧基等极性基团,表面能增大,接触角变小,润湿性提高,使PVDF表面的黏结性能得以改善,进而使钴酸锂正极材料从铝箔上脱落下来,铝箔得到完整回收。

a—浸出前;b—浸出后。
3 结论
1)用双氧水作还原剂、乙酸作浸出剂,可以有效浸出废锂离子电池正极材料中的钴、锂,浸出后铝箔变化不大,可返回利用。适宜条件下,锂、钴浸出率分别为84.7%、97%,而铝浸出率仅为6.8%。
2)红外光谱分析结果表明,PVDF在乙酸浸出液中破坏了黏结剂表面的C—F键,引入极性基团羧基,改善了PVDF表面的黏结性能。使钴酸锂正极材料从铝箔上脱落下来,铝箔完整回收。
3)以乙酸浸出钴酸锂,不产生有毒气体且易回收。浸出渣大部分为黏结剂和炭黑。扫描电镜分析结果表明,浸出前的钴酸锂粉末为相对规则的层状晶体且表面光滑,浸出后的颗粒表面被腐蚀形成疏松多孔的黑色物质。

