快速眼球运动睡眠行为障碍患者的神经心理学评价及其与客观睡眠的相关性
张 轩,王金莹,叶静怡,万亚会,崔林阳,朱晓冬,张美云,程 焱,薛 蓉
快速眼球运动睡眠行为障碍(rapid eye movement sleep behavior disorder,RBD)是以快速眼动(rapid eye movement,REM),睡眠期肌肉失迟缓并出现与梦境相关的复杂运动为特征的发作性疾病,可能导致自伤或床伴受伤。RBD分为特发性RBD(idiopathic RBD,iRBD)和继发性RBD,后者又分为药源性RBD、症状性RBD及与神经变性病相关性的RBD。iRBD指无明确病因的RBD,可发生在神经退行性疾病如帕金森病(Parkinson’s disease,PD)、路易体痴呆(dementia with Lewy bodies,DLB)、多系统萎缩(multiple system atrophy,MSA)之前[1]。人群中RBD的流行率为0.38%~2.01%,在神经退行性疾病中流行率更高,尤其是突触核蛋白病[2]。随着iRBD病程的增加,神经退行性疾病的发生率逐渐增高,2 y后为15%,3 y后为25%,4 y后为36%,5 y后为41%[3],另一项研究的数据为5 y后34.8%,10 y后为73.4%,14 y后为92.5%[4]。纵向研究数据支持大部分iRBD患者最终发展为突触核蛋白病尤其是PD、DLB、MSA[4,5]。
近年来研究发现RBD患者的认知功能受损领域涉及视空间、注意力、执行功能与记忆[6~10],与神经退行性疾病的认知受损领域相似,有研究提出轻度认知功能障碍可能是神经退行性变的标志[11,12]。睡眠对巩固记忆起重要作用,睡眠的时间和连续性可影响细胞的超微结构、基因表达及人体的新陈代谢、情绪及警觉性[13],但是RBD患者的客观睡眠参数与神经心理损害的相关性尚未明确,本研究比较RBD患者与对照组的神经心理学与客观睡眠参数的差异,进一步探讨RBD患者神经心理学表现与客观睡眠参数的相关性。
1 材料和方法
1.1 研究对象 收集自2014年10月~2016年5月于天津医科大学总医院神经内科门诊连续就诊的主诉有夜间睡眠行为异常患者,根据国际睡眠障碍疾病分类(International classification of sleep disorders,ICSD-3)中RBD的诊断标准[14]入选RBD患者;排除标准:(1)耳聋、色盲、文盲,不能配合完成测试;(2)抑郁症或精神分裂症等精神病病史;(3)严重的内科基础疾病;(4)脑血管病及其他神经系统疾病、脑外伤史、其他异态睡眠或阻塞性睡眠呼吸暂停等睡眠障碍病史;(5)服用已知的可影响REM睡眠的药物。共纳入符合条件的RBD患者22例,其中iRBD 9例,合并PD者12例,合并MSA者1例;纳入性别、年龄、受教育程度相匹配并经v-PSG 检查排除RBD的健康对照组23例。本研究所有参与者均签署知情同意书,该研究经天津医科大学总医院伦理委员会批准,受试者的主要人口学信息以及RBD患者的病程信息见表1。
1.2 多导睡眠监测 所有研究对象按照平常的作息习惯在睡眠实验室接受整夜的视频多导睡眠监测[尼高利(v32)],由一名具有经验的睡眠技师根据国际标准[15]判读结果。具体睡眠参数包括睡眠潜伏期、REM睡眠潜伏期、睡眠效率、总睡眠时间、N1、N2、N3及REM睡眠的比例、REM睡眠段数、睡眠呼吸暂停低通气指数(AHI)、周期性腿动指数(PLMI)、平均与最低血氧饱和度。
1.3 神经心理学评估 在受试者PSG结束当天上午进行神经心理学评估,包括:(1)总体认知功能:简易精神状态检查(Mini mental state exam,MMSE)[16];(2)言语记忆测试:听觉词语学习测试(Auditory verbal learning test,AVLT)[17],记录第1~3次的即刻回忆总分、短延时回忆、长延时回忆及再认的词语数;(3)视空间功能:Rey复杂图形测试(Rey Complex Figure Test,RCFT)[18]及画钟测试(Clock Drawing Test,CDT)[19]评价视空间技能,RCFT延迟回忆[19]评价视空间记忆能力;(4)言语信息处理:数字符号转换测试(Symbol digit modalities test,SDMT)[20];(5)执行功能:连线测试A[21]、B[20](Trail Making Test,TMT),Stroop色词测试[20]A、B、C;(6)语言:言语流畅性测试(Verbal fluency test,VFT)[20]评价言语流畅性,包括动物流畅性测试、城市流畅性测试、动物-城市交替流畅性测试,波士顿命名测试(Boston naming test,BNT)[22]评价命名能力。
2 结 果
2.1 人口学资料和多导睡眠监测 两组年龄、性别、受教育程度差异不具有统计学意义,RBD平均病程为10.45 y(见表1)。与对照组相比,RBD组N1比例增加(分别为15.61±1.93和27.18±2.82,P<0.01),N2比例减少(分别为63.39±1.81和55.77±2.85,P<0.05),N3比例减少(分别为6.87±1.19和3.41±1.10,P<0.05),PLMI增高(分别为4.87±1.70和26.22±7.73,P<0.05),差异具有统计学意义。两组的总睡眠时间、睡眠效率、睡眠潜伏期、REM睡眠潜伏期、REM睡眠时间,REM睡眠段数、觉醒指数、平均及最低血氧饱和度、AHI差异不具有统计学意义(见表2)。

表1 RBD组和对照组人口学和临床资料

表2 RBD组与对照组的PSG睡眠参数
TST=total sleep time,总睡眠时间;SL=latency to sleep onset,睡眠潜伏期;REML=latency to rapid eye movement,REM睡眠潜伏期;SE=sleep efficiency,睡眠效率;REM=rapid eye movement,快速动眼睡眠;PLM=periodic leg movement,周期性肢体运动;SpO2=serum oxygen saturation,血氧饱和度;AHI=apnea-hypopnea index,呼吸暂停-低通气指数
2.2 RBD患者的神经心理学受损特征 与对照组相比,RBD组MMSE得分较低(分别为28.47±0.34和26.05±0.72,P=0.015),AVLT即刻回忆总分较低(分别为19.59±1.06和14.27±0.96,P=0.020),短延时回忆词语数减少(分别为6.94±0.47和4.36±0.38,P=0.003),长延时回忆词语数减少(分别为6.29±0.39和4.32±0.44,P=0.022),RCFT得分较低(分别为32.76±0.77和27.18±1.87,P=0.009),TMT A用时增加(分别为69.12 s± 6.22 s和114.36 s±11.58 s,P=0.008),TMT B用时增加(分别为175.59 s±12.71 s和262.50 s±20.87 s,P=0.005),Stroop A用时增加(分别为18.00 s±0.97 s和23.05 s±1.93 s,P=0.029),Stroop B用时增加(分别为22.35 s±1.61 s和30.23 s±2.65 s,P=0.017),Stroop C用时增加(分别为33.88 s±2.24 s和45.45 s±2.87 s,P=0.005),差异均具有统计学意义。RBD患者的总体认知功能下降,认知受损领域有言语记忆能力、视空间能力、执行功能(见表3)。

表3 RBD组和对照组的神经心理学评价
MMSE=mini-mental state examination,简易精神状态检查;AVLT=Auditory verbal learning test,听觉词语学习测试;RCFT=Rey Complex Figure Test,Rey复杂图形测试;CDT=Clock drawing test,画钟测试;SDMT=Symbol digit modalities test,符号数字转换测试;TMT=trial making test,连线测试;VFT=Verbal fluency test,言语流畅性测试;BNT=Boston naming test,波士顿命名测试
2.3 RBD组神经心理学异常与客观睡眠参数的相关性分析 睡眠效率与SDMT得分呈正相关(r=0.491,P=0.020),与城市流畅性测试得分呈正相关(r=0.436,P=0.043),与TMT A用时呈负相关(r=-0.654,P=0.001)。总睡眠时间与RCFT得分呈正相关(r=0.600,P=0.003),与TMT A用时呈负相关(r=-0.573,P=0.005),与BNT得分呈正相关(r=0.482,P=0.023)(见图1)。

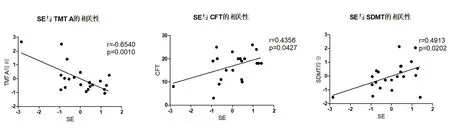
注:TST=total sleep time,总睡眠时间;SE=sleep efficiency,睡眠效率;RCFT=Rey Complex Figure Test,Rey复杂图形测试;BNT=Boston naming test,波士顿命名测试;TMT A=trial making test A,连线测试A;CFT=City fluency test,城市流畅性测试;SDMT=Symbol digit modalities test,数字符号转换测试
图1 RBD组神经心理学异常与客观睡眠参数的相关性
3 讨 论
本研究显示RBD患者存在客观睡眠障碍,与对照组相比,RBD患者的N1比例增加,N3比例减少,PLMI增加[23],与基于中国RBD患者研究一致。睡眠纺锤波是N2期睡眠的特征标志,既往研究显示iRBD与PD伴RBD患者睡眠纺锤波减少[24],本研究中RBD患者N2比例减少,与既往研究一致。RBD患者频繁的周期性肢体运动可导致严重的睡眠片段化和睡眠质量下降,本研究RBD组睡眠效率较对照组低,但差异不具有统计学意义,可能与样本量相对较小有关。RBD与神经退行性疾病密切相关,神经退行性改变可能影响控制睡眠和生物节律行为的脑区,睡眠和昼夜节律紊乱可能导致氧化损伤、代谢紊乱、代谢产物如淀粉样蛋白清除减少,这些可加剧神经退变[25]。因此临床治疗中关注RBD患者的睡眠障碍,可能有助于延缓神经退行性疾病的发展。
本研究中RBD患者存在多领域的神经心理学受损,包括言语记忆、视空间能力、执行功能。既往研究显示50%的iRBD患者以及73%的PD伴RBD患者具有轻度认知功能障碍而仅11%的PD不伴RBD及8%的对照组具有轻度认知功能障碍[11]。RBD是轻度认知功能障碍的重要危险因素,执行功能、词语延迟回忆能力、视空间功能与更严重的RBD症状相关[26],iRBD患者在词语广度、Rey复杂图形测试回忆、数字广度、逻辑记忆测试、视空间学习表现较差,与路易体痴呆的认知受损特征尤为相似[8]。随访研究显示RBD患者的非语言逻辑、注意力、执行功能及记忆力恶化,提示潜在的神经退行性改变[6,27]。我们发现RBD患者言语记忆能力受损表现为延迟回忆,而再认功能相对保留提示存在信息提取障碍而信息编码与存储相对保留,责任脑区位于信息提取功能密切相关的额颞叶,而信息编码相关的脑区边缘系统(如海马结构、海马旁回)等相对保留[28];本研究利用TMT、Stroop色词测试评价受试者的执行功能,其中TMT反应认知灵活性,该认知过程的神经基础位于左下前额叶和顶叶,Stroop色词测试是选择性注意/抑制控制的常用测试,其神经基础为背侧及腹侧注意力网络,也统称为额顶叶系统[29],因此,RBD患者执行功能障碍提示额顶叶皮质受累;RBD患者的视空间能力下降提示与其功能密切相关的顶枕叶皮质受损[30]。目前RBD患者的神经心理学异常有3种解释:(1)调控REM睡眠张力缺失的脑干环路的病变影响投射到皮质的神经纤维以及神经递质如乙酰胆碱、谷氨酸能、甘氨酸及γ氨基丁酸能系统,研究认为胆碱能障碍与iRBD患者的认知受损有关[31];(2)研究支持RBD患者存在除脑干外其他脑区的病变,比如左侧后扣带回及海马的体积减少[32],额叶皮质、舌回、梭状回厚度减少,额上沟灰质体积减少[33],单电子发射计算机成像技术发现RBD伴轻度认知功能障碍患者的枕叶、颞叶、顶叶皮质处于低灌注状[34],这些影像学异常解释了患者的信息提取、视空间能力与执行功能障碍;(3)脑电波减慢尤其是REM睡眠期[12]与iRBD的认知受损相关。但是RBD患者夜间睡眠障碍是否与神经心理学表现相关尚不明确。
既往有大量研究关注于睡眠障碍和神经心理学表现的关系,睡眠可以促进突触、树突分支的形成,从而有助于记忆存储[35],睡眠促进淀粉样蛋白的清除[36],而慢波睡眠减少,睡眠期间觉醒时间增加,可溶性淀粉样蛋白的产生相对增加,从而导致认知功能下降[37],另外长期睡眠片段化或睡眠限制抑制细胞增殖和神经发生[38]。一项荟萃分析显示PD患者中记忆和执行功能障碍与较差的睡眠相关[39]。本研究相关性分析显示RBD患者较低的睡眠效率与较差的言语信息处理能力、执行功能、言语流畅性相关,较低的总睡眠时间与视空间功能、执行功能和言语流畅性相关。言语流畅性的神经生理基础包括了总体基础、前额叶、海马以及大脑两半球的不对称性[40],数字符号转换测试评价言语信息处理能力,反应视知觉、视觉扫描、眼球运动、记忆的综合能力。既往研究显示睡眠限制使正常人执行功能的抑制控制能力受损[41],近红外光谱研究证实了睡眠时间减少者在完成工作记忆任务期间存在额叶功能障碍[42]。因此推测睡眠效率下降和睡眠时间减少可能对RBD患者额、顶、枕叶、海马等具有广泛影响,尤其是额叶,从而恶化了执行功能、视空间能力及记忆力,因此在临床工作中应重视及合理干预RBD患者睡眠障碍。
本研究为横断面研究,未来应进一步开展大样本的纵向随访研究。但是本研究为RBD患者的睡眠障碍和多领域的神经心理学受损提供了证据。RBD作为一种睡眠行为障碍,存在睡眠结构紊乱、睡眠质量下降和腿动指数增高,神经心理学受损提示患者存在额、颞、顶枕叶皮质受累,睡眠效率下降和睡眠时间减少可能加重RBD患者的皮质及海马受损,恶化神经心理学表现。在临床工作中对RBD患者进行PSG检查并关注其睡眠障碍、提高睡眠质量,有助于延缓认知功能障碍的发展。

