规范乳管镜报告系统联合20G留置针和美兰在导管内肿瘤手术中的应用价值
徐步存,刘玉献,刘爱霞
(河南省安阳市妇幼保健院 乳腺科,河南 安阳 455000)
乳管镜(fiberoptic ductoscopy,FDS)在导管内肿瘤诊断及治疗中有着极高的应用价值[1],目前已广泛应用于临床,但由于不规范的操作及不规范的报告系统,对于临床手术医师的帮助有限[2],仅限于确定肿瘤的存在与否。导管内肿瘤的治疗主要依靠手术,但传统的溢液乳段切除术是向溢液孔内注射美兰,完整切除导管系统(甚至象限切除术),术中容易出现溢液孔难找、手术切除范围大、周围组织损伤不小、术后残腔积液多、美观受影响及病变检出率低等情况[3-4]。近来,许多新的手术方法如导管镜下将配套的定位针留于肿瘤表面进行手术,切除肿瘤所在乳腺组织行区段切除,切除范围有所减少[5]。经乳管镜行导管内乳头状瘤激光治疗,因无法取得病理学诊断,目前在国内尚未开展[6-7]。为此总结本院2012年2月-2015年12月共319例导管内肿瘤患者的手术资料,探讨规范的乳管镜报告系统联合20 G留置针和术中美兰定位在导管内肿瘤手术中的应用价值,旨在推广其广泛应用于临床,现报道如下。
1 资料与方法
1.1 临床资料
选取安阳市妇幼保健院乳腺科2012年2月-2015年12月行导管内肿瘤手术患者。病例纳入标准:经乳管镜检查提示导管内占位性病变,患者同意入组并签署知情同意书。排除标准:乳腺X 线检查阳性或乳腺彩超阳性或者乳晕区可触及结节、肿块患者。入组患者一共319例,均为女性,年龄19~73岁,平均42.88岁,其中大于50岁者45人。临床检查绝大多数为单孔或多孔的浆液性或血性溢液,少数为乳汁样溢液,均未在乳晕下及乳晕旁触及结节或肿块,乳腺X线检查均为阴性,彩超下未见明显占位性病变,乳管镜检查下可见导管内占位性病变。319例均在本院行手术,其中78例行传统术中美兰染色溢液乳段切除术(导管系统完整切除),其中60例检出肿瘤,18例检出炎症或者及导管囊肿;241例行规范的导管镜报告系统联合20 G留置针和美兰定位下溢液乳段切除术(仅切除包含病变的部分乳管),其中220 例检出肿瘤,21例检出炎症或者及导管囊肿。
1.2 方法
1.2.1 FDS检查方法 使用北京博莱德FVS-6000 MI型内镜图像系统,采用注水法。检查者平卧位,先用1/4平针头准确插入检查乳孔后注入1%利多卡因0.2 ml浸润麻醉,分别用5~8号Bownman眼科泪管探针由细至粗依次扩张乳管,然后置入乳管镜,边注入少量生理盐水使乳管保持扩张状态边循腔进镜,发现病灶后,采集图像记录。
1.2.2 乳管镜检查的规范的报告系统 乳管镜的检查报告中必须包括患者的主诉、临床查体(是否有溢液,溢液性质、量、颜色,单侧双侧、单孔多孔,乳晕区及边缘有无肿块,与乳管的关系)、彩超及乳腺X线的异常表现情况、乳管内的情况(非肿瘤性的描述、肿瘤的详细描述:对肿瘤所在乳孔、深度、乳管分级及肿瘤数量、形态、颜色、边界、表面情况、与周边组织关系等)。例如:左侧乳头1点位进镜5 cm VI级乳管、9点位进镜3.5 cm IV级乳管内均可见不规则肿物堵塞管腔;右侧乳头7点位进镜3 cm II级乳管分叉口、3点位进镜4 cm V级乳管、12点位进镜4 cm III级乳管分叉口、9点位进镜4.5 cm III级乳管、9~10 点位进镜5 cm V级乳管末端、9点位偏中央孔进镜3 cm II级乳管及4.5 cm IV级乳管内均可见肿物堵塞管腔,见图1。

图1 乳管镜检查报告单
1.2.3 导管内肿瘤患者检查后20 G留置针定位 乳管镜检查后用20 G留置针置入导管内肿瘤所在乳管的乳孔内,标记病变乳管,见图2。防止术中无法准确找到病变乳管,用无菌薄膜敷贴固定,以备术中使用,一般保持24 h,见图3。
1.2.4 导管内肿瘤患者术中美兰定位 患者麻醉后自20 G留置针内注入美兰0.2 ml,见图4。按压乳晕区,找到乳管走形方向,取乳晕边缘弧形切口,长约2~3 cm,依次切开皮肤、皮下组织,游离至乳头根部,纵行剖开腺体,找到蓝染乳管,见图5。自乳头根部切断结扎,向远端游离蓝染乳管至乳管镜报告单中进镜深度的乳管,以此为中心,切除远近2 cm乳管送检,见图6。依次缝合各层组织,术中无需放置引流管,见图7。
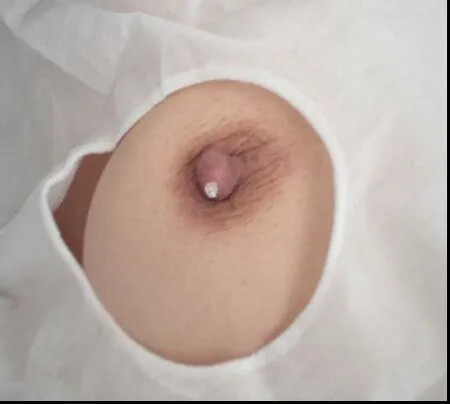
图2 20 G留置针定位
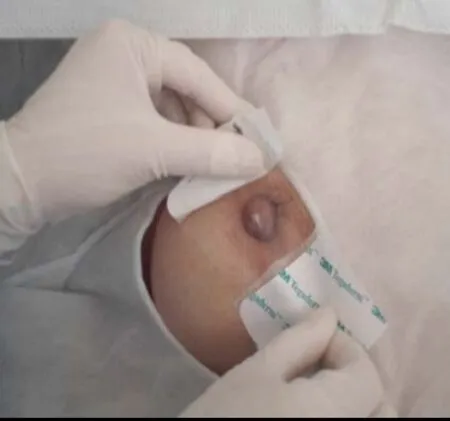
图3 定位后敷贴固定
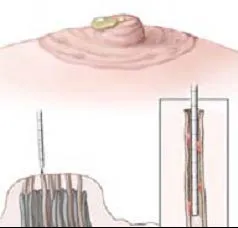
图4 自溢液定位孔注入0.2 ml美兰
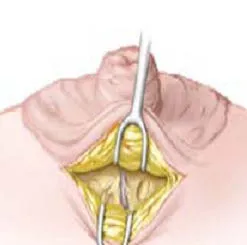
图5 选取乳晕边缘切口,找蓝染乳管

图6 病变乳管局段切除
图7 术后切口愈合
1.3 统计学方法
本组资料采用SPSS 17.0软件进行统计学分析,各组病变符合率的比较以百分比(%)表示,应用χ2检验,P <0.05为差异有统计学意义。
2 结果
319例行手术患者78例行传统术中美兰染色溢液乳段切除术(导管系统完整切除),其中60 例检出肿瘤(包括导管内乳头状瘤或者乳腺癌),18例检出炎症或者及导管囊肿。241例行规范的导管镜报告系统联合20 G留置针和美兰定位下溢液乳段切除术(仅切除包含病变的部分乳管),其中220例检出肿瘤(包括导管内乳头状瘤或者乳腺癌),21例检出炎症或者及导管囊肿。各组病理结果检出例数及符合率见表1(备注:检出肿瘤用阳性表示,检出炎症及或者导管囊肿用阴性表示;行传统术中美兰染色溢液乳段切除术组用传统加美兰表示,行规范的导管系统联合20 G留置针和美兰定位下溢液乳段切除术用20 G定位表示)。
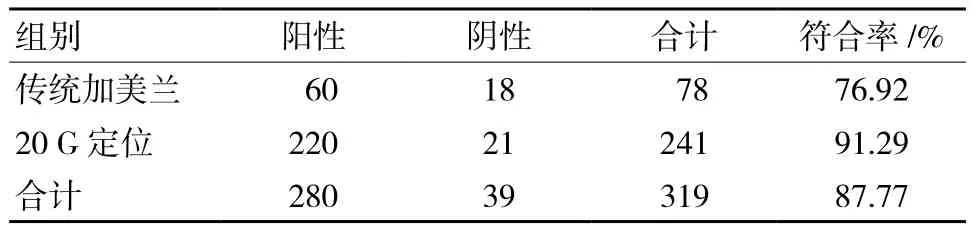
表1 各组病理结果检出例数及符合率 例
3 讨论
3.1 规范的导管镜报告系统对手术的指导作用
乳管镜检查逐渐成为乳腺科常用辅助检查之一[8],仅次于乳腺X线及彩超,但国内缺少专门的培训机构及单位。由笔者单位所见到的进修生发现,绝大多数基层医院的乳管镜检查操作及报告单均不规范,对临床的指导作用有限,对导管内肿瘤手术的帮助甚少;大多反映术后病理与临床不符、病变检出率低、术中切除范围不好控制及术后外观影响较大等。如果乳管镜的操作和报告单非常规范,例如乳管镜操作过程中严格按照时钟表,描述导管内肿瘤所在乳孔的对应时钟位置,并且描述进镜的距离,以及位于乳管的分级位置和是否堵塞管腔,均可以帮助术者确定病变乳管开口位置(即使术前已无溢液)、手术切口选择、乳管走形方向及切除乳管范围(尽可能做到仅切除病变所在的局段乳管,即乳管镜报告系统描述的位置距离上下1 cm)等,从而达到最小的有效切除、最满意的外观,见图7。
3.2 20G留置针在手术定位中的应用价值
笔者曾在北京某医院进修时发现,该医院乳头溢液的手术经常临时停台,因为术前发现不再溢液,无法确定溢液孔,无法进行准确手术。更为尴尬的是患者已躺在手术床上甚至麻醉好了,无法进行手术了。20 G留置针的使用帮助笔者定位了病变乳孔(避免误切除或者切除范围不确切),耗材廉价,不足20元,而且操作简单,便于基层医院推广采用。
3.3 美兰在手术中的使用价值
传统的溢液乳段切除术是向溢液孔内注射美兰,然后完整切除有蓝染导管系统(甚至象限切除术),但切除范围大,周围组织损伤较大,有些甚至需要放置引流管,术后影响患者的美观,且病变检出率低[9]。近年来,许多新的手术方法如导管镜下将配套的定位针留于肿瘤表面进行手术,切除肿瘤所在乳腺组织行区段切除,切除范围有所减少,但对于距乳管开口处太近的病灶,可能因为没有足够的距离无法固定,并且定位针花费较高,一般家庭难以负担,不利于基层医院开展使用[10]。李元庆等[11]在手术中利用乳管镜光源做引导,行局部病灶及部分乳管切除。该方法能够准确找到病灶,无需过多的切除周围正常乳腺组织,手术创伤小,病理诊断率也相当高,但手术过程中需要不断地调试器械,容易损坏昂贵的乳管镜镜头,而且该术式的手术时间较长。美兰临床常见,价格便宜,操作简便,结合乳管镜报告系统可以很好地帮助确定乳管走形方向,从而使术者准确地发现乳管病灶的部位,有助于提高切除性和送病理的可靠性,见图8,减少漏诊,缩小了手术范围,减少乳腺腺体破坏,乳房外观基本上不影响,术后不良后果减少,值得广泛推广应用。
通过规范乳管镜报告系统联合20 G留置针和美兰,可以在导管内肿瘤手术中做到多重保障,即利用导管镜报告系统定距离(病变距离乳头的距离);利用20 G留置针定乳孔(准确定位导管内肿瘤所在乳管的乳孔);利用术中注射的美兰定溢液乳段(即乳管走形的方向、切口的选择)。当然手术过程中可能还存在其他的一些问题,例如消毒过程中定位针的不慎脱落、美兰注射过程中的乳管破裂及术中溢液乳段切除过程中破裂所导致的手术视野污染均可能增加手术的难度和精准度。但相信通过笔者对手术操作流程的优化、手术熟练程度的提高,这些问题都可以有效解决。
目前国内的乳管镜系统并不支持内镜下的病理取材活检,相信随着医疗和材料科学技术的进步,国内的乳管镜检查系统也可以在不久的将来实现内镜下病灶的活检,然后进行射频消融手术等,进一步实现精准、微创化手术。
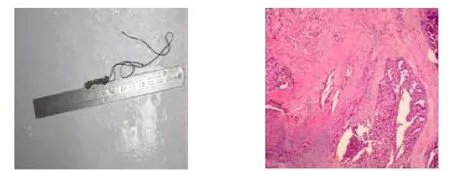
图8 术后病理

