猪伪狂犬病毒TaqMan 荧光定量PCR 检测方法的建立及其冻干检测试剂的制备
侯月娥1,叶 平2,伍建敏1,王凤求1,赵玉林1,王贵平1,李中圣1
(1.广东海大畜牧兽医研究院,广州511400;2.桂林联勤保障中心第二储备资产管理局,广州510440)
猪伪狂犬病是一种由伪狂犬病毒(Pseudorabies virus,PRV)感染导致的急性、热性传染病。除高级灵长类以外,PRV能够感染大部分哺乳动物[1]。猪是PRV的天然宿主和贮存宿主,不同日龄的猪感染PRV后表现出不同的症状。哺乳仔猪感染PRV后多表现为高热和神经症状,常常出现整窝集中发病,15日龄以内的仔猪死亡率可达100%[2]。随着日龄的增加,猪感染PRV后死亡率迅速降低,断奶阶段死亡率下降到30%以下。保育育肥猪感染PRV后多见发热和呼吸道症状,耐过后生长迟缓多成为僵猪。母猪初次感染PRV往往呈一过性发热,妊娠母猪会出现流产,产死胎等症状[3]。PRV已给全球养猪业造成了巨大的经济损失。美国和欧洲各国通过使用优质的基因标记疫苗和相应的鉴别诊断方法,已很好的控制或净化了猪伪狂犬病[4-6]。但在多数发展中国家,猪伪狂犬病仍频繁发生。我国PRV仍呈流行趋势,严重制约着养猪业的健康发展。对PRV感染早期进行及时、快速、准确的诊断,是有效防制猪伪狂犬病的重要前提。
gE、gI和TK基因是PRV的主要毒力相关基因,世界各国广泛使用的PRV基因缺失疫苗多为gE、gI基因缺失表型或gE、TK双基因缺失表型,以及gE、gI和TK三基因缺失表型[7-9]。PRV传统诊断方法包括病毒的分离、动物接种试验、ELISA、病毒中和试验、乳胶凝集试验、胶体金免疫层析试验、血凝与血凝抑制试验以及普通PCR等方法,这些方法存在耗时长,敏感性低,易出现假阳性,不能定量,试剂不方便运输等缺点,给PR早期隐性感染的诊断带来一定难度[10]。本研究在实时荧光定量PCR方法构建成功的基础上,将除核酸以外所有试剂加入保护剂进行冻干,更方便快捷,适用于PRV的快速检测和流行病学调查,从而为PR的预防和控制提供帮助。
1 材料与方法
1.1 病毒株、菌株及质粒 PRV、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)均由广东海大畜牧兽医研究院保存;猪伪狂犬活疫苗科伟净(HB2000株)和科卫宁(HB-98株)购自武汉科前生物股份有限公司;猪伪狂犬活疫苗伪美瑞(Bartha-K61株)购自哈尔滨维科生物科技开发公司;猪伪狂犬活疫苗猪克伪(Bartha-K61株)购自珠海市安富来物科技有限公司;大肠杆菌DH5α和pMD-18T载体购自TaKaRa公司。
1.2 主要试剂 体液病毒DNA小量制备试剂盒购自Axygen公司;Taq酶、dNTP购自TaKaRa公司;琼脂糖凝胶DNA纯化回收试剂盒以及普通质粒小量提取试剂盒均购自Omega公司;冻干保护剂由广东海大集团畜牧和水产研究中心提供。
1.3 引物和探针的设计及合成 根据PRV(AY170318)的核酸序列,利用Beacon Designer 7设计软件,设计针对PRV gE基因特异性引物和荧光探针(表1),引物和探针由上海Invitrogen公司合成。
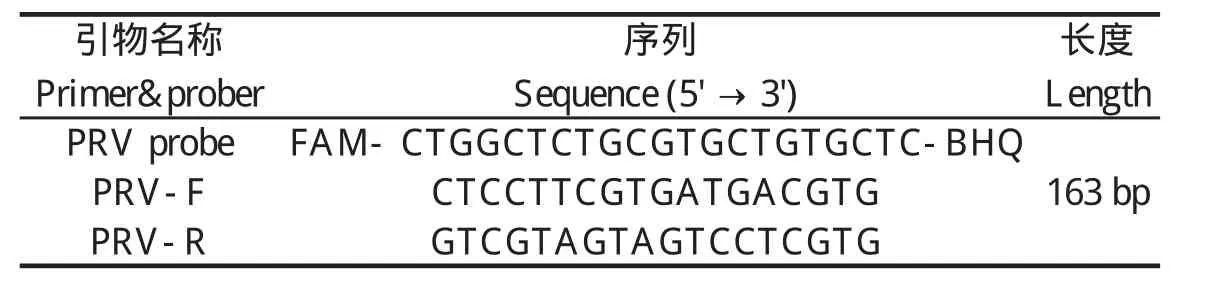
表1 PRV的荧光定量PCR探针及扩增引物Table 1 PRV primers and fl uorescent probes of real-time PCR
1.4 PRV总核酸提取及模板的制备 参照病毒DNA小量制备试剂盒说明书提取病毒传代细胞中的总核酸,-80℃保存备用。
1.5 PRV基因片段克隆及标准品的制备 以PRV的DNA为模板,PRV-F/PRV-R(10 pmol/L)为引物进行PCR扩增。扩增条件:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸45 s,共35个循环;72℃再延伸6 min。PCR扩增产物采用2%琼脂糖凝胶电泳检测。将切胶纯化的PCR产物分别克隆至pMD-18T载体中,构建重组质粒pMD-PRV。将阳性的重组质粒测序鉴定,并采用核酸蛋白检测仪测定重组质粒浓度,换算成拷贝数。
1.6 TaqMan实时荧光定量PCR扩增反应条件的优化PRV的引物和探针终浓度为0.1~0.6 μmol/L,退火温度为55℃~65℃,以不同浓度配比和不同的退火温度进行荧光定量PCR反应,选择效果最佳的引物、探针浓度及退火温度。
1.7 TaqMan实时荧光定量PCR标准曲线的构建 将1.5中制备的PRV标准品做10倍梯度稀释,用不同稀释梯度的重组质粒作为模板,每个梯度的质粒设立3个重复。使用优化的反应体系进行实时荧光定量PCR扩增。荧光定量PCR的反应条件:95℃预变性1 min,95℃变性10 s,退火温度根据1.6摸索出来的最适温度,40个循环,每个循环结束时进行荧光信号采集。
1.8 TaqMan实时荧光定量PCR特异性和敏感性检测
1.8.1 特异性试验 将提取的不同PRV疫苗株的DNA和CSFV、PRRSV反转录后的cDNA分别作为模板进行PCR扩增,验证其特异性。
1.8.2 敏感性试验 将测定好质粒浓度的模板进行10倍梯度稀释,利用PRV冻干检测试剂测定其敏感性。与本实验室已经建立的PRV普通PCR检测结果进行敏感性比较。
1.9 反应试剂冻干品的制备
1.9.1 冻干保护剂的优化 将冻干保护剂稀释为4组不同的浓度(10、8、5、1.25 μmol/mL),与配制好的反应试剂混匀,然后进行无菌分装,200 μL的8连管中,每管加入100 μL反应液(相当于20 μL的反应体系)。分装后于-80℃冰箱冷冻3 h,完全冷冻后,开盖放于已经调试好的Triad冷冻干燥器里面进行冷冻干燥。待程序停止后,根据冻干样品物理性状选择最佳的一组。
1.9.2 PRV冻干检测试剂的使用方法 将冻干试剂用16 μL灭菌去离子水进行溶解,加入2 μL阳性对照品,同时用灭菌的去离子水作为阴性对照,每管20 μL,封盖混匀离心。荧光定量PCR的反应条件均为:95℃预变性1 min,95℃变性10 s,退火温度根据1.6摸索出来的最适温度,40个循环,每个循环结束时进行荧光信号采集。
1.10 PRV冻干检测试剂保存期试验 将冻干检测试剂分别放置于室温25℃和37℃保存,定期对其敏感性进行检测,考察不同保存条件对敏感性的影响。
1.11 PRV冻干检测试剂在手持式荧光PCR仪上的试验 手持式荧光PCR仪为单通道PCR仪,将1.5制备的PRV标准品做10倍梯度稀释,用不同稀释梯度的重组质粒作为模板,根据其已有内置程序进行荧光PCR扩增,收集荧光信号进行定性检测。
1.12 临床样本的检测试验 选取经过检测的PRV阳性样品30份,PRV可疑样品27份,未经检测样品40份,累计97份,样品均来自广东省,采用本次构建的冻干检测试剂对临床样品进行检测,验证该方法的灵敏性和特异性。
2 结果
2.1 重组质粒标准品的制备 以合成的PRV引物进行PCR扩增,扩增产物经电泳检测后,切胶纯化回收PCR产物,分别与pMD-18T载体连接,构建重组质粒pMD-PRV,对阳性重组质粒进行测序鉴定。结果显示,PRV引物能扩增出相应的目的片段(图1)。

图1 PRV阳性重组质粒的鉴定Fig. 1 Identifi cation of PRV positive recombinant plasmids
2.2 TaqMan实时荧光定量PCR扩增反应条件的优化PCR反应中引物、探针的不同终浓度和不同的退火温度都会引起Ct值的不同,PRV-F/PRV-R的终浓度为0.3 μmol/L,探针终浓度为0.2 μmol/L,退火温度为60℃时,对同一标准品的检测信号值最强,Ct值最小。
2.3 TaqMan实时荧光定量PCR标准曲线的构建 质粒浓度为1×106~1×101copies/μL的6个线性梯度时,标准曲线呈等距性和平行性,具有较好的梯度性(图2)。

图2 PRV TaqMan实时荧光定量PCR标准曲线Fig. 2 The standard curve of TaqMan real-time PCR for PRV

图3 PRV TaqMan实时荧光定量PCR的特异性检测Fig.3 Specifi city of PRV TaqMan real-time PCR
2.4 TaqMan实时荧光定量PCR特异性试验和敏感性试验
2.4.1 特异性试验 将提取的PRV野毒、基因缺失活疫苗的DNA以及CSFV和PRRSV病毒核酸反转录的cDNA作为模板进行PCR扩增,结果显示,仅PRV野毒的荧光信号为阳性,其他疫苗株和另外两种病毒的检测均为阴性,说明建立的TaqMan荧光定量PCR特异性较强,与其他病毒的基因没有交叉反应,可用于临床野毒检测(图3)。
2.4.2 PRV TaqMan荧光定量real-time PCR敏感性试验 对PRV的反应标准重组质粒进行系列稀释,结果显示,实时荧光定量PCR的最低检测量为10 copies/μL(图4)。与实验室已经构建的PRV普通PCR检测结果进行比较,本研究建立的实时荧光定量PCR是普通PCR敏感性的100倍(图5)。

图4 PRV实时荧光定量PCR的敏感性检测Fig.4 Sensitivity of PRV TaqMan real-time PCR
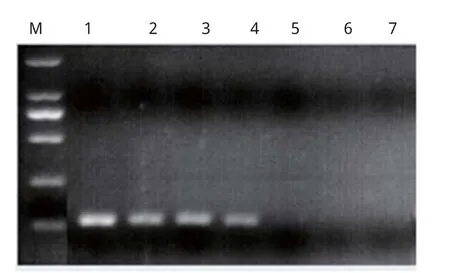
图5 普通PRV标准品敏感性试验Fig.5 Sensitivity of the normal PCR for PRV detection
2.5 PRV冻干保护剂的优化 优化试验结果显示保护剂浓度达到8 μm/mL时,和不加保护剂的反应Ct值相同(图6),故将保护剂浓度定为8 μm/mL。该组冻干形态上也较好(图7)。
2.6 PRV冻干检测试剂保存期试验 结果显示在室温25℃下存放6个月,37℃存放15 d和最初的检测结果没有差异,敏感性都可以达到10 copies/μL(表2)。由此说明,PRV的冻干检测试剂在这两种存放条件下的敏感性并未降低,质量稳定。
2.7 手持式荧光PCR仪检测结果和荧光定量PCR结果的比较 利用PRV冻干检测试剂,采用手持式荧光PCR仪对PRV标准品进行定性检测,并与TaqMan荧光定量PCR结果进行对比,结果显示手持式荧光PCR仪检测结果与荧光定量PCR检测结果相一致,表明冻干检测试剂也可以应用于手持式荧光PCR仪。

图6 PRV冻干保护剂的优化Fig.6 Optimization of the freeze-dried protective agent

图7 PRV 冻干检测试剂冻干后的物理性状Fig.7 The physical characters of the freeze-dried detection reagent for PRV

表2 PRV冻干检测试剂不同保存条件下的敏感性试验Table 2 Specifi city of the freeze-dried detection reagent after storage under different conditions
2.8 临床样品检测结果 对30份普通PCR鉴定的已知临床病料和27份可疑临床病料,以及未知的40份病料进行检测,结果显示,30份阳性病料,病毒拷贝数在4.1×104~2.1×107copies/μL(超过以及等于106copies/μL的样品,均稀释100后再次检测),符合率为100%。27份可疑病料检测结果显示9份感染PRV,病毒拷贝数在1.3×102~3.7×103copies/μL,阳性率为33.33%。40份未验证病料的检测结果显示,阳性感染的有18份,病毒拷贝数在2.7×102~6.4×108copies/μL,感染率为45%,而普通PCR仅检测出11份,感染率为27.5%。

表3 手持式荧光PCR仪和荧光定量PCR检测结果的比较Table 3 Comparison of detection result of handheld real-time PCR device and TaqMan real-time PCR
3 讨论
猪伪狂犬病是危害我国养猪业最重要的传染病之一,可引起母猪流产、死胎、木乃伊胎,初生仔猪大批死亡,成年猪则呈隐性感染,长期带毒排毒,并且同引起繁殖障碍疾病的病毒病临床症状相似,容易产生其他细菌性疾病的继发感染,使病情恶化不利于临床诊断。猪伪狂犬病严重影响种猪场生产及优良品种的推广,给养猪业造成极大的损失[11]。因此,对PRV进行快速、及时、准确的诊断,是有效防治PR的重要前提。PRV检测方法有病毒分离、gE抗体检测、常规PCR检测、中和试验、细胞免疫等,但这些方法耗时较长,敏感性和特异性存在不足。荧光定量PCR不仅可对核酸进行定量检测,而且灵敏度高,特异性强,实时性好,耗时短,自动化程度高,能同时检测多份样品[12]。定量检测可以对疫病进行预警预报,为防控和治疗赢得时间,并且在研究病毒对机体持续性感染方面具有重要意义[13-14]。
冷冻干燥技术是提高生物制品稳定性的通用方法,也为分子诊断试剂的长期保存提供了有效途径[15]。本研究通过对PRV gE基因的保守序列进行了特异性的探针和匹配引物的设计,并对反应体系和反应条件进行了反复调整和优化,最终确定了最佳反应条件。在优化的基础上将除核酸以外的所有成份(含保护剂)进行冷冻干燥。根据检测结果最终确定了最佳保护剂组合和冻干条件。干燥好的冻干检测试剂可以常温运输和短时间保存,不会影响其性能,直接用灭菌的去离子水进行溶解后,添加所需检测的DNA,置于荧光定量PCR仪,通过分析软件能直观详细记录整个PCR过程,不需要进行反转录和琼脂糖凝胶电泳,有效减少假阳性和污染发生,并且简单快捷,对工作人员的专业要求不高。利用标准曲线,可以直接从软件上得到病毒的准确拷贝数。
赵丽等[16]和田云等[17]建立的PRV荧光定量检测方法特异性和敏感性均较好,但是操作繁琐,试剂必须低温保存,不方便运输,不便于普及。本研究制备的冻干检测试剂可以在常温下操作而不影响其敏感性,也可以利用手持式荧光PCR仪来进行检测。本研究基于TaqMan荧光定量PCR检测方法,结合核酸扩增体系冻干工艺制备的PRV PCR冻干试剂弥补了传统检测方法重复性和耗时长的不足,同时具有较高的特异性,对于PRV早期诊断,致病机理研究以及防控技术研究等具有重要意义。
——一道江苏高考题的奥秘解读和拓展

