澳洲坚果种质资源光合特性的比较研究
宫丽丹,马 静,贺熙勇,柳 觐,吴 超,倪书邦
(云南省热带作物科学研究所,云南 景洪 666100)
【研究意义】澳洲坚果(Macadamiaspp.)原产于澳大利亚昆士兰与新南威尔士的亚热带雨林,系山龙眼科澳洲坚果属植物,其果实具有较高的营养价值和经济价值,已成为热带地区新兴的多年生木本油料树种和高档坚果类果树,已被越来越多的国家和地区栽种[1-5]。 澳洲坚果种质资源是生产上直接利用、种质资源选育、种质创新和生物技术研究的物质基础[6]。光合作用是植物叶片利用CO2和H2O合成有机物的过程,是果树产量高低的决定性因素[7-8]。因此,研究光合特性对澳洲坚果种质资源有十分重要的意义。【前人研究进展】刘建福[9]研究澳洲坚果叶片光合速率日变化发现,澳洲坚果光合速率日变化呈不对称的双峰曲线,有明显的“午休”现象。刘建福[10]研究磷胁迫对澳洲坚果光合特性影响发现,在磷胁迫下澳洲坚果幼苗叶片中叶绿素总量、净光合速率、气孔导度和水分利用效率降低,而胞间CO2浓度和蒸腾速率升高。原慧芳[11]研究磷胁迫对澳洲坚果光合特性影响发现,澳洲坚果幼苗叶片的光合参数在低磷处理下净光合速率、蒸腾速率、胞间CO2浓度、气孔导度均呈下降趋势。【本研究切入点】以35份澳洲坚果种质资源为试材,用LI-6400XT光合仪控制环境条件方法测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)。应用方差分析和相关性分析综合评价澳洲坚果资源光合特性。【拟解决的关键问题】以期了解不同种源澳洲坚果的光合生产潜能,揭示不同种源间光合特性的差异,为生产中澳洲坚果资源的选择利用及育种工作提供依据,为选育高光效的品种提供参考。
1 材料与方法
1.1 供试材料
试验于农业部澳洲坚果种质资源圃进行,试材为2012年定植的35份资源(表1)。试验地海拔550 m,红壤土,pH值为4.05~4.35,果园株行距为4 m×8 m,常规管理。
1.2 实验方法
选择光照及气温相对较高天气晴朗的6月,测定光合作用各项指标。采用美国基因公司(LI-COR公司)生产的LI-6400XT便携式光合作用测量系统。测定时随机选取植株生长状况一致的向阳健康成熟叶片(植株新梢自上而下第2轮稳定叶)作为供试材料,并对测定叶片进行标记。
测定于早上9:00-11:30时进行。每天每个种质资源测9片叶,1个种质资源测定1片叶后即测下1个种质资源,直至最后1个种质资源再返回测第1个种质资源的第2片叶。采用控制环境条件进行测量,其中设定光强为1000 μmol/m2·s,CO2为400 μmol/mol。测定指标有净光合速率(Pn, mol/m2·s)、蒸腾速率(Tr, mmol/m2·s)、气孔导度(Gs, mol/m2·s)、胞间CO2浓度(Ci, mol/mol)。根据测定指标计算叶片气孔限制值(Ls)、水分利用效率(WUE,mol/mol)。

表1 供试材料及来源
续表2 Continued table 2

编号Code种源Germplasm resource学名Scientific name来源Origin23HAES918Macadamia spp.广西24HAES695Macadamia spp.广西25粗壳种Macadamia spp.澳大利亚26南亚1号Macadamia spp.广东27桂热1号Macadamia spp.广西28广11Macadamia spp.广西29广9Macadamia spp.广西30YoungMacadamia spp.澳大利亚31三叶澳洲坚果Macadamia spp.澳大利亚322/18McMacadamia spp.澳大利亚33NG8(X8)Macadamia spp.澳大利亚344/7McMacadamia spp.澳大利亚35YonikMacadamia spp.澳大利亚
1.3 数据分析
应用SAS9.2统计分析软件对各项指标进行方差分析、以最小显著差数法(LSD)对资源间存在差异的指标进行多重比较,并对指标间进行相关分析。
2 结果与分析
2.1 不同种源澳洲坚果的叶片光合生理指标差异比较
由表2可以看出, 35份澳洲坚果种质资源的Pn存在显著性差异(P<0.01,LSD0.05=1.6 mol/m·s),HAES660的Pn值最高,达到9.62 mol/m2·s; D的Pn值最低,为4.49 mol/m2·s ;Gs存在显著性差异(P<0.01,LSD0.05=0.025 mol/m2·s),HAES660的Gs值最高,达到0.13 mol/m2·s,D的Gs值最低,为0.049 mol/m2·s,Ci存在显著性差异(P<0.01,LSD0.05=27.26 mol/mol),HAES660的Ci值最高达,到264.49 mol/mol,广11值最低,为186.19 mol/mol。Tr存在显著性差异(P<0.01,LSD0.05=0.44 mmol/m2·s)HAES660的Tr值最高,达到2.57 mmol/m·s,广11值最低,为1.11 mmol/m2·s;Ls存在显著性差异(P<0.01,LSD0.05=0.068),广11Ls值最高,达到0.53,HAES660的Ls值最低,为0.33;WUE存在显著性差异(P<0.01,LSD0.05=0.69 mol/mol)Yonik值最高达到5.14 mol/mol,O.C值最低,为3.26 mol/mol。35份澳洲坚果种质资源光合作用能力相对较高的是HAES660、HAES918和广11,最差的是HAES900、HAES246和D光合能力最差,其它29份资源光合作用能力居中。

表2 不同种源澳洲坚果的叶片光合生理指标差异比较
续表2 Continued table 2

编号CodePn(mol/m2·s)Gs(mol/m2·s)Ci(mol/mol)Tr(mmol/m2·s)LsWUE(mol/mol)116.16±0.160.07±0.03223.76±3.791.70±0.060.44±0.013.76±0.07127.84±0.120.08±0.02213.71±2.880.98±0.050.47±0.014.07±0.06137.47±0.140.08±0.03237.15±2.192.13±0.050.41±0.013.54±0.03149.62±0.120.13±0.03264.49±2.012.57±0.040.34±0.013.78±0.04157.17±0.220.09±0.04243.61±2.871.82±0.080.39±0.014.09±0.06166.02±0.110.06±0.01211.43±1.301.23±0.020.47±0.004.91±0.03178.86±0.150.10±0.02236.89±2.442.03±0.040.41±0.014.40±0.06188.21±0.160.10±0.03245.60±2.332.03±0.050.39±0.014.12±0.04197.69±0.170.08±0.02221.77±2.721.75±0.030.45±0.014.41±0.06207.95±0.190.09±0.03240.75±2.712.06±0.070.40±0.013.95±0.05214.95±0.270.05±0.01238.56±6.241.19±0.030.40±0.024.13±0.21228.22±0.130.10±0.03244.08±4.002.01±0.060.39±0.014.29±0.10239.33±0.130.10±0.04228.99±3.451.99±0.060.43±0.014.82±0.07247.62±0.170.07±0.02213.63±2.961.61±0.050.47±0.014.82±0.06258.12±0.300.11±0.04252.93±5.072.15±0.080.37±0.013.96±0.13267.64±0.140.07±0.02211.72±2.261.57±0.040.47±0.014.92±0.05275.48±0.190.07±0.03253.56±2.711.62±0.060.36±0.013.48±0.07289.13±0.170.12±0.04250.13±2.682.35±0.070.37±0.013.98±0.06296.80±0.230.06±0.02203.99±1.301.38±0.050.49±0.004.93±0.02308.68±0.170.11±0.04248.32±3.741.98±0.060.38±0.014.50±0.08316.48±0.190.08±0.03253.30±2.881.65±0.050.37±0.013.99±0.06325.68±0.140.06±0.02212.63±3.941.21±0.040.47±0.014.86±0.09336.76±0.250.06±0.02202.34±1.921.36±0.050.49±0.005.02±0.04345.19±0.140.05±0.02208.56±4.091.16±0.040.48±0.014.69±0.10357.66±0.130.07±0.01200.84±2.271.50±0.030.50±0.015.15±0.05
2.2 澳洲坚果种质资源光合生理指标变异统计
种质资源的各个瞬时光合生理指标变异结果见表3,6个指标的变异系数变动幅度为8.99 %~30.85 %。其中,Gs变异系数最大(30.85 %),Gs变异幅度为0.043~0.132 mol/m·s。Ci的变异系数最小(8.99 %),变异幅度为186.187~264.493 mol/mol。
方差分析表明(表4),光合生理指标在澳洲坚果种源间存在极显著差异。F值大小顺序为Gs(6.46)﹥Tr(5.59)﹥Pn(5.60)﹥WUE(4.55)﹥Ls(4.38)﹥Ci(4.37)。6个参数的重复力变动为77.11 %~84.52 %。其中,Gs的重复力最高84.52 %,Ci的重复力最低,为77.11 %。
2.3 澳洲坚果种质资源光合作用参数间的相关分析
分析35份供试种质资源的Pn、Gs、Ci、Tr、Ls、WUE相关关系结果表明(表5),Pn与Gs、Ci、Tr之间存在极显著的正相关(P<0.01),相关系数大小为Gs(0.922)﹥Tr(0.829) ﹥Ci(0.513)。显然Pn的大小受到Gs、Ci、Tr的制约,低Gs、Tr、Ci是限制Pn的主要因子。Gs与Tr、Ci呈极显著的正相关(P<0.01),Tr与Ci,Ls与WUE呈极显著的正相关(P<0.01)。Ls与Pn、Gs、Ci、Tr呈极显著的负相关(P<0.01),WUE与Gs、Ci、Tr呈极显著的负相关(P<0.01)。

表3 澳洲坚果种源光合生理指标变异
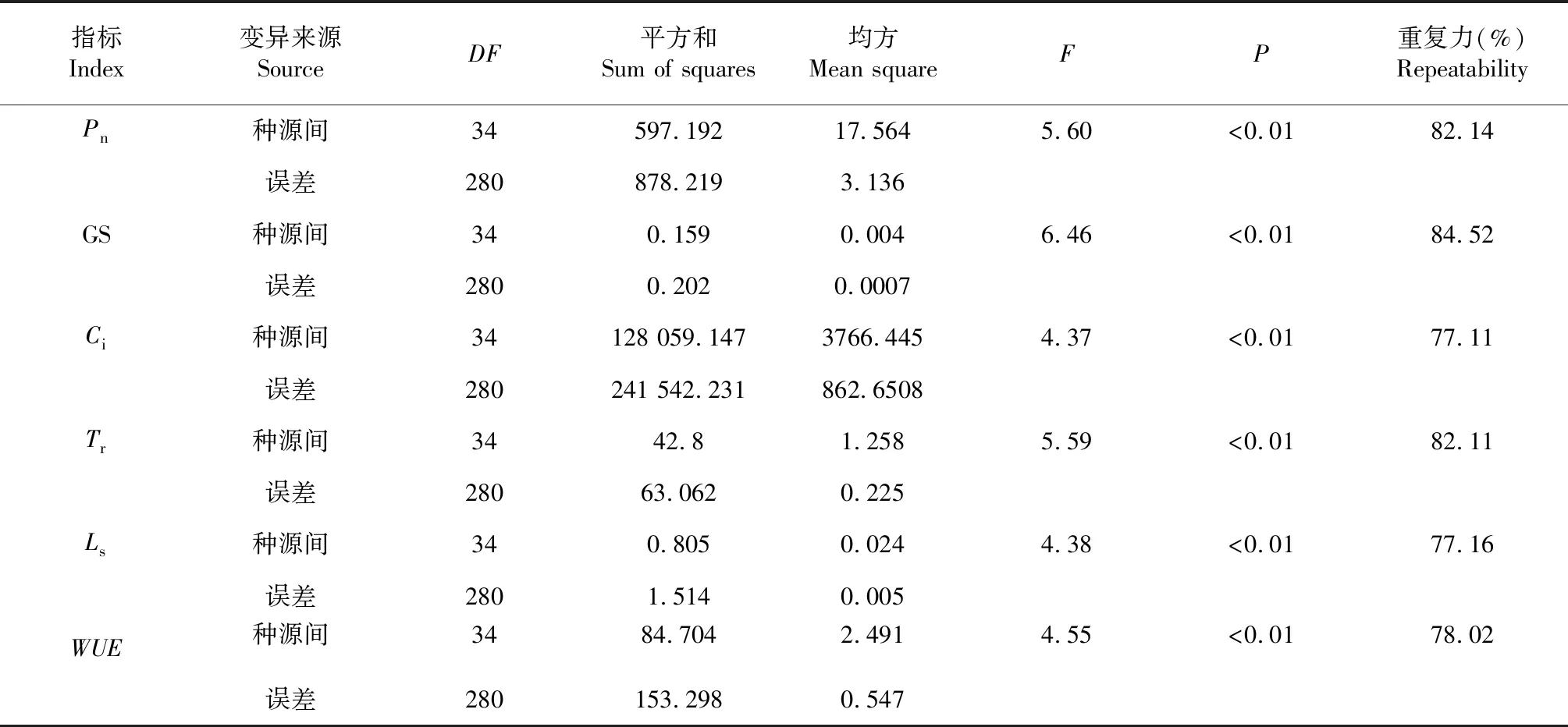
表4 不同种源澳洲坚果光合生理指标方差分析

表5 光合作用参数间的相关性
3 讨 论
光合指标为数量性状,受到试验材料、环境因子及仪器调控等许多因素的影响。为了增强试验数据的可靠性,在整个试验过程中,最大程度上做到栽培管理措施一致、测定控制条件相同、各个试验材料的测定时期和部位一致。35份澳洲坚果种质资源各个光合指标在种源间存在极显著差异,Gs的变异系数最大,Ci的变异系数最小,表明澳洲坚果种质资源间气孔导度差异是明显的,胞间CO2浓度在澳洲坚果种源间的差异较小。6个光合参数的重复力变动为77.11 %~84.52 %。表明澳洲坚果种质资源的光合生理参数主要由遗传因子控制,可作为澳洲坚果性状遗传多样性评价和地理变异研究的主要性状。这一结果与周祥斌[12]对香椿种源研究结果相似。
Pn是衡量植物光合能力大小的重要指标[13]。本研究中,Pn与Gs、Ci、Tr之间存在极显著的正相关,说明澳洲坚果叶片气孔关闭与否、细胞间隙CO2浓度高低、蒸腾速率高低直接影响澳洲坚果光合作用的顺利进行。这一结果与綦伟[14]对葡萄光合作用研究结果相似。WUE是耦合绿色植物蒸腾作用与光合作用的指标,可较好地反映绿色植物体协调水分耗散和碳同化的能力,且可评价植物对环境的适应能力[15]。本研究中,Yonik的WUE显著高于其余种源,说明其水分控制和适应能力较强,而Pn最高的种源HAES660具有较低的WUE,这可能是由于其Tr较高而出现光合能力与水分利用的权衡。这一结果与龙凤[16]对不同种源雷公藤光合特性研究结果相似。
4 结 论
澳洲坚果种质资源各个光合参数均存在显著差异,且不同澳洲坚果种质资源的净光合速率高低与气孔导度、胞间CO2浓度和蒸腾速率密切相关。35份澳洲坚果种质资源光合作用能力相对较高的是HAES660、HAES918和广11,光合能力最低是HAES900、HAES246和D,其它29份资源光合作用能力居中。

