心房颤动射频消融致肺静脉狭窄临床分析
陈 勇 肖 瑶 张 颖 高 杨 窦瑞雨 朱光发
射频消融术是治疗心房颤动的常用方法之一,主要的并发症有心脏填塞、肺静脉狭窄(pulmonary vein stenosis,PVS)、血栓栓塞、膈神经损伤、心房食管瘘等。随着对心脏电生理机制研究的深入和射频消融技术的成熟,手术相关并发症的发生在逐年减少,但少部分患者术后仍会出现如PVS等严重并发症[1]。PVS在术后第1周进展最快;其次是术后3个月内;术后6个月出现的迟发性PVS较少见[2-5]。该病早期症状常无特异性,多表现为咳嗽、咯血、胸痛及劳力性呼吸困难,常就诊于呼吸科,极易误诊、漏诊[3]。回顾性分析了首都医科大学附属北京安贞医院诊治的3例心房颤动射频消融致PVS患者的临床及影像学特点,并结合文献进行复习,以提高临床医生对该病的认识,争取早期诊断,及时治疗。
资料与方法
1.一般资料 病例1:患者男性,36岁,因“阵发心悸7年,咳嗽、活动后气短1个月”于2017年8月17日入住我院。7年前无诱因出现心悸、气短,未予特殊处理。3年前多次行心电图示心房颤动,分别于2014年8月15日、2015年2月13日和2015年12月2日于外院行射频消融治疗。1个月前爬1~2层楼即出现气短、乏力、咳嗽。入院查体:神清,口唇无发绀,双肺呼吸音清,右下肺可闻及少量湿啰音,叩诊心界不大,心率132次/min,心律绝对不齐,各瓣膜听诊区未闻及病理性杂音,双下肢不肿。辅助检查:血气分析:pH=7.411,PaCO2:30.5 mmHg(1 mmHg=0.133 kPa),PaO2:79.3 mmHg,SaO2:96.2%。血生化、血常规、尿常规、便常规正常。凝血五项、心肌酶、甲状脉功能五项、CRP正常。BNP:604.00 ng/L,较正常高。24 h动态心电图:心房颤动,心率最快193次/min,心率最慢67次/min,平均心室率109次/min。胸X线片:两肺纹理粗重,右膈角钝。超声心动图(图1):LVEF:54%,右心增大,左心房偏小,三尖瓣重度关闭不全,二尖瓣轻度反流,轻度肺动脉高压,SPAP 45 mmHg,左下肺静脉、右下肺静脉开口处狭窄。经食道超声心动图:左下肺静脉、右下肺静脉开口处狭窄,双房及心耳内未见确切血栓回声。肺动脉MRA增强成像(图2):右肺动脉远端分支稀疏,右肺静脉主干狭窄>90%,双侧胸腔积液,右侧著。PVS考虑为心房颤动射频消融所致,予以抗凝、控制心室率、利尿等治疗,于2017年8月22日行同步电复律治疗,恢复窦律,加用普罗帕酮150 mg 3次/d抗心律失常治疗。后患者于2017年11月行左下、右下肺静脉支架置入术。2018年03月14日于我院行肺静脉CT三维成像(图3):双下肺静脉支架置入术后,双上肺静脉入口狭窄。术后1年电话随访,患者自诉间断心悸,应用药物控制心房颤动,无咳嗽、气短、咯血、胸痛等不适,日常生活不受影响。
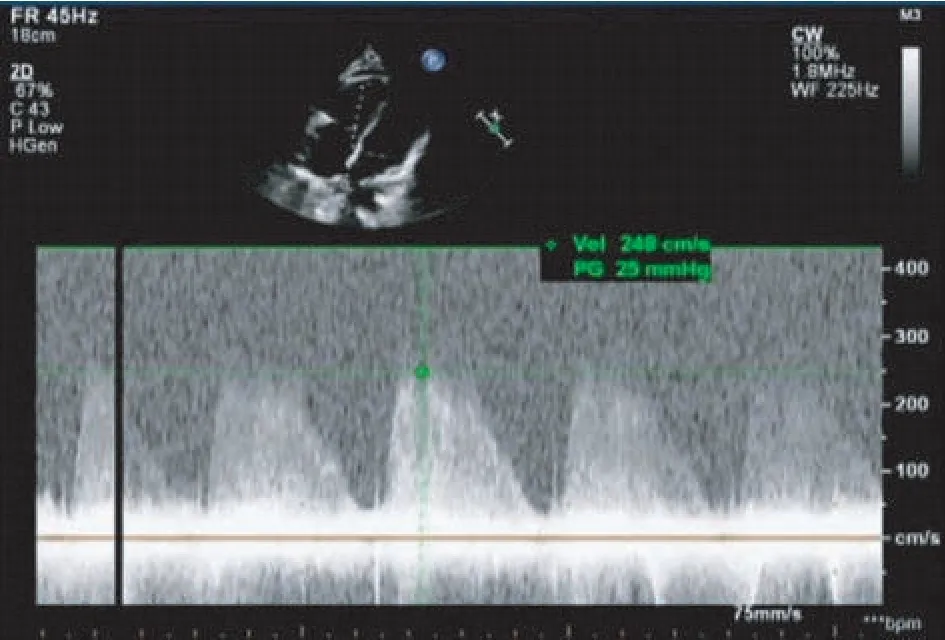
图1 超声心动图图像 右下肺静脉开口可见血流速度增快,最大流速约248 cm/s
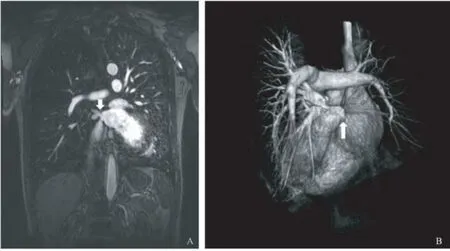
图2 肺动脉MRA增强成像:右肺动脉远端分支稀疏,右肺静脉主干狭窄>90%(见白箭头)
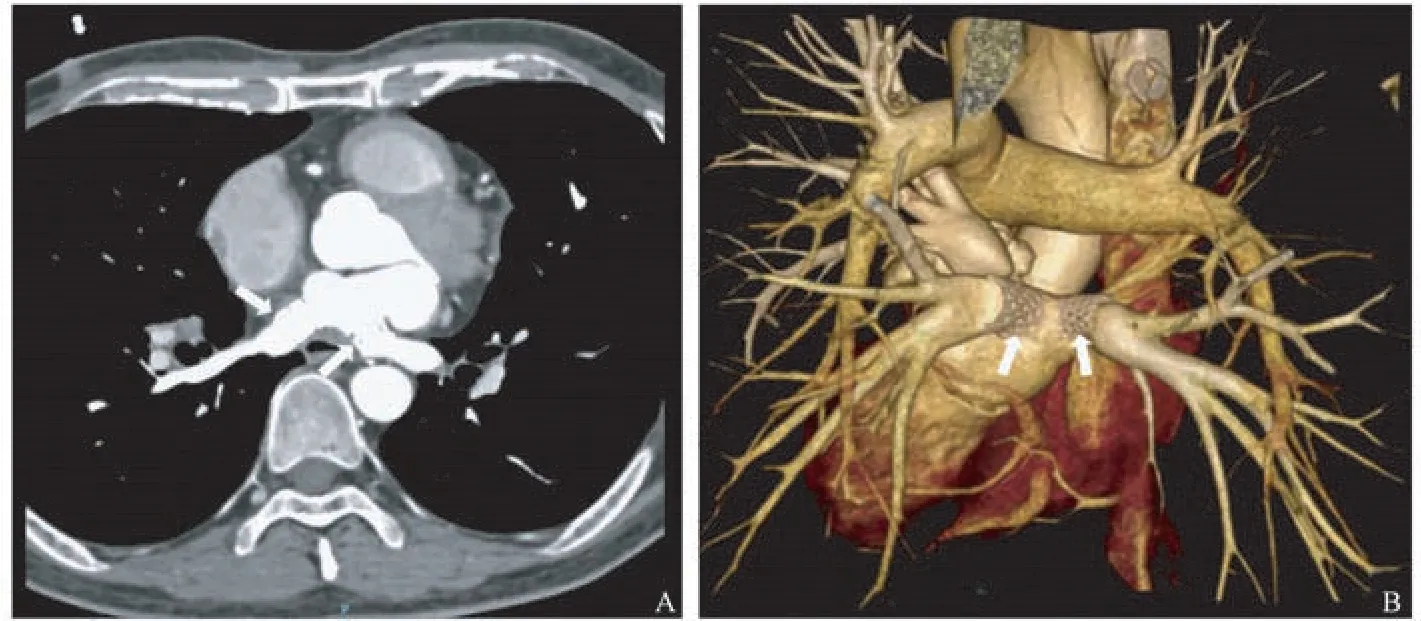
图3 肺静脉CTA图像 双下肺静脉支架植入术后(见白箭头)
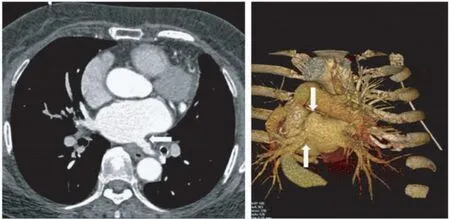
图4 肺静脉CTA图像 左下肺静脉开口处狭窄,左上肺静脉闭塞(见白箭头)
病例2:患者女性,63岁,因“间断心悸13年,伴胸闷、气短、咳嗽、咳痰3年”,于2018年5月23日入住我院。13年前劳累后发作心悸,于外院行心电图示:心房颤动,予以药物治疗(具体不详)后转复窦性心律。此后心悸间断发作,4年前曾于外院行射频消融术,术后给予阿司匹林抗血小板,未规律复查心电图。3年前无明显诱因出现反复咳嗽、咳白痰,伴活动后胸闷、气短。既往有高血压病5年,平素血压控制可。入院查体:神清,口唇无发绀,双肺呼吸音清,未闻及明显干湿啰音,叩诊心界不大,心率68次/min,律齐,各瓣膜听诊区未闻及病理性杂音,双下肢不肿。辅助检查:血气分析:pH=7.454,PaCO2:39 mmHg,PaO2:73.7 mmHg,SaO2:95.4%。血生化、血常规、尿常规、便常规正常。凝血五项、心肌酶、甲状腺功能五项、CRP正常。BNP:100.00 ng/L。床旁心电图:窦性心律,心率57次/min。胸X线片:两肺心膈未见异常。超声心动图:LVEF:64%,室间隔轻度增厚,二尖瓣轻度反流,三尖瓣轻度反流,左心室舒张功能减低。经食道超声心动图:双房及心耳内未见确切血栓回声。2018年5月25日,行肺静脉CTA(图4):左上肺静脉闭塞,左下肺静脉开口处狭窄,考虑外院射频消融术后并发症。患者及患者家属仍愿意尝试行射频消融术,于2018年5月27日,行心脏电生理检查及房颤射频消融术,术后恢复良好出院,院外予以抗凝等药物治疗。术后6个月电话随访,患者一般情况可,日常生活不受影响。
病例3:患者男性,49岁,因“咳嗽、咳痰伴痰中带血5个月”于2009年8月4日入住我院。5个月前,无诱因出现咳嗽、咳白痰,偶有痰中带血,自感乏力、胸闷,于外院行胸部CT平扫示:左肺渗出实变影伴胸腔积液。近2个月咳嗽、咳痰较前加重,伴持续性胸闷、胸痛,于外院抗感染及抗结核治疗3周,症状未见好转。既往:8个月前曾于我院因阵发性心房颤动行射频消融术。入院查体:神清,口唇无发绀,左肺呼吸音低,双肺未闻及明显干湿啰音,叩诊心界不大,心率70次/min,律齐,各瓣膜听诊区未闻及病理性杂音,双下肢不肿。辅助检查:血气分析、血常规、血生化、尿常规、便常规正常。凝血五项、甲状腺功能五项、CRP正常。胸水超声:左侧胸腔积液。胸X线片:左肺纹理紊乱,左肺野体积缩小,左肺野可见不规则片状模糊影,左侧胸腔中等量积液。肺动脉CTA:射频消融术后,左肺动脉主干显影良好,左上肺动脉分支—尖前支可见显影,较细小,左侧其各级肺动脉均未见造影剂充盈;左肺野多发大片不规则片絮状高密度影,左肺体积明显变小,左侧肺静脉各分支未见造影剂充盈。考虑PVS,予以抗感染、化痰等治疗,建议行左肺切除术,患者拒绝行手术治疗,要求保守治疗,后症状略好转后出院。术后9年电话随访,患者未诉特殊不适,自诉日常生活不受影响。
2.文献复习 以“心房颤动;肺静脉狭窄”或“Atrial fibrillation;Pulmonary vein stenosis”为检索词检索相关国内外的病例报告文献,包括PubMed数据库、万方数据库和中国知网,截止日期为2018年11月。
结果
共查到中文病例报告9篇,病例数13例;英文病例报告64篇,病例数66例。其中资料详细的个案报告共60例,男性50例(83.3%),女性10例(16.7%),年龄16~70岁,平均(48±12)岁。有10例(16.7%)曾行2次射频消融术,1例(1.7%)曾行3次射频消融术。患者发病时距射频消融手术平均时间为5(2~7)个月,其中4例(6.7%)为术后1周出现相关症状,15例(25.0%)为术后>6个月出现相关症状,最长者为第1次射频消融术后48个月出现相关症状。临床出现劳力性呼吸困难41例(68.3%),咯血39例(65.0%),咳嗽19例(31.7%),胸痛18例(30.0%),咳痰14例(23.3%)。其中4例(6.7%)患者无上述症状,因射频消融术后常规复查或需要再次行射频消融术发现。胸部影像发现渗出实变影47例(78.3%),磨玻璃影29例(48.3%),胸腔积液25例(41.7%),小叶间隔增厚16例(26.7%)。其中46例(76.7%)行CT肺血管造影发现PVS,41例(68.3%)行肺血管造影发现PVS,16例(26.7%)行超声心动图发现PVS,8例(13.3%)行MRA发现PVS。治疗上以介入治疗为主,其中25例(41.7)行支架置入治疗,6例(10.0%)行经皮肺静脉球囊扩张治疗,12例(20.0%)行外科手术治疗,17例(28.3%)接受药物保守治疗。文献中对36例(60.0%)患者进行了随访,最长随访时间为5年,随访中6例(24.0%)出现了支架内再狭窄。
讨论
随着射频消融术成为心房颤动重要的治疗手段,PVS作为其并发症之一,成为一种新的医源性疾病,越来越受到重视。早期射频消融的PVS发生率高至42.4%[6],近年来随着射频消融技术的成熟和手术经验的积累,PVS的发生率较前已下降至1.3%[7],但随之而来也导致了临床医生对其重视度下降及认识不足。射频消融的热损伤导致肺静脉血管壁瘢痕形成及肺静脉收缩被认为是射频消融所致PVS的机制之一[8]。这可能与不恰当的消融部位、射频能量过大、温度过高、消融时间过长、消融部位过深以及消融的肺静脉直径较小等因素有关[9]。PVS的病理表现为过度反应的胶原组织代替坏死的肌肉组织,以及炎症反应参与,最终出现管壁结构的重塑、内膜增生等[10],并引起肺静脉压增高、肺静脉血回心受阻,从而出现肺淤血,最终导致肺高压、右心室压力负荷增加,引发临床症状。
射频消融致PVS患者临床症状的轻重与PVS的数量、管腔狭窄的长度和程度以及病程长短密切相关。患者常因咳嗽、咳痰、咯血、胸痛及劳力性呼吸困难等症状到呼吸科门诊就诊,因其心脏结构和心电图无异常,既往的心脏射频消融术史易被忽视,加上胸部影像的表现,常被误诊为肺部感染、肺栓塞、肺结核等其他疾病[11],为进一步诊治增加了难度,延误治疗最佳时机。如本文病例1、病例2既往均有心脏射频消融术史,有咳嗽、劳力性呼吸困难等症状,但未引起重视,均因进一步诊治心房颤动而住院,完善术前检查而发现PVS。本文病例3因咳嗽、咳痰、咯血于外院就诊,胸部CT示左肺渗出实变影伴胸腔积液,初始诊治过程中未能考虑到心脏射频消融术后PVS这一少见并发症,而被误诊为肺部感染、肺结核,未能尽早明确诊断,延误诊治。
诊断PVS的方法有CT肺血管造影、MRA、超声心动图及肺通气/灌注扫描等无创性检查,金标准是肺静脉造影,但属于有创性检查,常不作为诊断的首选,若患者准备行介入治疗则可选用。CT肺血管造影结合三维成像技术不但可用于诊断肺动脉疾病,延迟扫描后还可以清楚显示各肺静脉,是评价和诊断PVS及其严重程度的重要无创性检查方法[12]。同样MRA结合三维成像技术可清楚显示PVS的部位及程度,是常用而准确的方法。超声心动图具有无创、经济、简便及重复性好的特点,是PVS诊断非常重要的检查手段。由于肺静脉距离超声探头较远,且透声偏差而不易显示清楚,因此对远离左心房开口部位的PVS受限[13-14]。肺通气/灌注扫描可记录PVS的血流分布特点,但只有狭窄>60%以上才表现为灌注下降,若狭窄<50%,则无灌注缺陷表现[15]。PVS常伴随着肺实质及间质的病变,包括肺淤血所致肺多发的斑片影、磨玻璃影,肺小静脉阻塞扩张及肺泡出血所致的肺小结节影,肺小叶间隔增厚以及慢性PVS时小静脉内膜增厚及纤维结缔组织增生所致间质纤维化。若心脏射频消融术后患者的胸部CT中出现上述影像改变时,也可作为PVS的间接证据[16]。本组3例患者通过CT肺血管造影、MRA、超声心动图等无创手段确诊PVS,其中1例患者胸部CT有PVS的间接证据。
目前PVS治疗目的在于恢复和保护患者肺功能,改善患者生活质量。对于无症状的轻中度PVS者,应持续抗凝,预防肺静脉内血栓形成及延缓PVS进展。对于有症状的重度PVS者应通过介入或手术方法缓解肺静脉机械梗阻,主要包括支架置入、经皮肺静脉球囊扩张及外科手术等。尽管介入治疗在短期内有显著疗效,但手术时可能出现出血、肺静脉撕裂、脑栓塞等严重并发症。同时支架置入后再狭窄率较高,后续可能需行二次甚至多次介入或手术治疗[17]。因此对射频消融术致PVS主要以预防为主,通过改进手术方式以及增加手术经验来减少PVS的发生。本组2例患者选择药物保守治疗,1例是因为症状较轻,另1例是患者拒绝行左肺切除术。还有1例患者选择了支架置入术。电话随访示3例患者一般状况可,日常生活不受影响。
综上所述,PVS是射频消融术后重要并发症,常首诊于呼吸科,易被误诊为肺部疾病。提高对射频消融术后PVS的认识是正确诊断的前提。对于既往有心脏射频消融史的患者,术后出现咳嗽、咳痰、咯血、胸痛及劳力性呼吸困难,胸部影像表现为渗出实变影、磨玻璃影、胸腔积液及小叶间隔增厚,正规抗感染治疗无效时应高度警惕本病可能,及时完善CT肺血管造影或肺静脉造影检查明确诊断。

