儿童马方综合征患者原纤维蛋白1基因突变与临床表型的相关性研究
孔 煜 李 扬 李玉琳 张晓平 郑 萍 温海初 杜 杰
马方综合征(Marfan syndrome,MFS)是严重遗传性结缔组织病,为常染色体显性遗传,发病率在1/3 000~5 000[1-2],MFS临床表现不一,主要累及眼睛、骨骼、心血管等器官组织。骨骼系统的主要表现包括身材高大,胸廓畸形,蜘蛛指,脊柱侧凸等;眼睛主要表现在高度近视和晶状体异位;心血管系统主要表现在主动脉根部的扩张以及伴随的主动脉瘤和主动脉夹层,其他还包括二尖瓣和三尖瓣的脱垂以及邻近肺动脉的扩张,是MFS患者就医和死亡的主要原因[3]。目前,MFS的诊断标准主要依据2010年发布的修订版Ghent标准[4]。
MFS主要由编码原纤维蛋白1的(fibrillin 1,FBN1)基因突变引起[5],FBN1基因位于人类第15号染色体,有65个外显子,迄今已经发现超过3 000种FBN1基因的突变[6],每个家庭的突变几乎都是独特的,突变方式包括无义、移码、剪接、插入/缺失以及错义突变[7],也包括整个基因和多个外显子的丢失[2]。
基因型和临床表型的复杂多变[8],对MFS的临床决策造成了极大的困难。目前,国人对MFS基因型和表型研究十分有限,基因型和表型的关联尚不清楚,本研究试图分析我院儿童MFS患者FBN1基因的突变谱,寻找FBN1基因新的致病位点,发现基因型与临床表型之间的关联,为国人中儿童MFS患者的临床诊疗提供理论基础。
资料与方法
1.研究对象 本研究纳入了2014年至2016年间,就诊于北京安贞医院的30例临床确诊或疑似MFS的儿童患者(年龄<18周岁),诊断标准依据2010修订版Ghent标准[4]。所有的儿童患者都经过专业医师的评估并且有详细的临床信息。本研究通过了北京安贞医院伦理委员会的审查,所有患者均签署了知情同意书。所有患者都是汉族人。
2.血液样本获取及DNA提取 取儿童MFS患者外周静脉血2 mL(EDTA抗凝),用QIAamp全血DNA提取试剂盒(QIAamp DNA Blood Mini Kit)提取基因组DNA。
3.Ion AmpliSeq NGS Panel目标测序 应用Ion AmpliSeq NGSPanel靶向目标测序技术(赛默飞),对FBN1基因目标区域进行NGS测序。针对FBN1基因用AmpliSeq Panel扩增目的片段,进行磁珠纯化、链霉素标记测序。将100 pmol文库与磁珠结合在油包水扩增后,链霉素标记目的基因,进行Ion PGM上机测序。
4.生物信息学分析 (1)原始数据的处理:①处理原始数据生成BAM文件(软件:Torrent Suite);②BAM文件分类、索引、再分类去除错误的SNP(软件:Genome Analysis Tool Kit、Samtools)。
(2)信息注释以及过滤筛选:1)信息注释包括:基因参考序列、染色体和cDNA位置、氨基酸变化以及相关公共数据库信息。(软件:ANNOVAR;数据库:SNP数据库(dbSNP142),千人基因组,外显子测序计划(ESP6500),人类外显子数据库(ExAC03),全基因组数据库(cg60),人类基因突变数据库(HGMD),以及众多的功能预测软件);2)过滤标准:①在千人基因组,外显子测序计划(ESP6500),人类外显子数据库(ExAC03)中最小等位基因频率(MAF)<0.1%;②破坏性突变包括:移码突变、插入或缺失、终止突变、剪接突变;③非同义突变:a.M-CAP score>0.025;b.REVEL score>0.5;c.6项标准中至少符合5项:SIFT<0.1,Polyphen2>0.9,CADD score>30,GERP>5,Mutation-Taster=“A”or“D”,and LRT=“D”。
(3)筛选结果分为两类:已知致病突变和疑似致病突变。
(4)计算患者主动脉根部Z评分:Z评分是一个用来标化数据的统计方法,计算公式是主动脉根径实测值与平均值的差值(单位为mm)再除以标准差,评分越高代表患者主动脉扩展程度越高。
5.Sanger sequencing验证 对筛选出的突变合成对应的DNA引物,用PCR法进行扩增,用ABI 3730xl测序仪(美 国Applied Biosystems公司)以Sanger测序法进行测序,测序结果与靶向目标测序的结果进行比对。
6.统计学分析 所有统计分析均使用SPSS软件完成。应用Shapiro-Wilk检验来确定数据是否符合正态分布。符合条件的分类变量以频数(率)表示,使用χ2检验或使用Fisher精确概率法。以P<0.05为差异有统计学意义。
结果
1.我们对30例儿童先证者进行了基因测序,发现27例儿童患者携带致病或者疑似致病的FBN1突变,其中错义突变19例,截短突变8例,剪接突变3例(表1)。
2.用主动脉Z评分对儿童MFS患者的主动脉直径量化结果 在主动脉Z评分≥3的患者中,大部分患者携带截短或者剪接突变(70.0%),小部分患者携带错义突变(30.0%),在主动脉Z评分<3的患者中,大部分患者携带错义突变(76.5%),小部分患者携带截短或者剪接突变(23.5%)。和主动脉Z评分<3的儿童患者相比,主动脉Z评分≥3的儿童患者有更多的患者携带截短或者剪接突变(70.0%vs.23.5%,P<0.05),差异有统计学意义,故携带截短或者剪接突变的儿童患者主动脉扩张的程度更高(表2)。
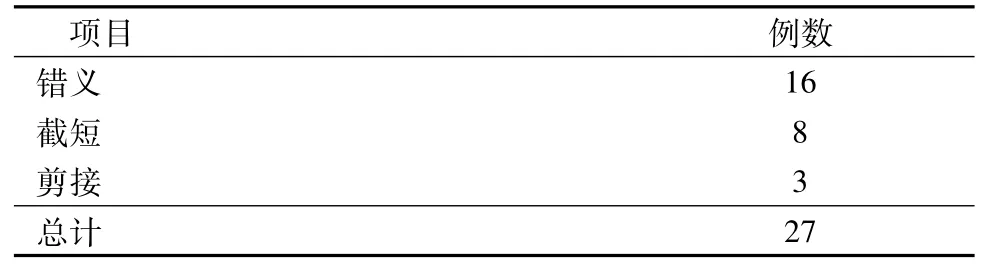
表1 27例患者FBN1基因突变类型测序结果

表2 27例患者的主动脉Z评分组间FBN1基因突变类型分布[n(%)]
3.FBN1基因中半胱氨酸相关基因突变与临床表型关系[9]本研究发现16例携带FBN1错义突变的患者中,按照突变是否和半胱氨酸相关将患者分为两个亚组,其中一组有8例携带半胱氨酸相关FBN1突变,另一组有8例携带非半胱氨酸相关FBN1突变,携带半胱氨酸相关突变的儿童患者有更容易出现晶状体异位的趋势(P=0.119,表3)。

表3 半胱氨酸相关FBN1基因突变与晶状体异位
讨论
自Dietz等[5]第一次发现FBN1基因突变导致MFS已经有20余年,FBN1基因编码的原纤维蛋白1是一种糖蛋白,广泛的分布在细胞外基质中,对弹性纤维的形成至关重要,FBN1基因的突变会引起原纤维蛋白1的异常,从而引起MFS的一系列表型。人们对这其中的发病机制进行了深入的研究。有研究认为,FBN1基因突变引起MFS的机制可以用单倍剂量不足和显性负效应两种机制来解释,单倍剂量不足指一个等位基因突变后,另一个等位基因能正常表达,但这只有正常水平50%的蛋白质不足以维持细胞正常的生理功能;显性负效应指某些蛋白突变后不仅自身无功能,还能抑制或阻断其他蛋白的作用[3]。近来也有研究发现,MFS和TGP-β信号通路的异常有关[10-12],在MFS患者中,FBN1基因的突变导致TGP-β配体的释放失控,上调经典和非经典TGP-β信号通路,从而导致TGP-β靶基因的过度表达,进而导致原纤维蛋白的异常,引发MFS的临床表型。
人们也对MFS基因型和临床表型的关联进行了大量的研究,但是只获得了为数不多的发现。有研究发现FBN1基因发生半胱氨酸替换与晶状体异位有关[9];携带截短或者剪接突变的MFS患者更易发生主动脉事件[13];FBN1单倍剂量不足突变的患者更多地出现了鸡胸、硬脑膜扩张、皮纹等表现[14],并且这些患者有更高的风险出现主动脉事件和心血管相关的死亡[15];FBN1基因第47号外显子跳跃突变的MFS患者更容易发生主动脉相关疾病[16];FBN1基因24-32号外显子的突变和新生儿MFS或者严重的MFS表型相关[17]。
本研究是中国人群中少有的有关儿童MFS患者的研究,我们发现在中国人群中携带截短或剪接突变的儿童MFS患者主动脉扩张的程度更高,相比之下携带错义突变的儿童MFS患者主动脉扩张程度较小,这一发现和Baudhuin等[13]的发现,在某种层面上是一致的,他们的结果提示携带截短或剪接突变的患者更易出现主动脉事件(主动脉瘤和主动脉夹层)。
本研究也存在局限性,首先,北京安贞医院是中国最大的MFS诊疗中心之一,这些儿童患者可能都有比较严重的表型;其次,患者人数相对较少,数据可能有所偏倚;再者,很多新报道的突变的判定都是基于生物信息学的分析和相关软件的预测,缺少对应的功能学实验;在以后的研究中,我们会做出相应的改进。
总之,主动脉相关的表型仍然是MFS患者最严重的临床表现,本研究发现携带截短或剪接突变的儿童MFS患者主动脉扩张的程度更高,这对儿童MFS患者的未来临床诊疗具有重要的意义。

