血清糖类抗原125在慢性阻塞性肺疾病合并慢性肺源性心脏病的临床意义
孙 茜 朱光发
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种具有气流受限特征的肺部疾病,气流受限不完全可逆,呈进行性发展。慢性肺源性心脏病是COPD常见的并发症之一,其存在增加了COPD患者的病死率。慢性阻塞性肺疾病引起慢性肺源性心脏病是由于肺循环阻力增加、肺动脉高压,进而引起右心室肥厚、扩大,甚至心力衰竭。病情一旦发展到失代偿期,表现危重,治愈较困难。因此早期诊断、治疗COPD合并慢性肺源性心脏病对改善COPD预后有着重要的临床意义。
目前有多种血清学指标用于辅助早期诊断COPD合并慢性肺源性心脏病,如BNP、内皮素-1、hs-CPR、IL-6及TNF-α等[1-4]。目前尚无特异性血清学指标用于早期诊断COPD合并慢性肺源性心脏病。血清糖类抗原CA125(cancer antigen125,CA125)是肺肿瘤标志物中的一个重要指标,不但广泛应用于呼吸系统疾病的诊断,而且在卵巢癌、胃肠道肿瘤、脑胶质瘤等疾病的诊断中具有重要价值[5],还可被用于慢性心力衰竭的鉴别诊断[6]。最新研究表明[7],CA125在继发肺动脉高压的COPD患者血清中显著升高,且与肺动脉收缩压(systolic pulmonary artery pressure,SPAP)呈正相关,提示血清CA125可被用于判断COPD患者是否合并肺动脉高压。COPD患者合并慢性肺源性心脏病时,血清CA125的表达水平迄今仍不清楚。通过对294例COPD合并慢性肺源性心脏病患者,和234例单纯COPD患者进行血清CAl25的检测,旨在探讨血清CA125在早期识别慢性阻塞性肺疾病合并慢性肺源性心脏病的临床应用价值。
资料与方法
1.临床资料 选择首都医科大学附属北京安贞医院呼吸与危重症医学科,2017年1月至2017年12月,收治的COPD患者。入院标准符合2018年GOLD指南制定的COPD诊断标准。排除恶性肿瘤、冠心病、左心功能不全、原发性肺动脉高压、肺栓塞、糖尿病、支气管哮喘、活动性肺结核、支气管扩张及肾功能不全的患者。所有患者均行详细的问诊、体格检查、超声心动图检查。根据1977年全国第二次肺心病专业会议修订的慢性肺性心脏病诊断标准[8],将入选患者分为以下两组:COPD合并慢性肺源性心脏病组(294例),年龄(70±8)岁,其中男性211例;单纯COPD组(234例),年龄(68±7)岁,其中男性158例。
2.研究方法 由有经验的超声医师进行超声心动图检查。于入院次日空腹抽取所有患者静脉血,分离血清,采用电化学发光法检测肺肿瘤标志物水平,癌胚抗原(carcinoembryonic antigen,CEA)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)、血清骨胶素(cytokeratin 19 fragment,CYFRA21-1)、糖类抗原(cancer antigen125,CA125)、胃泌素释放肽前体(pro-gastrin-releasing peptide precursor,ProGRP)。
3.统计学方法 采用统计软件SPSS 17.0进行数据处理及统计学分析。计量数据以均数±标准差表示,比较采用t检验;计数资料的比较采用卡方检验。以P<0.05为差异有统计学意义。
结果
1.临床资料分析 COPD合并慢性肺源性心脏病组、单纯COPD组的基本资料见表1。两组患者年龄、性别、BMI、吸烟指数在各组间,差异无统计学意义(P>0.05)。根据三尖瓣反流速度估算肺动脉收缩压(SPAP),结果显示COPD合并慢性肺源性心脏病组的SPAP为(54.1±11.4)mmHg(1 mmHg=0.133 kPa),单纯COPD组无肺动脉高压(SPAP<36 mmHg)。
表1 两组患者基本资料比较[,n(%)]
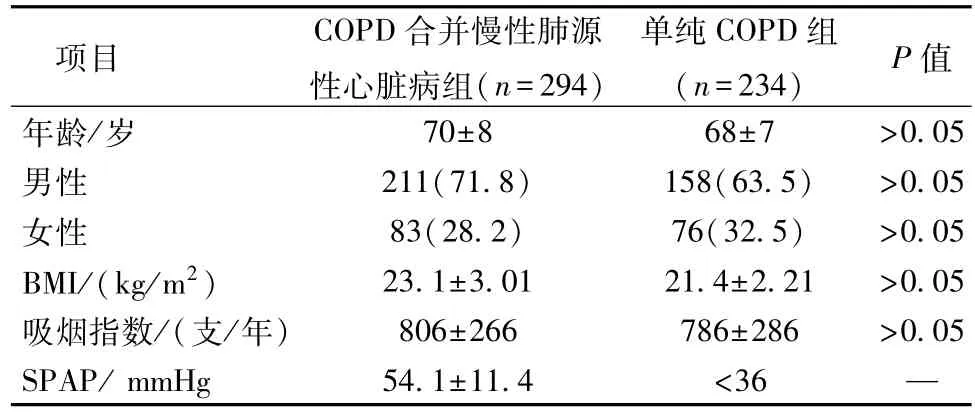
表1 两组患者基本资料比较[,n(%)]
项目 COPD合并慢性肺源性心脏病组(n=294)单纯COPD组(n=234) P值年龄/岁 70±8 68±7 >0.05男性 211(71.8) 158(63.5) >0.05女性 83(28.2) 76(32.5) >0.05 BMI/(kg/m2) 23.1±3.01 21.4±2.21 >0.05吸烟指数/(支/年) 806±266 786±286 >0.05 SPAP/mmHg 54.1±11.4 <36 —
2.血清肿瘤标志物检测 COPD合并慢性肺源性心脏病组患者血清CA125水平(53.4±8.86)U/mL较单纯COPD组患者血清CA125水平升高(27.7±6.78)U/mL(P<0.05,表2),且COPD合并慢性肺源性心脏病组患者血清CA125水平高于正常值(0~35)U/mL,单纯COPD组患者血清CA125水平在正常范围内。其它肺肿瘤标志物CEA、SCC、CYFRA21-1、ProGRP的血清水平在各组间比较,差异无统计学意义(P>0.05,表2)。
表2 两组患者血清肺肿瘤标志物检测结果()

表2 两组患者血清肺肿瘤标志物检测结果()
项目 COPD合并慢性肺源性心脏病组(n=294)单纯COPD组(n=234) P值CEA/(μg/L) 2.35±0.34 2.58±0.40 >0.05 SCC/(μg/L) 1.30±0.19 1.10±0.15 >0.05 CYFRA21-1/(μg/L) 2.88±0.23 3.07±0.30 >0.05 CA125/(U/mL) 53.40±8.86 27.70±6.78 <0.05 ProGRP/(ng/L) 50.30±5.89 46.43±4.88 >0.05
讨论
COPD是多种因素参与的气道慢性炎症性疾病,在患者体内存在持续性、低水平的系统性炎症,除肺部炎症反应外,全身炎症应答亦参与其发病过程[9]。在COPD病程中,多种炎症介质及缺氧可破坏肺部毛细血管,微血管床重构,甚至微血栓形成,增加了肺循环阻力,导致肺动脉高压,进而引起右心室肥厚、扩大,甚至心力衰竭。目前慢性肺源性心脏病的诊断主要根据慢性胸肺疾患病史,临床表现,胸X线、心电图及超声心动图等检查,具有肺动脉高压,右心增大或右心衰竭,且排除其他心脏病。虽然超声心动图可以协助诊断慢性肺源性心脏病,但由于超声医生的临床经验不足或三尖瓣反流不明显,部分早期慢性肺源性心脏病患者可能被漏诊。近年已有多种血清学指标被用于早期预测或诊断COPD患者中慢性肺源性心脏病的发生[10],但有关血清CA125在本病中作用的研究仍相对较少。
CA125发现于1981年。Bast等[11]用卵巢浆液性乳突状囊腺癌细胞系OVCA433免疫BALB/c小鼠,并与骨髓瘤杂交纯化得到一株单克隆抗体,将其命名为OC125,对应抗原命名为CAl25。CA125是一种不均一的黏蛋白样糖蛋白,主要在呼吸道、胃肠道、泌尿生殖道的上皮细胞表达[12]。在呼吸道中,CA125分布于杯状上皮细胞和黏膜下黏液细胞。当气道炎症发生时,会促使杯状细胞增生,黏液细胞分泌增加,从而促进黏蛋白的合成和分泌增加[13]。CA125合成并储存于细胞内,通常由于细胞间连接和基底膜的阻挡作用而无法入血,故健康人血清中浓度非常低。正常人的血清CA125平均水平≤35 U/mL,当超过正常水平两倍时,需进一步完善相关检查排除恶性肿瘤。血清CA125被认为是卵巢癌最重要的相关抗原,是目前最可靠的卵巢癌血清学诊断指标。1999年,Nagele等[14]研究发现,慢性心力衰竭患者血清CA125水平显著高于健康对照组,而其升高程度与心功能恶化的程度呈正相关。已有文献报道[15-16],血清CA125还可被用于心力衰竭的鉴别诊断。进一步研究发现[17],血清CA125与慢性心力衰竭的严重程度及液体潴留有关,但与射血分数、左心室内径无关;右心功能不全时,血清CA125与右心室腔扩大有关,但通过对肺动脉压力等多个变量校正后,发现升高的血清CA125仅仅与右心功能不全有关。以上研究提示,心腔压力增加可能是血清CA125表达水平上调的一个机制。
有研究指出,CAl25对慢性肺源性心脏病患者心功能不全有提示作用[17],心功能不全患者血清CAl25浓度的升高可能与心包、胸膜或其他间皮细胞受机械压力及炎症刺激有关[18]。目前已有部分研究探索血清CA125在COPD继发肺动脉高压中的作用[7,19]。研究显示[7],与单纯稳定期COPD患者相比,血清CA125在继发肺动脉高压的稳定期COPD患者血清中显著升高,且与SPAP呈正相关,提示血清CA125可用于识别稳定期COPD继发肺动脉高压。另有研究显示血清CA125水平与慢性肺源性心脏病患者的心功能有关,在一定程度上呈现正相关[20]。然而血清CA125水平是否能够用于诊断COPD引起的慢性肺源性心脏病,目前仍不清楚。本研究对可能影响血清CA125的因素(年龄、性别、BMI、吸烟指数)在两组患者进行匹配后,结果表明单纯COPD组患者的血清CA125在正常范围内,COPD合并慢性肺源性心脏病组患者升高。因此,血清CA125的升高可能可以用于早期识别COPD患者中慢性肺源性心脏病的发生。
综上所述,本研究发现血清CA125在COPD合并慢性肺源性心脏病患者血清中升高。提示早期、动态监测血清CA125水平变化,当血清CAl25的水平高于正常值时需要引起高度重视,以便能够及时发现和估测COPD患者慢性肺源性心脏病的发生,为早期诊断、治疗及预测和改善预后提供帮助。

