溢油污染物在栉孔扇贝不同组织的富集特异性及生物放大效应的初步研究
景玉婷,李志林,张传松,*,石晓勇,张海波
1. 中国海洋大学化学化工学院,青岛 266100 2. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100 3. 国家海洋局海洋减灾中心,北京 100194
石油是当今世界的主要能源之一,被称为当今社会的“黑色黄金”、“经济血液”。人类对于石油的需求不断增长使得海洋石油勘探及运输规模日益扩大,但随之出现的是溢油事故频发,对生态环境和海洋生物造成严重的破坏。溢油事故发生后,人们常使用消油剂(即溢油分散剂)来治理溢油污染。虽然大多数溢油消油剂本身的毒性比许多常用的化学制品小,但是仍然有一些消油剂本身比溢油对海洋生物的毒性更大[1-2],因此须谨慎使用。
同时该类污染物会通过食物链的传递进入人体,进而危及人类健康与安全。由于贝类地理分布广,生活方式固定,能够累积其生活环境中的石油烃(TPH),因此被许多国家和地区作为TPH污染监测的指示生物。目前海洋污染物在贝类体内的富集特征研究已有一些报道[3-5],而关于TPH污染物在贝类不同组织内的富集特征的研究则鲜有报道[6];此外,作为海洋生态系统中的初级生产力,海洋浮游植物处在食物链的最底层,相比其他海洋生物分布范围更广、数量更多,其受TPH等污染物的影响也最大,是TPH等污染物被海洋生物吸收和富集及在食物链传递过程中的第一层,因此在TPH污染物进入生物链的过程中起着关键作用。一旦浮游植物受到TPH的污染,TPH会通过食物链在海洋生物间进行传递并富集,也会对整个海洋生态系统的结构、稳定性和功能产生影响[7-9],同时海洋污染物在海洋食物链中的传递研究主要集中在重金属污染物[10-12],而关于TPH污染物在食物链中的传递还相对较少。
三角褐指藻(PhaeodactylumtricornutumBohlin)是海产养殖中的常用饵料,在甲壳类、双壳贝类的苗种生产中起着重要作用[13],并且对污染物有很高的累积能力,是海洋浮游生物毒性测试中常用的藻种;0#柴油是我国船舶应用最为广泛的油品。因此,本研究选择0#柴油为实验油品,选用GM-2型消油剂,栉孔扇贝(Chlamysfarreri)作为受试生物,分别从溢油污染物在栉孔扇贝体内不同软体组织的富集特征、柴油组分从三角褐指藻到扇贝体内的传递2个方面,研究了TPH污染物对海洋生物的影响,该研究结果可以为溢油污染物对海洋生物的危害性评估提供数据支撑。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
0#柴油(青岛市某加油站);溢油消油剂为GM-2型消油剂(青岛市某环保公司);实验培养海水采自青岛市沙子口附近海域,盐度为27~30,pH为7.9~8.5,过滤后采用荧光法测定柴油的背景浓度;实验所用容器为40 cm×40 cm×30 cm玻璃缸;日立荧光分光光度计F-4500(日本,岛津)。
1.2 实验生物
1)受试生物栉孔扇贝采自沙子口海水养殖场,实验前用干净海水冲洗除去其表面附着物,在实验条件下(温度21 ℃±2 ℃、pH=8.0±0.3、盐度29.0±1.0)驯养10 d,驯养期间连续通气,每天换水一次,换水前2小时投喂定量绿藻粉,驯养结束后选择健康且体长相近(6.0 cm±0.5 cm)的个体用于实验。
2)三角褐指藻取自中国海洋大学海洋污染生态化学重点实验室。藻种在室内光照培养箱内培养,培养条件为(22 ℃±2 ℃),人工海水盐度30.5,pH为8.1,光照强度3 500 Lux,光暗比为12 h:12 h。培养至指数期后重新接种到新的培养基中,依次循环培养3代,接种,备用。
1.3 0#柴油分散液和乳化液母液的制备与测定
柴油母液制备[14-15]:0#柴油与过滤后的海水以体积比为1:2的比例制备柴油分散液母液;按消油剂、柴油、海水以体积比为1:10:100的比例制备柴油乳化液母液。混合于三角瓶中,封口,置于磁力搅拌器上连续避光搅拌24 h。静置8 h后虹吸下层液体即为母液,经0.45 μm的醋酸纤维膜过滤后转移到棕色试剂瓶中,于4 ℃冷藏保存待用。
实验液制备:0#柴油分散液和乳化液母液在使用前,依照《海洋监测规范》(GB 17378.4—2007[16]和GB 17378.6—2007[17])中的荧光分光光度法测定海水和生物体中石油烃的浓度,并按照实验设计用海水稀释至所需要的浓度。
1.4 实验方法
1.4.1 柴油在扇贝体内不同组织的富集实验
实验设置4个实验浓度组和一个对照组,各个实验组浓度分别为0.05、0.1、0.3、1.0 mg·L-1,每个实验浓度组设置3个平行组,每个平行组均放入45只经过驯养的栉孔扇贝进行柴油富集实验。每天定时充氧2 h,每12 h更换全量海水并加入相应体积的柴油母液,使实验水体中TPH浓度保持相对稳定,每次换水前2小时喂养定量干净的绿藻粉。富集实验共进行8 d,分别在第0、1、2、3、5、8天的同一时间在实验组和对照组的培养箱内同时随机取出3只扇贝,其中1只扇贝解剖出整个软体组织后用焙烧过的锡纸包好,装于封口袋中,用于测定扇贝整体的TPH浓度,另外2只扇贝解剖出外鳃、内脏团、肌肉,用滤纸吸收其表面水分至不再自然流下,称量湿重,用焙烧过的锡纸将软体组织包好,装于封口袋中,-20 ℃冷冻保存,用于测定不同软组织中的TPH浓度。将样品经冷冻干燥研磨后用超声波提取-荧光分光光度法分析[18]。分别测定每个浓度组的3个平行组TPH浓度,并取平均值。
生物对污染物的蓄积能力通常用生物富集系数即BCF(Bioconcentration factors)表示,BCF值越大,生物对该污染物的蓄积能力越强,BCF按下式计算:
(1)
式中:Ca和Cw分别表示栉孔扇贝体内和水体中TPH的含量(mg·kg-1)。
1.4.2 TPH在海水-三角褐指藻-栉孔扇贝食物链中的传递实验
1.4.2.1 三角褐指藻富集海水中的TPH
在2 L锥形瓶中加入相应体积的柴油母液和驯养的三角褐指藻,用人工海水稀释到2 L,使水体中TPH浓度分别为0、1.0 mg·L-1和2.0 mg·L-1,藻密度约为1×104cell·mL-1。每组各设置一个空白对照,只加入柴油母液,不加藻。将锥形瓶置于光照培养箱中恒温培养,条件为(22±2) ℃、3 500 Lux照度和12 h:12 h的明暗周期,连续培养7 d,每天取少量藻液计算藻密度,并取20 mL藻液过滤洗涤后测定其TPH浓度。7 d后将各瓶藻液分别离心,藻沉淀用少许上清液洗涤后再次离心,每次使用时取适量藻沉淀稀释到100 mL后计数。
1.4.2.2 栉孔扇贝富集三角褐指藻中的TPH
实验在30 cm×25 cm×30 cm的玻璃鱼缸中进行,设置2个实验浓度组和1个对照组,每组各设3个平行,实验水体为20 L,每个鱼缸中放入15只驯养过的扇贝,分别取适量用1.0 mg·L-1和2.0 mg·L-1的柴油培养过的褐指藻沉淀稀释到100 mL,计数后分别添加到2个实验组,使各实验组鱼缸中藻密度均为4×104cell·mL-1左右。实验进行8 d,每天更换全量海水并同一时间投喂等量的褐指藻。每天各鱼缸分别取一只扇贝样品,按1.3所述方法测定扇贝体内TPH浓度。
1.5 数据处理
在柴油由水体向三角褐指藻体内传递实验中,采用“水相差法”[19-20]间接测定藻体内的污染物浓度。计算公式如下:
(2)
式中:Cw(c)为对照组水体中污染物的浓度(mg·L-1),Cw(s)为实验组水体中污染物浓度(mg·L-1),Bt(cell·L-1)为t时刻水体中的生物量密度(以C计),CA(mg·cell-1)为藻体内的TPH污染物浓度(生物量以C计)。
2 结果(Results)
2.1 柴油在栉孔扇贝体内不同组织的富集
2.1.1 扇贝不同组织中TPH浓度随时间的变化特征
各浓度序列实验组中扇贝不同组织内TPH浓度随时间变化的特征基本一致。下文以最大浓度组(1.0 mg·L-1)为例,讨论在柴油分散液和柴油乳化液中扇贝不同组织内TPH浓度随培养时间的蓄积变化情况(图1)。在富集8 d条件下,随着时间的推移,扇贝不同组织对柴油分散液和柴油乳化液中的TPH组分整体上均呈现持续富集的趋势,且各时期富集量大小均表现为鳃>内脏团>肌肉。具体来说:在柴油分散液中,鳃内TPH浓度迅速上升而后趋势逐渐减缓。鳃组织最先接触散布在水体中的污染物,颗粒较大的分散油滴经过鳃时被滤掉,从而导致鳃富集柴油速度较快,且污染物浓度最大。内脏团中含有消化腺,其中含有重要的解毒器官肝脏,进入肝脏的少量柴油被消化腺分解后随代谢排出,因此在实验前期内脏的TPH浓度很低,而随着暴露时间的增加,消化腺机能受到相应的影响,对柴油的代谢效率降低,肌肉和内脏团由此受到影响[21],因此暴露实验中后期内脏和肌肉内的TPH浓度增幅变大。类似鳃,整贝的TPH浓度也呈现前期平均富集速度高于后期的趋势,但整贝的TPH浓度要远远小于鳃。到第8天富集实验结束时,鳃内的TPH浓度远大于内脏团、肌肉和整贝的TPH浓度。在柴油乳化液中,鳃和内脏团内的TPH浓度,同样均出现前期平均富集速度高于后期的趋势,在实验的前5天,鳃内的TPH浓度大于内脏团,但相差不大。从第5天开始,鳃内TPH浓度略小于内脏团的TPH浓度,依然相差不大。同样肌肉内TPH浓度上升幅度先增大后逐渐减小。类似内脏团,整贝的TPH浓度也呈现前期平均富集速度高于后期的趋势。到第8天富集实验结束时,鳃、内脏团和整贝的TPH浓度要远大于肌肉内的浓度。
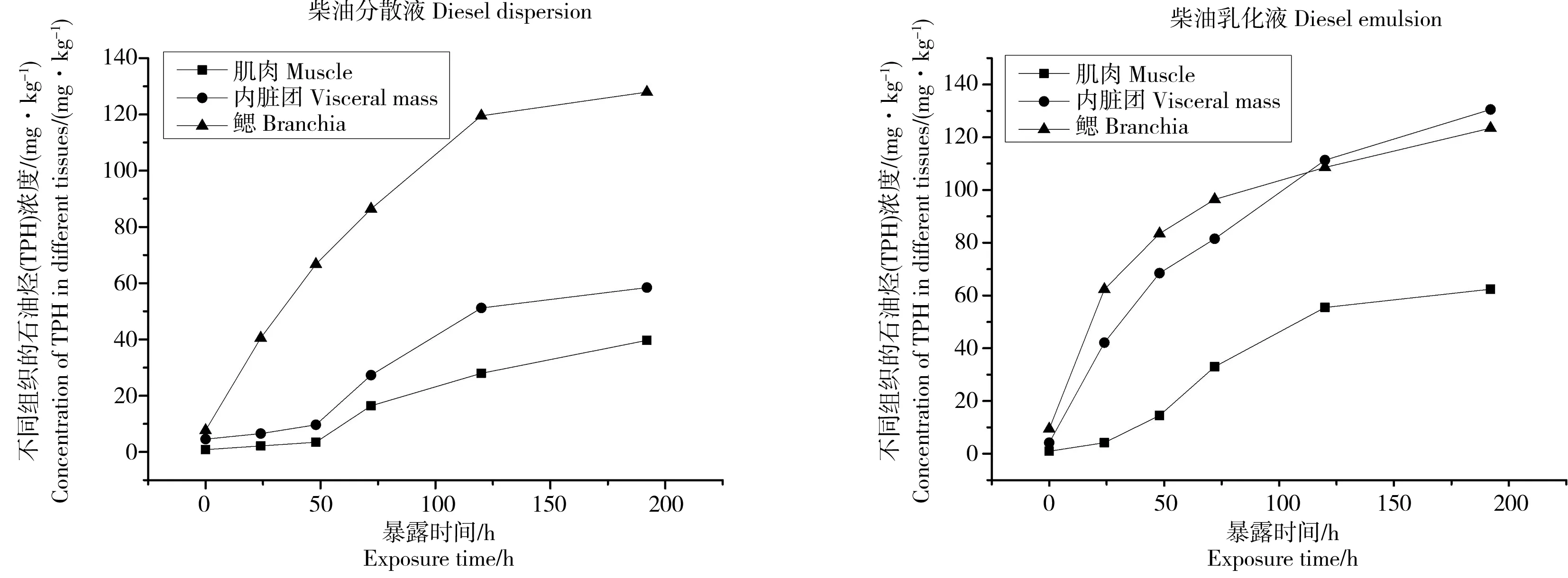
图1 1.0 mg·L-1实验组扇贝不同组织内总石油烃(TPH)浓度随时间变化Fig. 1 Variations of total petroleum hydrocarbon (TPH) concentrations in different tissues of Chlamys farreri (1.0 mg·L-1 treatment) over time
添加消油剂后油滴颗粒变得更加细小均匀,更容易通过鳃的选择后进入扇贝消化腺,这样导致了平行组之间更加一致的吸收和释放[21]。因此相同浓度条件下,添加消油剂的实验组样品浓度测定值与平行组测定值更加一致,同时过量的柴油无法被消化腺及时代谢,从而导致内脏团和肌肉内的TPH浓度增幅较大。因此在使用溢油消油剂时不应只考虑消油剂本身对海洋生态系统的影响,更应该考虑消油剂与溢油作用后的综合影响,特别是对海洋生物的毒性,有必要在充分考虑溢油消油剂优点和毒性的基础上建立溢油事故中消油剂的使用规范。
由《海水水质标准》可知,第一类海水水质要求TPH的浓度为0.05 mg·L-1以下,由《海洋生物质量》[22]标准可知,第一类海洋贝类体内TPH浓度要求小于等于15 mg·kg-1(湿重)。当扇贝处于TPH浓度大于0.05 mg·L-1的水体中超过3 d时,扇贝体内的TPH浓度便超过15 mg·kg-1,即超过第一类贝类质量标准,而当水体中TPH浓度小于0.05 mg·L-1时,扇贝体内的TPH浓度始终小于15 mg·kg-1。因此建议扇贝养殖者不要在超一类海水的区域进行水产品的养殖。同时随着经济的快速发展与人为活动的加剧,海洋石油泄漏问题更加需要引起有关职能部门的重视。
2.1.2 扇贝不同组织对柴油富集程度的比较
从图1、图2可以看出,扇贝不同组织内TPH含量与富集时间及水环境中的TPH浓度呈正相关,表明栉孔扇贝对TPH具有较强的富集能力。栉孔扇贝各软组织在柴油分散液(a)和柴油乳化液(b)中富集阶段结束(第8天)时的TPH浓度如图2所示,在不同浓度的柴油溶液中,栉孔扇贝的肌肉、鳃、内脏团对柴油均有一定的富集作用,各组织中的TPH浓度均随环境中TPH浓度的增大而增大,且均为肌肉内浓度最低。在柴油分散液中,各个浓度条件下不同组织的富集量均为鳃(44.47~127.92 mg·kg-1)>内脏团(14.69~58.46 mg·kg-1)>肌肉(7.38~39.68 mg·kg-1),鳃的TPH浓度远大于内脏团和肌肉中的浓度,且整贝的浓度也随着柴油暴露浓度的增大而增大。而在柴油乳化液中的扇贝表现出一定的差异,在较低浓度下(0.05~0.3 mg·L-1),不同组织对柴油的富集量同样有鳃>内脏团>肌肉,当水体中TPH浓度为0.05 mg·L-1时,内脏团和肌肉的TPH浓度相近且远小于鳃的浓度,而随着水体中TPH浓度的增大,肌肉的TPH浓度缓慢增加,内脏团中TPH浓度迅速增大,而当环境中TPH浓度达到1.0 mg·L-1时,内脏团的TPH浓度甚至超过了鳃的TPH浓度。说明在柴油添加消油剂后,TPH更容易经过鳃向内脏团传递,并且内脏团不能迅速地代谢所吸收的柴油,从而引起了肌肉组织内TPH浓度的增大。两组实验结果都显示肌肉组织内TPH的富集量最小,且因此从饮食安全和产品开发角度上讲,食用扇贝柱要比食用其他部位或整个扇贝肉安全得多。
扇贝不同组织在不同浓度的柴油分散液和柴油乳化液中对柴油组分的生物富集系数BCF(表1)大多表现为鳃(889.40~127.92 mL·g-1、830.80~123.43 mL·g-1)>内脏团(293.80~58.46 mL·g-1、184.00~130.53 mL·g-1)>肌肉(147.60~39.68 mL·g-1、149.80~62.40 mL·g-1)。就栉孔扇贝整体对石油烃的富集而言,各实验组扇贝在柴油乳化液中的BCF(404.6~91.75 mL·g-1)均大于同浓度的柴油分散液中的BCF(292.20~49.60 mL·g-1)。实验结果表明:在柴油乳化液中,栉孔扇贝对柴油有更高的富集能力,添加分散剂后增大了扇贝对柴油组分的吸收;扇贝在柴油分散液与柴油乳化液2种体系中的生物富集系数均随着水体中TPH浓度的增大而减小,说明水体中TPH浓度越大,扇贝对其富集程度越小。而对于栉孔扇贝不同组织的富集规律,将不同浓度组的栉孔扇贝各组织BCF值进行方差分析发现:在95%的置信水平下外套膜、内脏团和闭壳肌BCF值之间存在显著性差异(P<0.01),表明各组织对TPH的富集能力不同。
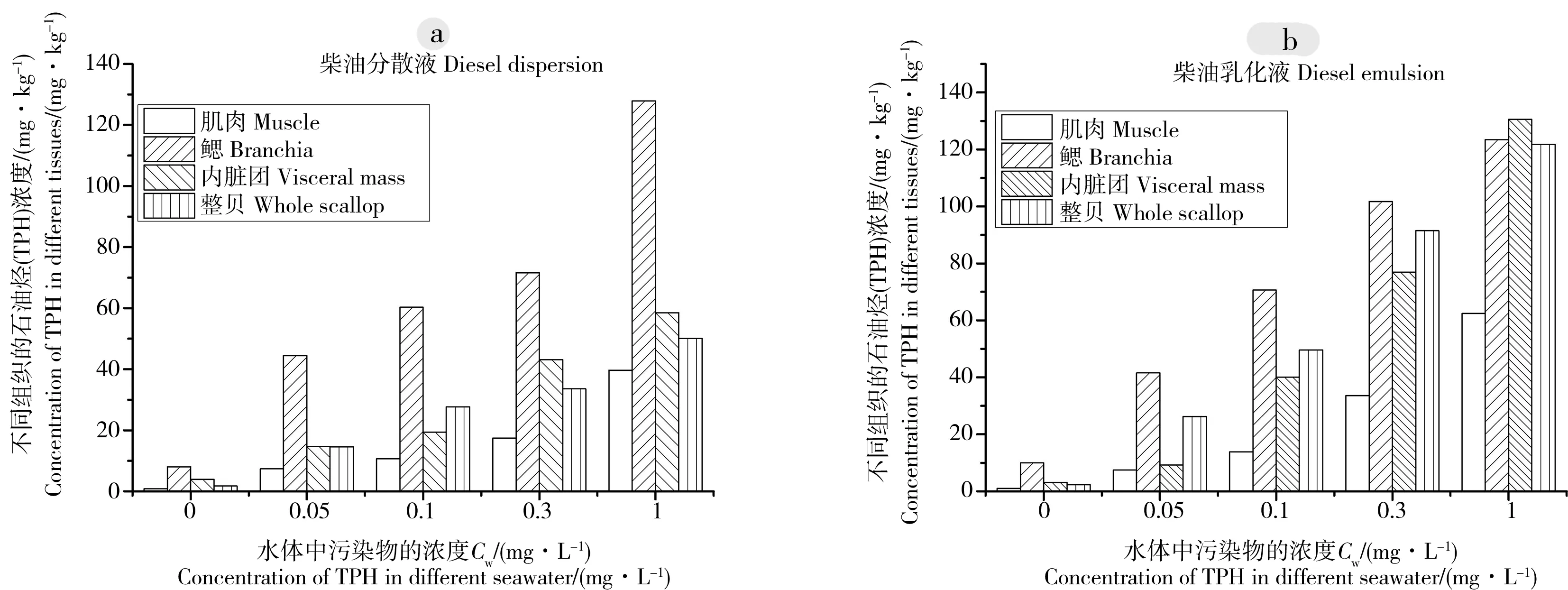
图2 扇贝在柴油分散液和柴油乳化液中暴露8 d后不同组织的TPH浓度Fig. 2 The concentrations of TPH in different tissues of Chlamys farreri after 8 d exposure
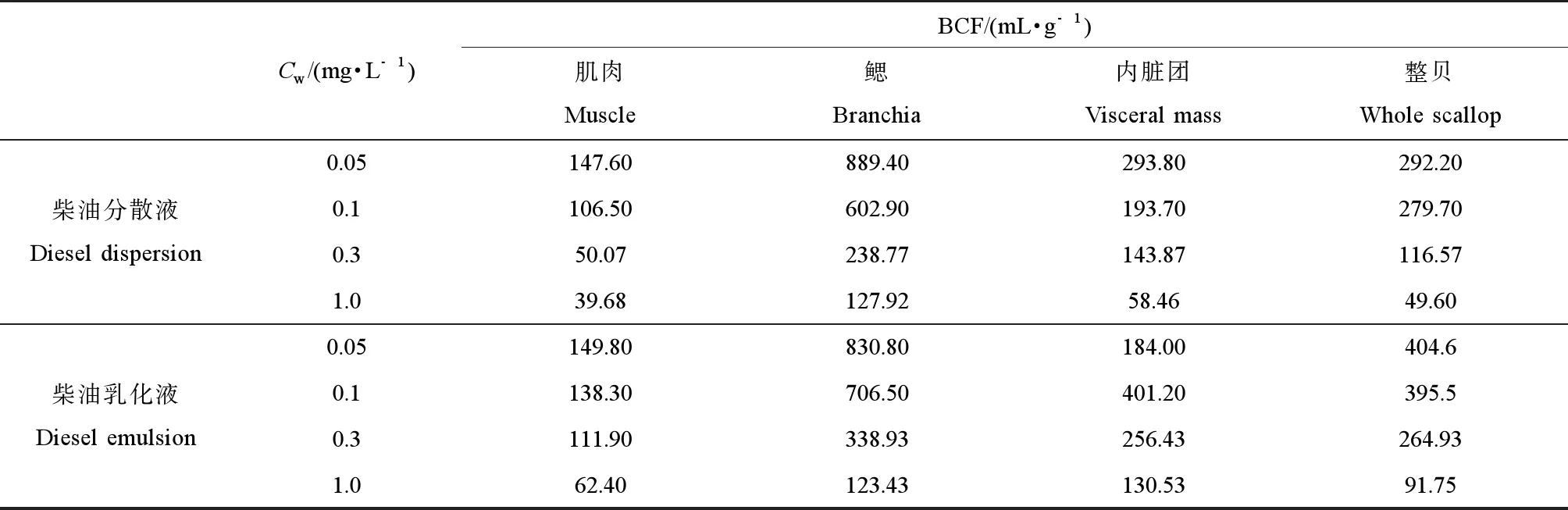
表1 扇贝在柴油分散液和柴油乳化液中的生物富集系数Table 1 The BCF values of Chlamys farreri in diesel dispersion and diesel emulsion
注:Cw表示水体中TPH的含量(mg·kg-1),BCF表示生物富集系数(mL·g-1)。
Note:Cwstands for the concentration of TPH in different seawater (mg·L-1); BCF stands for the bioaccumulation factors (mL·g-1).
大量研究比较了扇贝不同组织对TPH的富集特征。本研究与一些抗菌药物(如氨基脲和氟苯尼考等)在栉孔扇贝中的富集规律一致[5,23];赵美丽等[24]在扇贝不同组织对石油烃的富集实验中,同样发现:富集能力大小表现为鳃>消化腺>外套膜>肌肉;宫向红等[6]研究了海湾扇贝对柴油的富集和消除规律,累积量表现为内脏>外套膜及鳃等其他组织>闭壳肌,与本文的研究结果略有差异,主要是因为宫向红等没有单独检测体液,而是与外套膜、鳃等组织混合检测。出现这样情况的原因可能是由于内脏团中消化腺的代谢过程而使其蓄积能力最强,而位于扇贝中心的肌肉组织内污染物浓度含量始终在3个组织中最小,因此食用肌肉比食用其他组织更安全。
2.2 TPH在海水-三角褐指藻-栉孔扇贝食物链中的传递实验
2.2.1 三角褐指藻富集海水中的TPH
图3为各实验组三角褐指藻的生长曲线,图4分别为1.0 mg·L-1组(a)、2.0 mg·L-1组(b)水体中TPH浓度随时间的变化曲线。从图3可以看出藻密度在整体上随培养实验的进行而增加,具体表现为褐指藻在前2天处于适应期,藻密度基本不变,随后褐指藻开始进入指数生长期,细胞密度迅速增加,经过3~4 d的指数生长,藻细胞到达相对稳定的平台期。到第7天时,各实验组藻密度分别达到1.80×106cell·mL-1、2.13×106cell·mL-1、1.42×106cell·mL-1。说明在营养盐充足的环境中,高浓度的柴油会在一定程度上抑制三角褐指藻的生长,较低浓度的柴油在短期内反而会促进藻的生长。
水体中TPH浓度均随培养实验的进行而逐渐降低。具体特征表现为:1.0 mg·L-1实验组和对照组在实验的第1天TPH浓度均迅速降低,且降低幅度相近,由1.0 mg·L-1左右降低到约0.8 mg·L-1,从第2天开始对照组水体中TPH浓度只有微小的变化,而实验组TPH浓度大幅度降低。到培养结束时,对照组水体中TPH浓度降低到0.76 mg·L-1,实验组水体中TPH浓度降低到0.39 mg·L-1,根据“水相差法”的原理可认为由于藻的富集作用引起的水体中TPH浓度的变化为0.37 mg·L-1(扣除TPH挥发部分)。对比藻密度的变化曲线可知,三角褐指藻从第3天开始进入细胞指数生长期,因此三角褐指藻对柴油的吸收率急剧增加。同样,2.0 mg·L-1的实验组和对照组在培养的前2天TPH浓度也迅速下降,分别由最初的2.0 mg·L-1降低到约1.08 mg·L-1和1.73 mg·L-1。从第3天开始对照组水中的TPH浓度只有小幅度的变化,第4天时实验组水体中TPH浓度大幅度降低,因为此时藻细胞进入指数生长期。到培养结束时,对照组水中TPH浓度降低到1.08 mg·L-1,而实验组浓度降低到1.71 mg·L-1,由于藻的富集作用引起的水体中TPH浓度的变化约为0.63 mg·L-1。a、b实验组由于藻的富集作用引起的水体中TPH浓度的变化和单个藻细胞内TPH浓度如表2所示。因此,海洋浮游植物作为食物链的最底层,其受TPH等污染物的影响最大,在TPH等污染物被海洋生物所吸收和富集以及进入生物链的过程中起着关键作用。
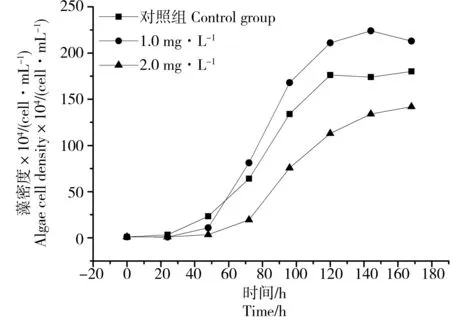
图3 各实验组三角褐指藻密度随时间的变化Fig. 3 Variations of density of Phaeodactylum tricornutum Bohlin over the exposure time
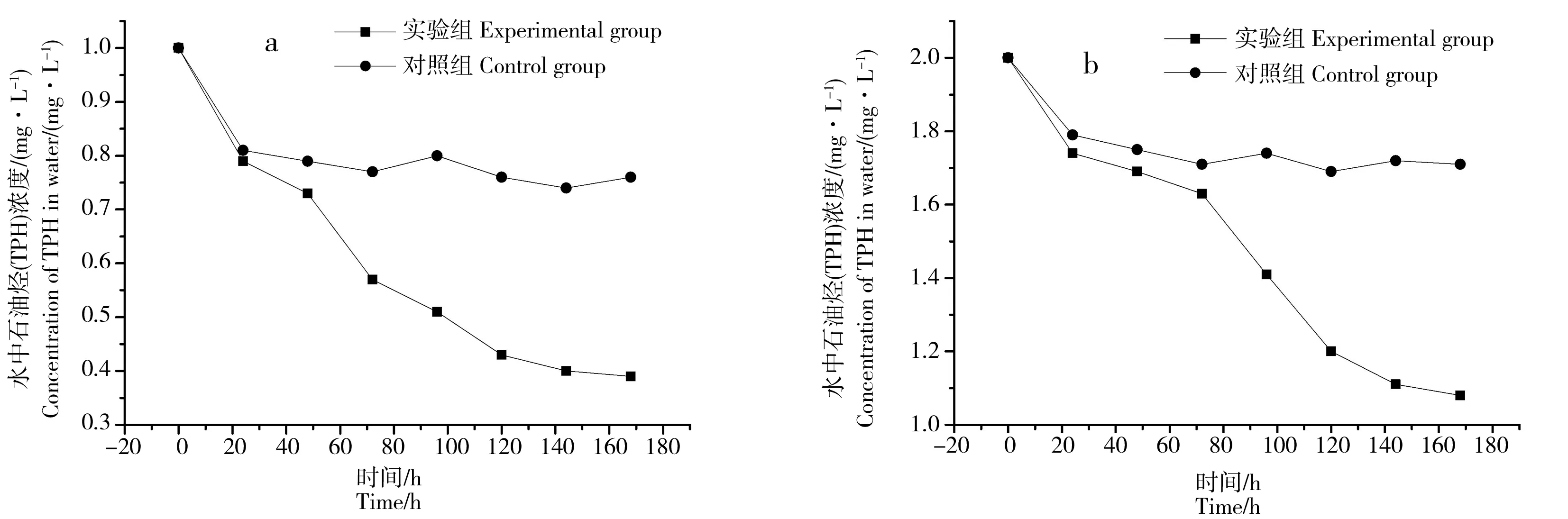
图4 水体中TPH浓度随时间的变化曲线Fig. 4 Variations of TPH in water over the exposure time
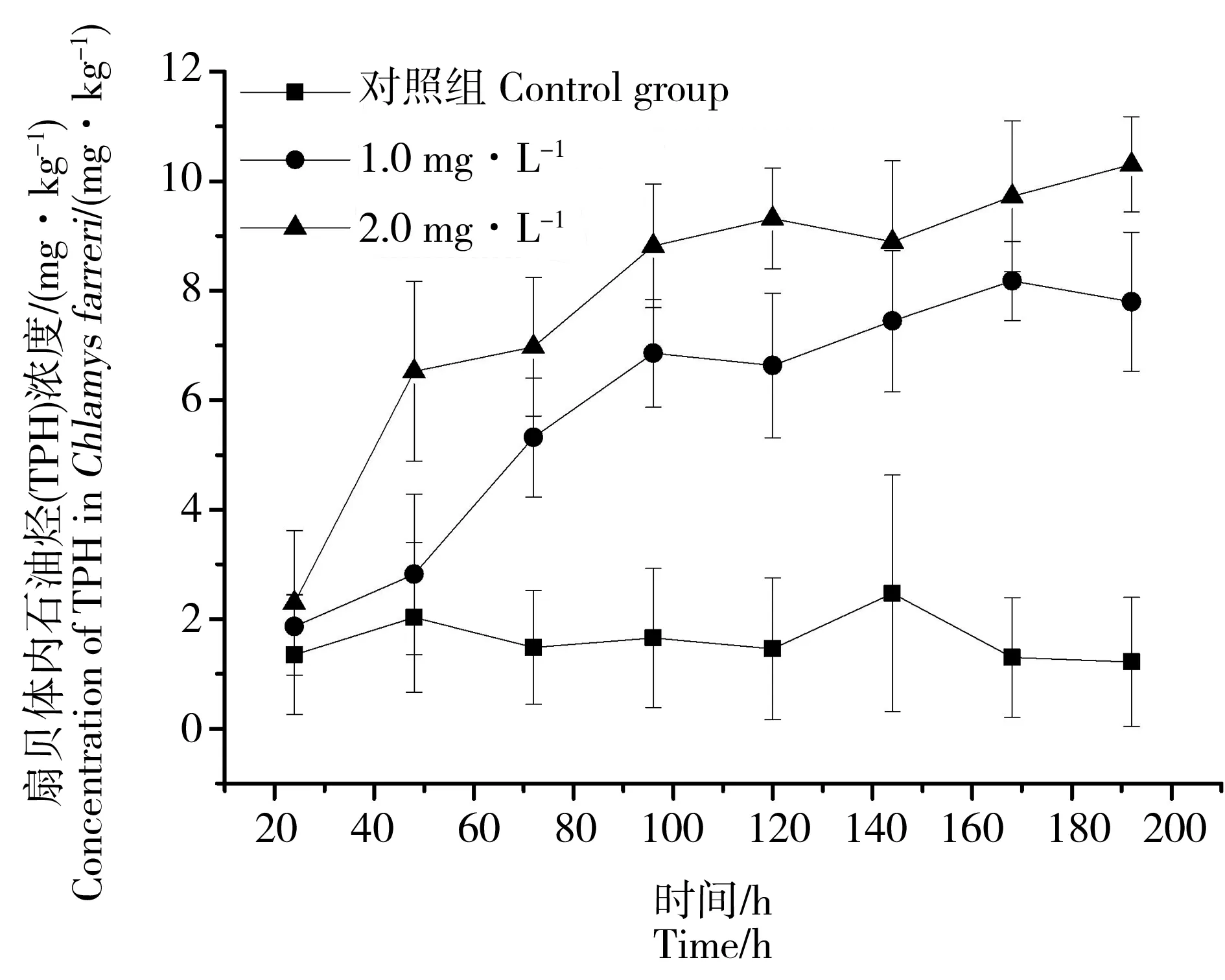
图5 投喂三角褐指藻后扇贝体内TPH浓度的变化Fig. 5 Variations of TPH in Chlamys farreri after fed with Phaeodactylum tricornutum
2.2.2 栉孔扇贝富集三角褐指藻中的TPH
图5为投喂柴油培养的三角褐指藻后的栉孔扇贝体内TPH浓度随时间的变化曲线,由图可知:对照组扇贝体内的TPH浓度在整个实验过程中变化不大,基本保持稳定,平均浓度为1.46 mg·kg-1。而投喂受柴油污染的三角褐指藻后扇贝体内的TPH浓度逐渐增大,到实验结束时扇贝体内TPH浓度分别从1.51 mg·kg-1增加到7.79 mg·kg-1和9.61 mg·kg-1,说明摄食行为是环境中TPH污染物进入扇贝体内的一种方式。具体而言:1.0 mg·L-1实验组扇贝体内TPH浓度在前2天增加缓慢,从第3天开始迅速增加随后速度逐渐放缓,到第8天实验结束时扇贝体内TPH浓度达到7.79 mg·kg-1左右。2.0 mg·L-1实验组扇贝体内TPH浓度在实验开始后便迅速增加,从第5天开始速度逐渐放缓,到第8天实验结束时,扇贝体内TPH浓度达到9.61 mg·kg-1。在扇贝培养实验过程中,2.0 mg·L-1实验组扇贝体内TPH浓度始终大于1.0 mg·L-1实验组,说明低营养级生物体内污染物浓度越大,则通过食物链向高营养级传递的量也越多。
本研究中2个实验组扇贝所喂的褐指藻体内TPH浓度分别为1.74×10-10mg·cell-1和4.44×10-10mg·cell-1,后者浓度约为前者的2.59倍,而扇贝毒性实验结束后2个实验组扇贝体内TPH浓度分别达到为7.79 mg·kg-1和9.61 mg·kg-1,后者约为前者的1.23倍,表明在扇贝摄食褐指藻的过程中,并不能将藻体内的柴油完全吸收到自身体内,因为污染化合物在生物体内的富集还与摄食过程、生物的同化作用、排出过程以及其他理化因子有关[25]。当水体中TPH浓度增大时,褐指藻(低营养级)内TPH浓度增大,扇贝(高营养级)对柴油的富集也增大,表明柴油污染物可以沿着海水-三角褐指藻-栉孔扇贝进行传递。

表2 三角褐指藻细胞内的TPH浓度Table 2 The concentration of TPH in Phaeodactylum tricornutum Bohlin

表3 藻体内和扇贝体内TPH浓度的关系Table 3 The relation of TPH concentration in Chlamys farreri and Phaeodactylum tricornutum
本实验结果与韦丽丽等[10]对三峡库区重金属的生物放大研究的结果一致。虽然在本实验条件下,扇贝通过三角褐指藻积累的柴油量始终未超过第一类生物质量标准值(15 mg·kg-1),但实验结果表明当低营养级即三角褐指藻内TPH浓度增大时,扇贝体内柴油的累积量也增大,因此对于扇贝养殖者来说,在育苗以及养殖过程中,要确保饵料中TPH浓度低于某些限定值,以免引起扇贝体内柴油富集量超过生物质量标准,该类浓度限定值有待进一步研究。
3 讨论(Discussion)
(1)经过富集实验,在不同浓度柴油分散液中,扇贝不同软组织对柴油的富集量大小均表现为鳃(44.47~127.92 mg·kg-1)>内脏团(14.69~58.46 mg·kg-1)>肌肉(7.38~39.68 mg·kg-1),在柴油乳化液较低浓度(0.05~0.3 mg·L-1)下也表现为此规律。结果表明,肌肉组织内TPH的富集量最小,因此从饮食安全和产品开发角度[53]上讲,食用扇贝柱要比食用其他部位或整个扇贝肉安全得多。
(2) 当摄食受柴油污染的三角褐指藻后扇贝体内对柴油产生了一定的累积,在实验结束时,扇贝体内柴油的累积量随藻体内TPH浓度的增大而增大,表明柴油污染物可以沿着海水-三角褐指藻-栉孔扇贝进行传递。同时,正是由于TPH污染物能够沿着食物链在营养级间进行传递,因此当溢油事故发生后需要及时消除溢油,防止石油污染物沿着食物链进行传递,并且由于溢油分散剂能够显著增加芳香烃等有生物毒性的物质的溶解度,因此在消除溢油时要规范合理使用分散剂,以减少TPH中有毒成分沿食物链到达人体的可能性。

