小鼠原代哺乳期乳腺细胞中TSH对钠碘同向转运体的调节作用
史新竹,申红梅
(1.沈阳医学院公共卫生学院流行病学教研室,辽宁沈阳110034;2.哈尔滨医科大学中国疾病预防控制中心地方病控制中心)
哺乳期妇女适宜的碘营养,是下一代在胎儿期和出生后早期脑发育的重要保障。哺乳期妇女碘营养不足,势必会给下一代带来因碘缺乏所致的各种危害。钠碘同向转运体(sodium iodide symporter,NIS)是甲状腺摄取碘的生理基础,介导碘转运至甲状腺滤泡细胞内合成甲状腺激素。NIS也是哺乳期乳腺重要的摄碘蛋白,但仅存在于妊娠期和哺乳期的乳腺中[1]。甲状腺NIS活性受到促甲状腺激素(TSH)、碘、雌激素等的影响。TSH主要调控甲状腺的功能和碘的摄取,是影响NIS表达和定位的主要因素,对NIS基因的表达起到促进作用[2]。目前公认的甲状腺NIS调控信号通路是环磷酸腺苷(cAMP)/蛋白激酶A(PKA),主要受到TSH调节,属于正向调节通路[3]。在一定程度上TSH的磷酸化模式依赖于PKA调节完成[4]。乳腺是对激素非常敏感的器官,内分泌功能改变和腺体疾病均能对其产生直接影响。本课题组前期观察不同碘水平下哺乳期乳腺摄碘调节因素时发现,哺乳期乳腺NIS水平的调节因素与甲状腺相似[5]。为探讨TSH对哺乳期乳腺NIS表达中发挥的作用,本研究在原代哺乳期乳腺细胞中观察了TSH对NIS表达的调节作用。
1 资料与方法
1.1 主要试剂 TSH(美国Sigma公司),实时荧光定量PCR试剂盒(大连宝生物工程有限公司),PKA抑制剂(H-89)(美国Cayman Chemical公司),促甲状腺激素受体(TSHR)抗体、NIS抗体(美国ABBIOTEC公司)、β-actin单克隆抗体(北京中杉金桥生物技术有限公司)。
1.2 仪器与设备 实时荧光定量PCR仪(美国Bio-Rad公司),Odyssey红外线成像系统(美国LI-COR公司),倒置相差显微镜(日本Olympus公司),凝胶电泳仪(美国Pharmacia Biotech公司),酶标仪(上海天呈科技有限公司)。
1.3 实验方法
1.3.1 培养原代哺乳期乳腺细胞 BALB/c小鼠(北京维通利华实验动物技术有限公司)喂饲普通饲料(北京科澳协力饲料有限公司),饮用蒸馏水。当雌性小鼠体重达到20 g时,挑选皮毛光滑无病雌性小鼠与成熟雄性小鼠按5∶1比例合笼交配。受孕后分笼观察其生产情况。
提取哺乳期BALB/c小鼠乳腺组织于DMEM/F12培养基中洗涤,制备组织匀浆。胶原酶消化后,置于37℃震荡孵育箱内消化15~20 min,120 r/min。研磨过滤未消化完全的组织,加DMEM/F12培养基于滤液中终止消化,制成细胞悬液。调整细胞密度,置于培养瓶中,5%CO2、37℃培养箱中,培养72 h。待细胞贴壁生长并铺满瓶底90%后传代。
1.3.2 实验分组 第二代细胞分组干预。将TSH用去离子水稀释配制成不同剂量。TSH不同剂量组:分别用不同剂量 TSH(0、0.01、0.03、0.05 μg/ml)干预细胞 24 h;沉默分组:50 nmol/L TSHR siRNA组、阴性对照组和平行空白组;PKA抑制组:H-89抑制PKA 30 min后加入0.03 μg/ml TSH干预24 h,同步设置0.03 μg/ml TSH干预组和空白组。
1.3.3 实时荧光定量PCR法检测原代哺乳期乳腺细胞NIS mRNA的表达 无血清DMEM/F12培养基培养细胞24 h,PBS洗涤6孔板中细胞3次,预冷Trizol裂解细胞3 min;三氯甲烷分离裂解细胞,移液器吸取中间清亮水相部分,加入与吸取液体等量异丙醇,混匀,室温静置10 min,4℃ 12 000 r/min离心10 min,留取沉淀;预冷75%乙醇洗涤RNA并测定RNA浓度;配制逆转录反应体系,在PCR梯度仪合成cDNA,实时荧光定量PCR仪实现扩增反应。
反应条件为95℃预变性30 s;95℃变性5 s;60℃(NIS)/58℃(β-actin)退火20 s,72℃延伸20 s,共40个循环;72℃终延伸10 min。引物见表1。

表1 PCR引物序列
1.3.4 Western blot法检测NIS蛋白的表达 细胞加入裂解液10 min,充分刮取蛋白,12 000 r/min离心20 min,收集上清蛋白,测蛋白浓度。电泳2 h,PVDF转膜50 min,封闭液封闭1 h。分别用兔抗鼠NIS单抗(1∶400)和单抗β-actin(1∶1 000),4℃过夜。DAB显色,GIS凝胶图像处理系统照相观察。Gelpro软件比较目的条带相对灰度值。
1.3.5 TSHR基因沉默 使用优化培养基培养细胞24 h,lipo2000用无血清的优化培养基稀释,孵育5 min后与siRNA混和,室温孵育20 min,形成siRNA-lipo2000混和物。将siRNA-lipo2000混合液加入细胞,混和。置于5%CO2、37℃培养箱,5 h后换成正常优化培养基培养72 h。
1.4 统计学方法 采用SPSS 20.0软件进行统计学分析。多个总体均数差异比较采用方差分析,两两比较采用t检验。检验水准为α=0.05。
2 结果
2.1 不同剂量的TSH对原代哺乳期乳腺细胞NIS mRNA和蛋白表达的影响 4组NIS mRNA的表达水平比较差异有统计学意义(F=6.51,P<0.05),0.05 μg/ml TSH组的NIS mRNA表达量最高。4组NIS蛋白表达水平比较差异无统计学意义(P>0.05)。见表2、图1。
表2 不同剂量TSH组NIS mRNA的表达水平比较(±s)

表2 不同剂量TSH组NIS mRNA的表达水平比较(±s)
注:与0.05 μg/ml TSH组比较,1)P<0.05
F P TSH(μg/ml)0.05 0.03 0.01 0 n5 5 5 5 NIS mRNA 2.09±0.89 1.22±0.261)0.86±0.271)0.96±0.061)6.510.00

图1 TSH不同剂量组NIS蛋白表达
2.2 TSHR siRNA沉默TSHR基因对NIS蛋白表达的影响 TSHR siRNA组、阴性对照组和空白组的NIS蛋白表达比较差异无统计学意义(P>0.05)。见图2。

图2 沉默TSHR基因后NIS蛋白的表达
2.3 抑制PKA对哺乳期乳腺细胞NIS蛋白表达的影响 PKA抑制组、TSH组和空白组的NIS蛋白表达水平比较差异有统计学意义(F=8.45,P<0.01),PKA抑制组NIS蛋白表达水平明显低于TSH组和空白组(P<0.05)。见表3和图3。
表3 抑制PKA后NIS蛋白表达(±s)
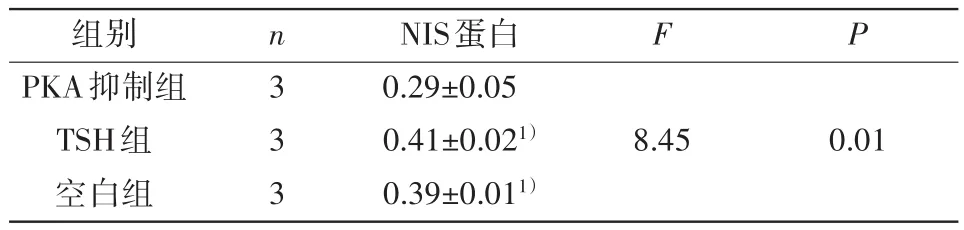
表3 抑制PKA后NIS蛋白表达(±s)
注:与PKA抑制组比较,1)P<0.05
组别PKA抑制组TSH组空白组n3 3 3 NIS蛋白0.29±0.05 0.41±0.021)0.39±0.011)F P 8.450.01

图3 抑制PKA后NIS蛋白的表达
3 讨论
NIS主要位于甲状腺细胞基底外侧膜上,介导碘的主动转运,生产足够的甲状腺激素。有研究证实NIS在多个组织中表达,但仅在甲状腺和哺乳期乳腺中处于高表达状态[6],这与哺乳期乳腺需碘量增大密切相关。
乳腺哺乳期摄碘量大幅增加,NIS在哺乳期乳腺细胞基底外侧膜表达,从血液中吸取碘化物到乳汁中,高效积累碘化物。甲状腺摄碘受到TSH严格调控,刺激NIS半衰期延长。本研究应用不同剂量TSH作用于哺乳期乳腺细胞,观察到高浓度TSH对哺乳期乳腺细胞NIS的表达有一定调节作用,低浓度TSH作用不明显。本研究还对与TSH结果的关键蛋白TSHR进行沉默,但未观察到细胞NIS水平的显著变化。TSHR属于G蛋白偶联受体,一旦与配体TSH结合,即起到连接细胞内外环境,向细胞内部传递TSH所携带信息的作用。有研究显示在哺乳期乳腺细胞中存在TSHR表达[7],提示乳腺中NIS很可能受到TSH影响。此次TSHR沉默后未观察到NIS水平变化,其原因可能是沉默过程中产生了RNA干扰的脱靶现象[8],当siRNA与靶位点序列完全互补配对时,复合体直接切割靶标mRNA,导致其被快速降解,其他可能原因需进一步探讨。
本研究抑制PKA活性后,抑制组NIS蛋白表达量显著低于正常对照组,提示PKA作为重要的蛋白激酶在哺乳期乳腺细胞NIS调节过程中,起到上调NIS表达的作用。PKA是一种普遍存在于动物体内的蛋白激酶,且蛋白酶抑制剂可与PKA催化亚基结合抑制PKA活性。甲状腺中TSH主要通过cAMP/PKA信号通路调控细胞增殖、分化及NIS表达,PKA刺激NUE(NIS上游增强子),改变NIS表达[1]。
综上所述,高浓度TSH对小鼠哺乳期乳腺细胞NIS表达具有一定调节作用;蛋白激酶PKA可上调NIS表达。

