动物药羊胆水质量标准研究*
刘春花,熊丹丹,潘 洁,刘绍欢,李勇军,王爱民,王永林,4△
(1.贵州医科大学民族药与中药开发应用教育部工程研究中心·省部共建药用植物功效与利用国家重点实验室,贵州贵阳 550004; 2.贵州医科大学·贵州省药物制剂重点实验室,贵州 贵阳 550004; 3.贵州医科大学药学院,贵州 贵阳 550004; 4.贵州医科大学·贵州省民族药与中药开发应用工程技术研究中心,贵州 贵阳550004)
胆汁作为一类重要动物药[1],除了熟知的熊胆、牛胆、蛇胆外,羊胆也是常用中药。羊胆首载于陶弘景《本草经集注》,《中药大辞典》记载羊胆来源于牛科山羊属动物山羊Capra hircus Linnaeus、绵羊属动物绵羊Ovis aries Linnaeus或山羚属动物青羊Naemorhedus goralHardwicke的胆汁[2]。《辽宁中药志(动物、矿物、海洋类)》[3]《贵州省中药材、民族药材质量标准》(2003年版)[4]中记载羊胆的来源是牛科动物山羊Capra hircusLinnaeus或绵羊OvisariesLinnaeus的胆汁。宰羊时,剖腹,割取胆囊,将胆管扎紧,悬通风处晾干,或取新鲜胆汁入药[2]。羊胆药性苦寒,归肝、胆经,具有清热解毒、明目退翳、止咳等功效[2,5],主治目赤肿痛、青盲夜盲、翳障、肺痨咳嗽、小儿热惊、咽喉肿痛、黄疸、痢疾、便秘、热毒疮疡等[2,4]。现代药理学研究表明,羊胆有明显的抗炎活性[5-7],治疗肺结核的疗效确切[8],具有良好的药用价值。山羊或绵羊的胆汁主要含胆汁酸盐、胆色素、黏蛋白、胆甾醇、卵磷脂、脂肪酸及碳酸氢钠等[2,9],动物胆汁中含量最高的物质主要为胆酸和脱氧胆酸[10]。
目前,关于羊胆的质量控制研究报道较少,《贵州省中药材、民族药材质量标准》(2003年版)[4]收录了羊胆水,《福建省中药材标准》(2006年版)[11]收录了羊胆膏,《宁夏中药材标准》(1993年版)[12]收录了牛、羊胆汁,对羊胆的质量控制项目较单一,均无含量测定项目,不能较好地控制羊胆的质量。本研究中采用薄层色谱(TLC)法、总固体含量测定和高效液相色谱(HPLC)法进行研究,同时分析多批羊胆水样品,为羊胆水的质量控制提供参考。现报道如下。
1 仪器与试药
1.1 仪器
REPROSTAR3型薄层数码成像系统(瑞士Camag公司);Ultimate 3000型高效液相色谱仪(赛默飞世尔科技<中国>有限公司);Prominence型高效液相色谱仪(日本岛津企业管理<中国>有限公司);EL204型电子天平(Mettler公司);EL-204型电子天平(万分之一,梅特勒-托利多仪器上海有限公司);超纯水机(四川沃特尔科技发展有限公司);KQ-300DE型超声波清洗器(昆山市仪器有限公司);DK-98-Ⅱ型电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 试药
羊胆粉对照药材(批号为121524-201202),胆酸对照品(批号为100078-201415),均购于中国食品药品检定研究院;冰醋酸、三氯甲烷、异丙醇、甲醇、硫酸、磷钼酸均为分析纯,乙腈为色谱纯,均购自国药集团化学试剂有限公司;硅胶G板(青岛海洋化工厂分厂,烟台黄海江友硅胶开发有限公司,青岛鼎康硅胶有限公司);羊胆水10批,分别编号为S1(贵阳花溪)、S2(贵州习水)、S3(贵州凤岗)、S4(贵州丹霞)、S5(贵州金沙)、S6(贵州习水)、S7(盘州板桥)、S8(贵州兴义)、S9(贵州龙里)、S10(贵州贵阳),均在采收地宰杀现场收集,均来源于山羊,宰杀前均由贵州医科大学中药标本馆龙庆德副教授鉴定。
2 方法与结果
2.1 羊胆水TLC鉴别
分别量取10批羊胆水样品各0.5 mL,置70℃水浴蒸干,残渣加甲醇10 mL,超声处理30 min,滤过,取续滤液,作为供试品溶液。取羊胆粉对照药材10 mg,加甲醇10 mL,超声处理30 min,滤过,取续滤液,作为对照药材溶液。照TLC法(2015年版《中国药典(四部)》通则0502)试验,分别吸取不同批次供试品溶液与对照品溶液各1μL,分别点于同一硅胶G板,以异丙醇-三氯甲烷-冰醋酸-甲醇(30∶20∶4∶4,V∶V∶V∶V)为展开剂,展开,取出,晾干,喷含3.5%磷钼酸的20%硫酸溶液,在105℃加热至斑点显色清晰,分别置日光和紫外光灯(365 nm)下检视。供试品溶液色谱中,在与对照药材溶液色谱相应位置上显相同颜色的斑点,详见图1。不同批次间可能各成分含量不同,因此对应斑点颜色深浅存在差异。
2.2 总固体含量测定
取新鲜羊胆水,摇匀,精密量取10 mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干,置105℃干燥3 h,置干燥器中冷却30 min,精密称定质量,计算供试品中新鲜胆汁干燥后所得质量,结果见表1。10批羊胆水总固体含量范围为0.046 1~0.076 0 g/mL,相差1.6倍。
2.3 羊胆水中胆酸含量测定
2.3.1 色谱条件与系统适用性试验
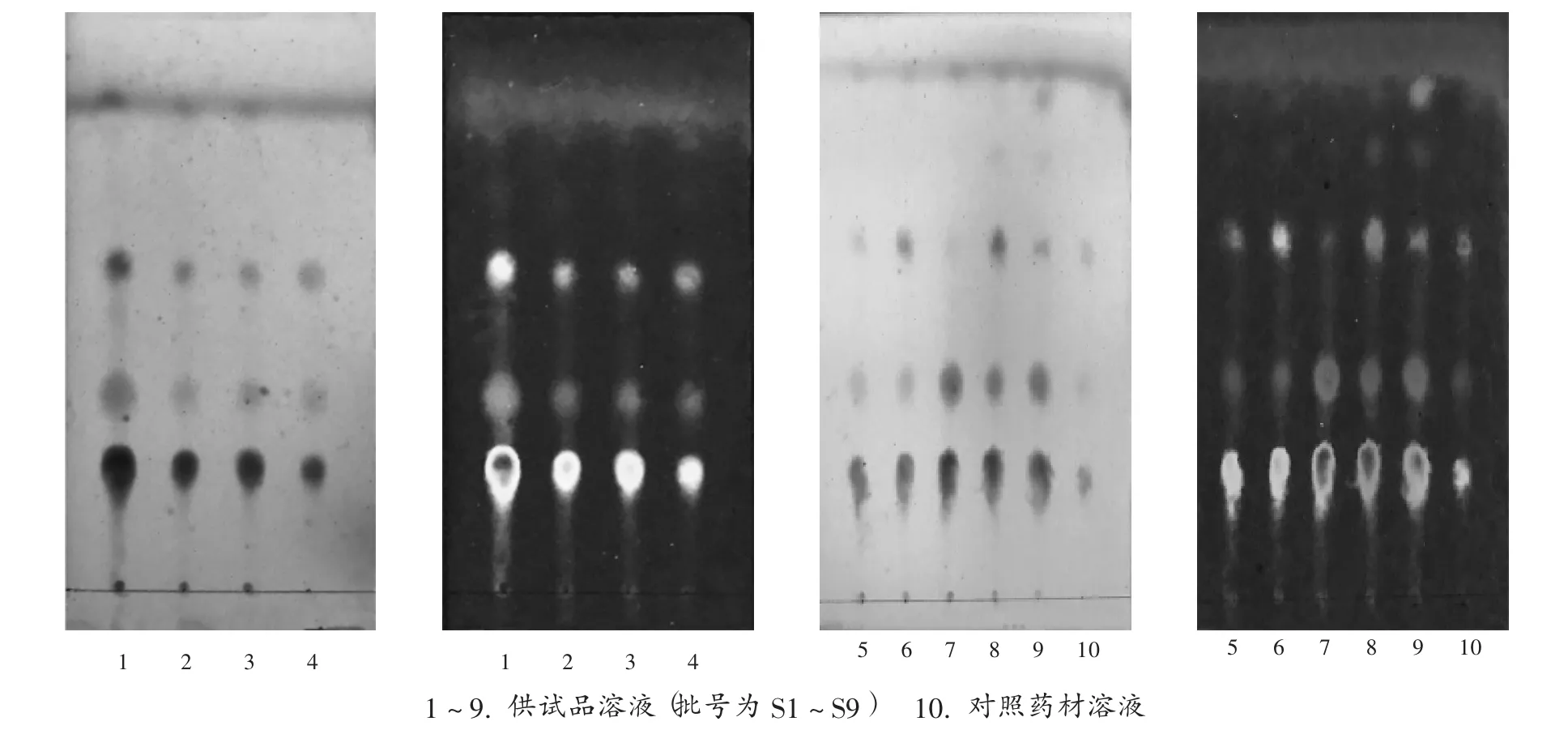
图1 羊胆水薄层色谱图
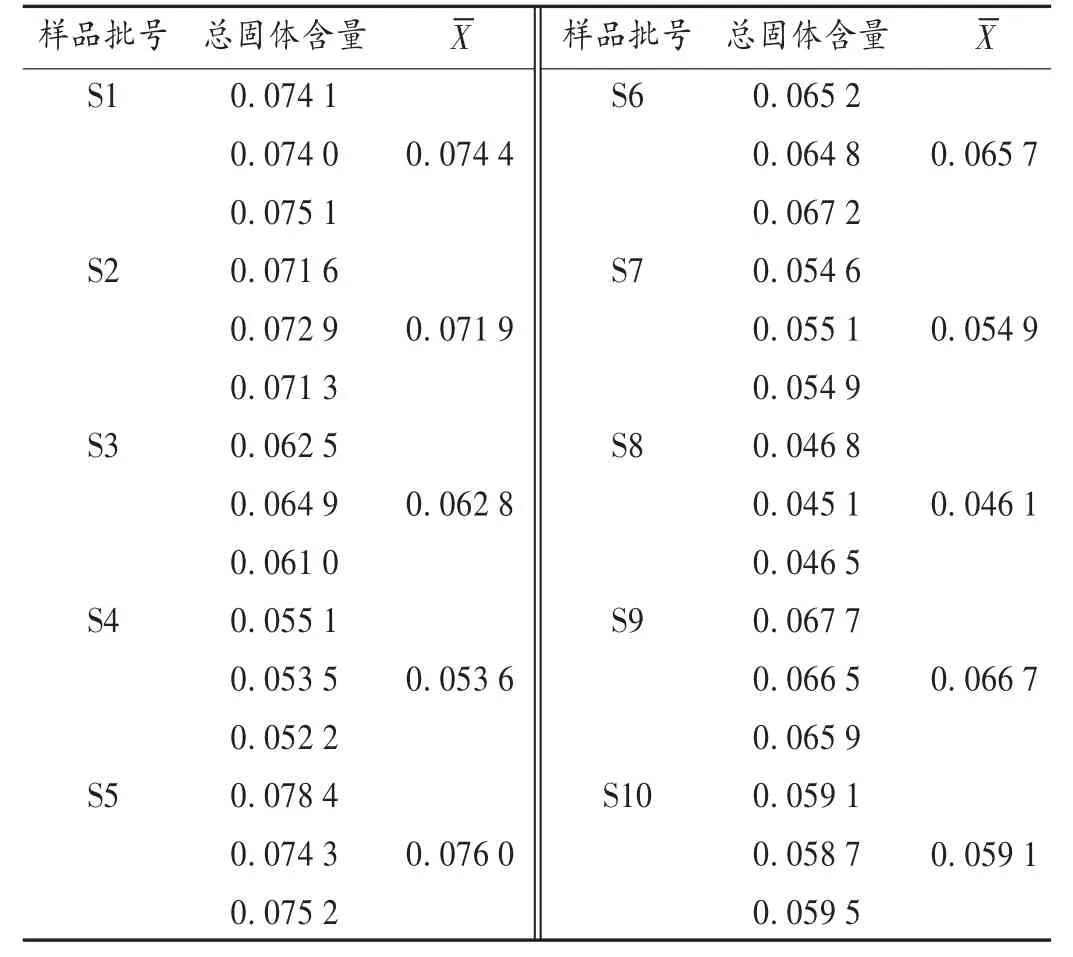
表1 各批羊胆水总固体含量(g/mL)
色谱柱:Phenomenex Luna-C18柱(250mm×4.6mm,5μm);柱温:35℃;流动相:乙腈-0.1%磷酸溶液(45∶55);流速:1 mL/min;检测波长:192 nm;进样量:5μL;柱温:35℃。按拟订色谱条件吸取对照品溶液、供试品溶液和空白对照溶液各5μL,分别注入液相色谱仪,记录色谱图。在此条件下,胆酸与其他组分峰的分离度大于1.5,且空白无干扰,详见图2。
2.3.2 溶液制备
取胆酸对照品0.013 52 g,精密称定,置2 mL容量瓶中,加甲醇溶解并定容至刻度,摇匀,制得质量浓度为6.760 g/L的对照品溶液。再精密吸取上述溶液1 mL置5 mL容量瓶中,加10%甲醇定容,稀释成质量浓度为1.352 g/L的胆酸对照品溶液。
精密量取羊胆水5mL,置50 mL容量瓶中,加甲醇30 mL,超声处理15 min,放冷,用甲醇定容,过滤,精密吸取续滤液5mL,蒸干,加20%氢氧化钠10 mL,回流2h,放冷,加稀盐酸调pH至2~3,用乙酸乙酯萃取4次,每次15 mL,合并乙酸乙酯层溶液,蒸干,加甲醇溶解并定容至10 mL,摇匀,滤过,即得供试品溶液。
2.3.3 方法学考察
线性关系考察:取2.3.2项下对照品溶液(质量浓度为6.760 g/L),用甲醇逐级稀释至质量浓度为3.3800,1.690 0,0.845 0,0.422 5 g/L。按拟订色谱条件测定,以待测物的峰面积(Y)为纵坐标,质量浓度(X)为横坐标进行线性回归,得胆酸的回归方程Y=10.448X+1.011(r=0.9995)。结果表明,胆酸质量浓度在0.4225~6.760 0 g/L范围内与峰面积线性关系良好。
重复性试验:取同一批(批号为S5)样品,分别精密吸取羊胆水样品处理项下量(5 mL)的3个水平(50%,100%,150%)2.5,5.0,7.5 mL,各3份,共9份,依法制备供试品溶液,照拟订色谱条件进样分析,记录色谱图,计算胆酸含量。结果胆酸平均含量为16.65 g/L,RSD为1.49%(n=9),表明方法重复性良好。
中间精密度试验:在与重复性不同的试验时间(不同天),分别吸取羊胆水5 mL共3份,依法制备供试品溶液,照拟订色谱条件进样分析,记录色谱图,计算胆酸含量。结果胆酸平均含量为16.67 g/L,RSD为0.34%(n=3),表明方法中间精密度良好。
稳定性试验:取同一供试品溶液,分别于0,1,2,4,8,12 h时进样分析。结果不同时间峰面积的RSD为1.97%(n=6),表明供试品溶液在24 h内稳定性良好。
加样回收试验:精密量取与重复性试验项下同批样品2.5 mL,共9份,以重复性试验结果(胆酸含量为16.65 g/L)计算羊胆水中胆酸的本底,分别按50%,100%,150%3个水平加入胆酸对照品,各3份,依法制备供试品溶液,进样分析,计算回收率。结果见表2。
2.4 样品含量测定
精密量取不同批次羊胆水5 mL,各2份,依法制备对照品溶液与供试品溶液,按拟订色谱条件各进样5μL,分别注入液相色谱仪,记录色谱图。结果见表3。可见,5批羊胆水药材中胆酸含量在7.537~19.660 g/L。不同来源的羊胆水中胆酸含量差异较大,相差2.6倍,这可能与动物生长的环境存在一定关系。
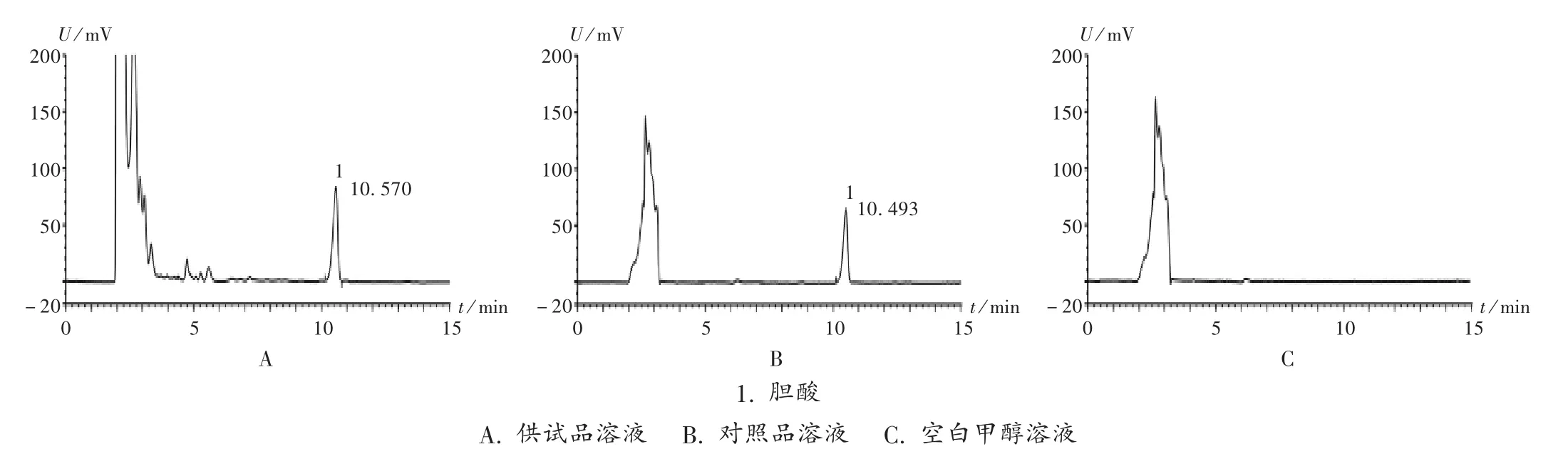
图2 高效液相色谱图

表2 胆酸加样回收试验结果(n=9)
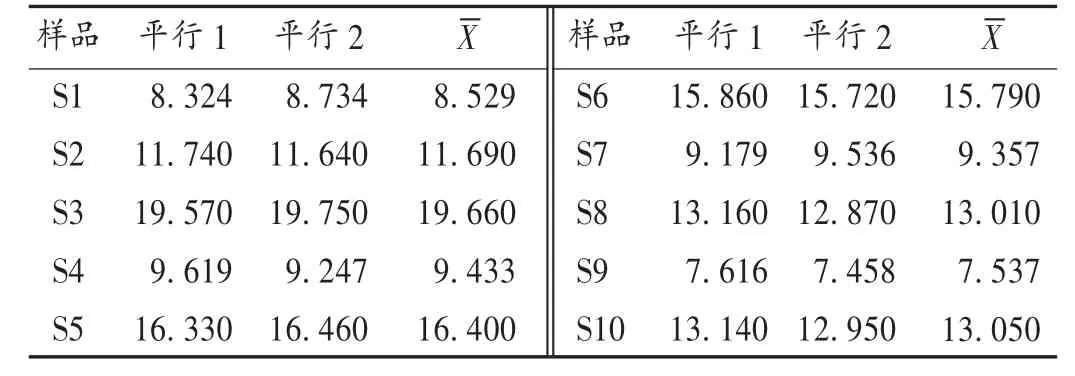
表3 各批样品中羊胆水含量测定结果(g/L)
3 讨论
3.1 TLC条件选择
曾对羊胆水的TLC鉴别方法进行了系统优化,包括不同的供试品制备方法的考察,直接利用不同试剂对羊胆水进行萃取和羊胆水挥干后用不同溶剂提取,最后发现直接挥干羊胆水后,加甲醇提取效果较好,同时还考察了甲醇的提取时间和溶剂体积等,得到最佳提取方法。通过对羊胆水TLC条件的优化,包括不同展开系统和比例、不同视检方法等,最终明确最佳色谱条件。最后考察了所建立TLC法的耐用性试验,包括样品溶液的稳定性、不同厂家薄层板、不同展开环境温度和相对湿度,最终发现耐用性良好,不同批次样品与对照药材分离结果良好。
3.2 HPLC法条件与方法选择
羊胆水中含有多种化学成分,其中胆酸是其主要化学成分,占比最大[13-14],具有镇咳、祛痰、抗菌、镇静等作用[15],其可能是羊胆水中的主要活性成分,因此选择胆酸作为指标成分,建立HPLC含量测定方法。首先,考察了不同的样品处理方法,包括不同超声处理时间、氢氧化钠用量和浓度、回流时间、萃取次数等,最终得到最佳提取条件。同时优化了色谱条件参数,分别考察了最佳吸收波长、色谱柱、流动相比例和pH、流速、柱温,得到最佳色谱条件。然后进行方法学验证试验,结果表明方法专属性强,分离度良好,均符合要求,最终对10批样品进行含量测定,发现来源不同使羊胆水样品中胆酸含量存在较大差异,也可能与动物的生长年限、生长环境有关系,有待进一步研究。羊胆水属液体药物,因此测定了其总固体的含量,结果最大值与最小值相差1.6倍,这也可能是由动物的个体差异导致。
综上所述,不同来源的羊胆水的总固体含量、胆酸含量均存在差异,造成差异的原因可能与羊的生活环境、食物、性别和羊自身的健康状态及羊胆水收集的季节等因素有关。所用羊胆水均为山羊的胆汁,并未收集绵羊的胆汁,2种来源不同的羊胆水中胆酸含量是否存在差异,具体影响胆酸含量差异的因素需作进一步研究。

