2019年3月美国、欧盟和日本新批准药物概述
孙友松
(上海递鸽医药科技有限公司,上海 201210)
1 2019年3月美国FDA新批准药物
2019年3月,美国FDA共批准15个新药,包括3个全球首次批准的新分子实体[solriamfetol(1)、brexanolone(2)和西尼莫德(siponimod,3)]、1个新有效成分(盐酸艾司氯胺酮)、2个新复方、3个新剂型、1个新生物类似药和5个新增适应证药物(见表1)。

1
2
3
1.1 Solriamfetol
Solriamfetol是一种多巴胺和去甲肾上腺素双重再摄取抑制剂,由爱尔兰爵士(Jazz)制药公司研发,研发代号为JZP-110,商品名为Sunosi®。2019年3月20日,FDA批准solriamfetol用于治疗发作性睡病和睡眠呼吸暂停综合征,该药是FDA批准的首个多巴胺和去甲肾上腺素双重作用的再摄取抑制剂[1]。Solriamfetol不可与单胺氧化酶抑制剂(MAOI)类抗抑郁药物同时使用。
Solriamfetol此次获得FDA批准基于4项随机、安慰剂对照的Ⅲ期TONES系列临床研究(TONES 2研究, NCT02348593,发作性睡病;TONES 3研究,NCT02348606,睡眠呼吸暂停综合征;TONES 4研究,NCT02348619,睡眠呼吸暂停综合征;TONES 5研究,NCT02348632,长期安全性评估)结果。研究人员在900余例发作性睡病和睡眠呼吸暂停综合征患者中开展了solriamfetol的临床研究,研究结果显示solriamfetol较安慰剂具有明显优势,且安全性和耐受性良好[2]。
2014年,爵士制药公司从Aerial生物医药公司购得solriamfetol除亚洲部分地区(韩国、中国、日本商业化授权归SK生物制药所有)的全球商业授权,solriamfetol于2012年获得FDA治疗发作性睡病的孤儿药资格。

表1 2019年3月美国FDA新批准药物Table 1 New drugs approved by FDA in March 2019
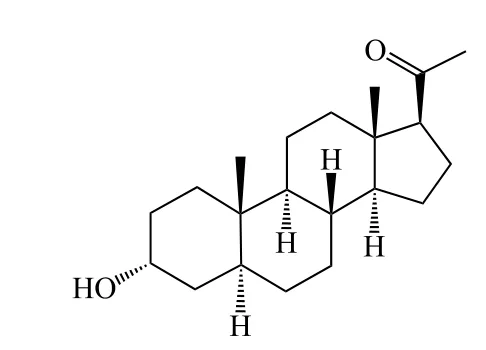
1.2 Brexanolone
Brexanolone是一种GABA A受体调节剂,由Sage医疗公司研发,研发代号为SAGE-547,商品名为Zulresso®。2019年3月 20日,FDA批准brexanolone用于治疗产后抑郁症[3]。作为Sage医疗公司首款上市新药,brexanolone也是唯一一种专门用于治疗产后抑郁症的新药。产后抑郁症是分娩最常见的医学并发症,通常孕晚期妇女或在分娩后4周内出现,自杀是分娩后母亲死亡的首要原因,在美国大约有11.5%的新晋母亲出现产后抑郁症症状。
Brexanolone于2016年获得FDA突破性疗法认定资格,2018年获得优先审批资格,此次获得FDA批准基于3项随机、双盲、平行、安慰剂对照的Ⅲ期Hummingbird系列临床研究(547-PPD-202 B研究,NCT02942004;547-PPD-202 C研究,NCT02942017;547-PPD-304研究,NCT03665038)结果,研究评估brexanolone在中度至重度产后抑郁症患者中的安全性和有效性,受试者年龄为18 ~ 45岁,产后时间小于6个月,筛查时出现的症状不早于妊娠晚期,也不晚于分娩后的前4周。3项临床研究结果显示,与安慰剂对照组相比,brexanolone治疗组在治疗后60 h时达到临床主要终点,抑郁症汉密尔顿评定量表(HAM-D)总分与基线相比显著降低,且安全性良好[4]。
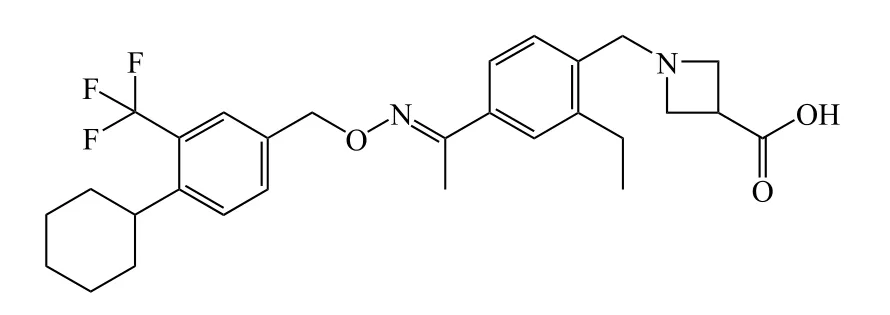
1.3 西尼莫德
西尼莫德(siponimod)是一种鞘氨醇1磷酸盐受体激动剂,由诺华制药公司研发,研发代号为BAF-312,商品名为Mayzent®。2019年3月26日,西尼莫德获FDA批准用于治疗成人复发型多发性硬化症,包括活动继发进展型多发性硬化症、复发缓解型多发性硬化症和临床孤立综合征,且大部分患者不需要进行首次剂量观察[5]。
西尼莫德此次获批基于一项随机、双盲、安慰剂对照Ⅲ期临床研究(EXPAND研究,NCT01665144)结果,该研究共招募来自31个国家的1 651例多发性硬化症受试者,研究开始时受试者平均年龄为48岁,患有多发性硬化症平均时间为16年,且50%以上受试者中位扩展残疾状况量表(EDSS)评分高达6.0且可依靠助行器。研究比较了西尼莫德治疗组和安慰剂对照组的有效性和安全性,西尼莫德显著降低了3个月确诊残疾进展(CDP)的风险,达到主要临床终点,与安慰剂相比减少21%(P= 0.013)。此外,西尼莫德有意义地推迟了6个月CDP的风险,年复发率降低了55%[6]。
2 2019年3月欧盟新批准药物
2019年3月,欧盟委员会(European Commission,EC)共批准8个新药,包括1个欧盟首次批准的新生物制品和7个新增适应证药物(见表2)。
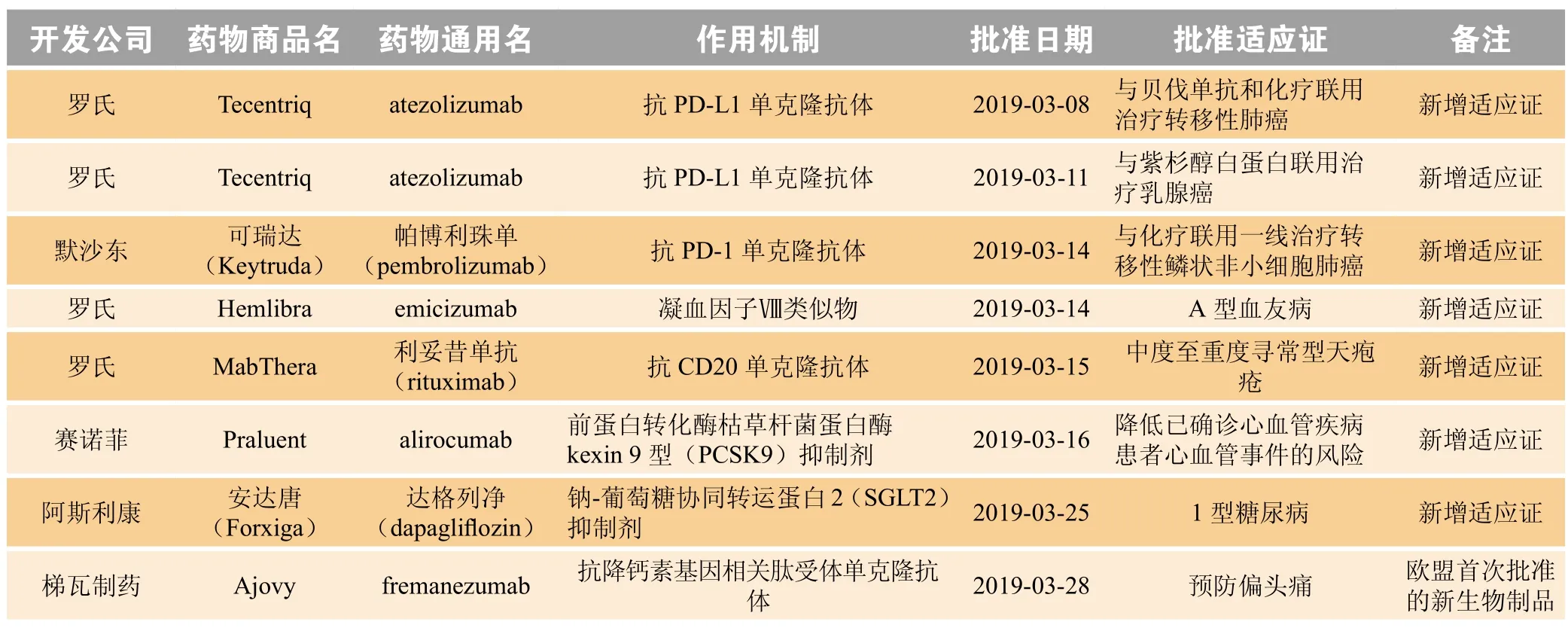
表2 2019年3月欧盟新批准药物Table 2 New drugs approved by European Commission in March 2019
3 2019年3月日本新批准药物
2019年3月,日本厚生劳动省(Ministry of Health,Labour and Welfare,MHLW)共批准31个新药,包括1个全球首次批准的新分子实体(peficitinib)、2个全球首次批准的新生物制品(elapegademase、risankizumab)、1个全球首次批准的新基因疗法(beperminogene perplasmid)、5个日本首次批准的新分子实体、2个日本首次批准的新生物制品、1个新剂型、4个新复方、1个新生物类似药和14个新增适应证药物(见表3)。

表3 2019年3月日本新批准药物Table 3 New drugs approved in Japan in March 2019

续表3

续表3

