传统合成改善病情抗风湿药的遗传药理学研究进展
吴明如,葛卫红
(南京大学医学院附属鼓楼医院药学部,江苏 南京 210008)
类风湿关节炎(RA)是一种以侵袭性关节炎为主要临床表现的自身免疫性疾病,可发生于任何年龄。流行病学调查显示:RA的全球发病率为0.5% ~1%,其中中国大陆地区发病率为0.42%,患病人群约为500万,男女患病比为1 : 4[1]。RA不仅造成患者身体功能、生活质量和社会参与度下降,而且会给患者家庭和社会带来巨大的经济负担。随着风湿病学研究深入,各国RA诊疗指南持续更新,药物治疗策略得到不断优化。本文基于2018年中国最新RA诊疗指南,结合指南推荐抗风湿药的治疗策略,分析相关药物遗传药理学研究进展,以期为诊疗决策及临床研究提供部分参考意见,促进个体化用药进展和临床转化。
1 《2018年中国类风湿关节炎诊疗指南》药物治疗策略解读
《2018中国类风湿关节炎诊疗指南》(下简称2018年指南)系中华医学会风湿病学分会关于RA的第3版指南,较第2版指南——《类风湿关节炎诊断及治疗指南》(2010年版)[2](下简称2010年指南)在诊疗方面有较大的更新。
2010年指南治疗原则强调“治疗的目的在于控制病情、改善关节功能和预后。应强调早期治疗、联合用药和个体化治疗的原则。治疗方法包括一般治疗、药物治疗、外科手术和其他治疗等。”在该版指南中对当时(2010年)RA各种治疗药物,尤其生物制剂的使用做了详细介绍,2010年指南推荐抗风湿药见图1。主要包括:1)非甾体抗炎药(NSAIDs),如布洛芬、双氯酚酸、美洛昔康、塞来昔布等;2)改善病情抗风湿药(DMARDs),如甲氨蝶呤(MTX)、柳氮磺吡啶(SASP)、金诺芬、硫唑嘌呤等;3)生物制剂如依那西普、英夫利昔单抗、阿那白滞素、阿巴西普等;4)糖皮质激素;5)植物药制剂,如雷公藤、白芍总苷等。

图1 《类风湿关节炎诊断及治疗指南》(2010年版)推荐抗风湿药Figure 1 Treatment recommendations in 2010 Chinese Guideline for the Diagnosis and Treatment of Rheumatoid Arthritis
2018年指南治疗原则强调“早期、规范治疗,定期监测与随访。治疗目标是达到疾病缓解或低疾病活动度,即达标治疗,最终目的为控制病情、减少致残率,改善生活质量。”新版指南更加强调早期达标治疗的重要性和必要性。药物治疗方面意见体现在“推荐意见 6 ~ 9”[1]。
“推荐意见6:RA患者已经确诊,应尽早开始传统合成改善病情抗风湿药(csDMARDs)治疗。推荐首选MTX单用。存在MTX禁忌时,考虑单用来氟米特(LEF)或SASP。”
同时,指南中提出羟氯喹(HCQ)一般不单独使用,建议与其他DMARDs联用。可见,2018年指南再次肯定了csDMARDs在早期RA患者治疗中的基石地位。但需要指出的是2010年指南中推荐的传统的金制剂、青霉胺、巯唑嘌呤、环孢素等由于缺少循证医学证据,《2015年美国风湿病学会(ACR)RA治疗指南》(下简称2015年ACR指南)[3]和 《2016年欧洲风湿病防治联合会(EULAR)RA治疗指南》(下简称2016年EULAR指南)已未再推荐上述各种药的使用[4]。在2018年指南中亦未推荐以上各种药的使用。
“推荐意见7:单一csDMARDs治疗未达标时,建议联合另1种或2种csDMARDs进行治疗;或1种csDMARDs联合1种生物制剂DMARDs进行治疗;或1种csDMARDs联合1种靶向合成DMARDs(tsDMARDs)进行治疗。”
2016年EULAR指南将DMARDs分为合成DMARDs(sDMARDs) 和 生 物 DMARDs(bDMARDs) 两 大类。其中sDMARDs又分为csDMARDs和tsDMARDs。MTX、LEF、SASP、HCQ属于csDMARDs的范畴;托法替布属于tsDMARDs的范畴。bDMARDs又分为生物制剂(boDMARDs)和生物类似物(bsDMARDs)两大类。其中,肿瘤坏死因子-α(TNF-α)拮抗剂、白细胞介素-6(IL-6)拮抗剂属于boDMARDs的范畴。2018年指南中再次肯定了TNF-α拮抗剂和IL-6受体单克隆抗体在RA治疗中的作用。2010年指南中TNF-α拮抗剂列入了依那西普、英夫利昔单抗、阿达木单抗3个品种,2018年指南只推荐了这一大类药物,并未建议具体品种,因为临床实践中发现该类药物临床效果相似。IL-6受体单克隆抗体托珠单抗在第2、3版指南中均有推荐。2010年指南推荐的IL-1拮抗剂阿那白滞素、抗CD20单抗利妥昔单抗、细胞毒性T淋巴细胞抗原4抑制剂(CTLA4-Ig)阿巴西普由于循证证据的缺乏,新指南在综合效益风险评估后均未推荐。tsDMRADs是当前一类新的治疗策略,目前该大类中只有1个品种即小分子口服靶向制剂——托法替布应用于临床,并于2017年3月在中国获准上市。2016年EULAR指南中,托法替布被推荐为与TNF-α拮抗剂、IL-6拮抗剂等生物药地位相当的治疗药物[4]。2018年指南中指出TNF-α拮抗剂、托珠单抗和托法替布在使用方面无优先顺序,三者之间可以更替与csDMRADs联合使用。
“推荐意见9:RA患者在使用bDMARDs或tsDMARDs达标后,可考虑对其减量,但减量过程中需严密监测,谨防复发,减量过程中,如RA患者处于持续临床缓解状态1年以上,临床医师或可根据实际情况讨论是否停用,但是推荐级别为1C级别。”
较2010年第2版相对粗犷的用药推荐,2018年中国指南依据最新循证医学证据更加强调流程和序贯治疗。2015年ACR指南、2016年EULAR指南均将“早发现、早治疗、达标治疗、个体化”治疗贯穿于RA治疗的新理念中。2016年EULAR指南指出“任何治疗策略的制定必须由患者和风湿科医生共同决策”,强调个体化治疗的重要性:临床诊疗过程中,风湿科医生应综合患者的疾病活动度、有无骨破坏、病程长短、是否有合并症以及年龄、性别、经济情况等多种因素制定个性化的治疗方案。但在临床用药过程中“千人一药、千人一方”的状况普遍存在,相关指南均未给出药物个体化治疗的建议。2016年EULAR指南的展望中指出下一版的指南更新或将纳入精准用药的相关推荐,以使患者获得最佳治疗效果和最低不良反应。在此背景下,基于2015年ACR指南、2016年EULAR指南、2018年中国指南中均推荐了csDMARDs —— MTX、LEF、SASP、HCQ,本文同时从遗传药理学方面分析这4种药物个体化治疗研究进展。相关csDMARDs基本情况见表1。
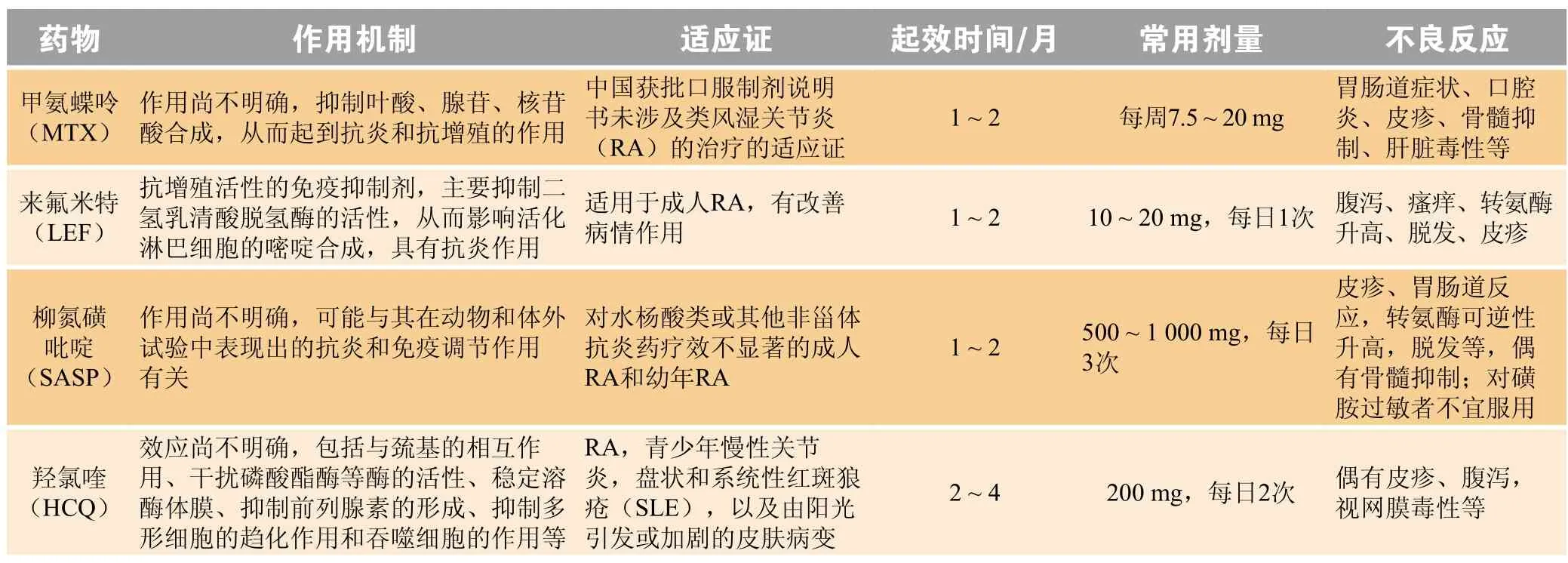
表1 《2018中国类风湿关节炎诊疗指南》推荐传统合成改善病情抗风湿药物基本情况一览表Table 1 Conventional synthetic disease-modifying antirheumatic drugs recommended in 2018 Chinese Guidelines for the Diagnosis and Treatment of Rheumatoid Arthritis
2 传统合成改善病情抗风湿药的遗传药理学
2.1 甲氨蝶呤的遗传药理学
小剂量MTX作为早期RA的单药治疗首选方案,也是RA治疗的锚定药。大剂量MTX可用于各型急性白血病、头颈部癌、肺癌,各种软组织肉瘤、银屑病、乳腺癌等多种疾病。小剂量MTX主要用于RA的治疗,常用方案为口服,每周7.5 ~ 20 mg,一般1 ~ 2个月起效。然而,其疗效存在种族差异,如汉族人群MTX一般起始治疗剂量每周7.5 mg,最高耐受剂量每周20 mg[5];事实上我国很多患者由于消化道不良反应通常不能耐受超过每周15 mg的剂量,而在高加索RA患者中,MTX起始推荐剂量一般为每周10 mg,并迅速加量至每周25 ~30 mg,给药途径为口服或皮下注射[6]。在同一种族中通过充分的剂量优化后,依然存在疗效及不良反应方面的差异,文献报道至少30%的患者无效[7],大部分患者最终需要合并其他药物共同控制RA[8]。目前,MTX剂量优化及选择主要依赖临床药效和安全性的观察,此过程至少需持续3 ~ 6个月,且需要更长时间来最终决定是否改变剂量或合并其他药物治疗。这种“试错型”剂量调整或改变用药方案策略会延迟患者受益,可能置30%的RA患者于长期无效治疗之境而贻误病情,并可能引起胃肠道不良反应等毒副作用。已有大量研究表明:基因多态性与MTX治疗的敏感性相关,其疗效和不良反应差异受多种因素控制,主要涉及药物转运体、药物代谢酶、作用靶点等方面[9]。业界认为MTX可通过细胞膜上溶质转运蛋白(solute carrier,SLC)家族成员的还原型叶酸载体1(reduced folate carrier,RFC1)转运至红细胞、淋巴细胞等细胞内,胞内MTX同时又被细胞膜上三磷酸腺苷结合盒转运体(ATP-binding cassette transporter,ABC转运体)家族成员ABCB1排出至胞外。胞内的MTX被叶酸聚谷氨酸合成酶(FPGS)代谢为多聚谷氨酸酸化MTX(MTX-PG),此为动态过程,MTX-PG同时又被γ-谷氨酰水解酶(GGH)水解,又生成MTX。MTX-PG一方面可抑制胸腺核苷酸合成酶(TYMS),从而干扰DNA合成途径;另一方面MTX-PG可抑制二氢叶酸还原酶(DHFR)、亚甲基四氢叶酸还原酶(MTFHR)生成,从而干扰叶酸代谢;再一方面MTX-PG可抑制氨基咪唑羧酰胺核糖转移酶(ATIC),从而干扰腺苷(adenosine)的胞内聚集并分泌至胞外的过程,腺苷可能是MTX发挥抗炎作用的主要原因[10]。MTX的作用机制见图2所示。

图2 简化的甲氨蝶呤作用机制Figure 2 Abbreviated illustration of the mechanism of methotrexate
2.1.1 药物转运体编码基因多态性与甲氨蝶呤的临床表现 目前,研究认为MTX仅可被细胞膜上SLC转运至细胞内。SLC是一个超家族,迄今已发现至少395个成员和52个家族,其家族成员中RFC1被认为是MTX转运的主要转运体,系SLC家族第19个家族的第1个成员(SLC19A1)[11]。RFC1的遗传多样性不仅可能影响RFC1的功能和表达[12],同时可能影响MTX的转运[11]。目前,RFC1的80G/A是相对研究最多的单核苷酸多态性(SNP)的位点,它影响着MTX的胞内转运[10]、胞内MTX的浓度[13]、MTX-PG的浓度[14]。但有关研究结果的结论却并不一致:一方面研究发现RFC180A基因突变可能会提高RA患者对于MTX的应答率[10,12-13,15-17],并延长疾病缓解期[18],这似乎提示着携带RFC180A等位基因或许可作为判断患者对药物疗效提高的标志物;另一方面研究发现,RFC180G携带者在使用MTX时可能总的不良反应及胃肠道不良反应发生率也会提高[15,19-21]。43T/C位点的变异可能减少RFC1的表达,从而影响MTX的摄取,进而影响MTX的疗效和毒性反应[22]。其他被研究的位点SLC19A1rs7499、SLC46A1rs2239907、SLCO1B1rs149056可能增加MTX的毒性反应的风险,SLC19A1单倍型rs7499、rs1051266、rs2838956可能具有帮助识别MTX的毒性反应的能力[23-24]。转运至胞内的MTX又被细胞膜上ABC转运体排出胞外。ABC转运体也是一个超家族,目前已经发现7个亚家族,超过50个成员,ABCB1是ABC第2个家族的第1个成员,编码的蛋白是P-糖蛋白(P-gp),是MTX的外排转运体[9]。ABC转运体的基因变异可能影响耐多药相关蛋白1-4、多重耐药蛋白等外排蛋白的功能,通过影响胞内MTX的浓度,进而影响药物的疗效及不良反应[25-26]。ABCB1的3435C/T突变发生率较高,可能加快症状的缓解及相关不良事件的发生[10,25]、2677GA/T位点突变可能也与MTX的疗效及安全性有关,而1236C/T 位点突变未被发现与MTX的疗效及安全性有关[27]。
2.1.2 药物代谢酶编码基因多态性与甲氨蝶呤的临床表现胞内的MTX可被FPGS代谢为MTX-PG,MTXPG为药效活性成分。MTX-PG被GGH水解,又生成MTX。在GGH和FPGS编码基因中,已有多个SNPs被检测到,包括GGH中的401C/T、354G/T、124T/G、452C/T、1102A/G;FPGS中 的 1994A/G、2572C/T、114G/A[26]。既往研究发现,GGHT16C与MTX的疗效有关,C等位基因可能减少GGH的活性,导致MTX的外排,提高胞内MTX-PG的水平;携带GGH16C等位基因的患者(携带或不携带GGH452C-16T)在使用MTX治疗3个月后,临床症状改善更加明显[26]。GGH-401CC基因型则增加MTX的总的不良反应的发生率[15]。目前,对于FPGS的基因多样性的研究相对较少,大多数研究不支持GGH和FPGS多样性可能会影响MTX的反应性的结论。
2.1.3 作用靶点编码基因多态性与甲氨蝶呤的临床表现MTX-PG可干扰叶酸代谢途径,通过抑制DNA合成、修复和细胞增殖中相关酶的活动,一方面直接抑制TYMS、DHFR、ATIC;另一方面间接抑制叶酸代谢途径中的MTHFR。DHFR317A/G可能与患者对MTX的应答率下降有关[25]。常见19-bp基因缺失可能影响DHFR的复制,但可能对MTX的疗效及不良反应发生并不产生影响[28]。另外,携带473G/A和35289A/G的SNP未发现可能影响MTX的疗效;rs12517451、rs10072026、rs1643657位点突变可能与MTX的不良反应事件的发生有关[25]。
MTHFR是目前MTX遗传药理学研究最多的代谢酶。大量研究证明:MTHFR具有基因多态性,其中667位点、1298位点的多态性最常见,这2个位点突变均会影响叶酸的代谢。中国人群中,约29%MTHFR基因为677TT型(纯合突变),44%为677CT(杂合突变型,3.9%为1298CC型[29]。677CT等位基因可能降低MTX治疗应答率[15,20],但却可能提高病情控制率[30]。然而,近期的一份荟萃研究显示:MTHFR677CT可能增加MTX在亚洲和高加索RA患者人群中的总的毒性反应[31]。另2项研究发现,MTX对于携带1298C等位基因的患者的治疗效果较差[20,26]。但有趣的是,当使用大剂量MTX时,携带1298C等位基因的患者治疗效果可能更好,表现为延缓病情进展,并降低C反应蛋白(CRP)水平[32-33]。携带1298C等位基因可能增加血管内皮功能障碍的风险,从而引起动脉粥样硬化等心血管不良事件的发生,而已知心血管疾病风险是罹患RA的独立危险因素[34]。近期Fan等[35]发表的一项荟萃分析纳入了10个研究,其中1 325例系“MTHFR1298C与MTX疗效相关”的病例,2 777例系“MTHFR1298C与MTX不良反应的相关”的病例,结果表明MTHFR1298C与MTX的疗效或不良反应均无相关性,但亚组分析表明MTX在携带MTHFR1298C的南亚人群中的疗效下降。尽管相关研究可能有所限制,但目前多数学者支持MTHFR在677T等位基因和1298C等位基因的变异将最有可能作为预测MTX相关不良反应的标志物。另外,MTHFR在白血病、多发性卵巢综合征等疾病方面的基因多态性也是当前研究的热点。
在TYMS基因多态性方面,研究最多的是位于28 bp重复(repeats)片段、1494缺失(del6)片段。1个多态性区域包含2个或3个28 bp重复片段(即2R或3R)与TS酶的表达及MTX的疗效有关[36]。携带3R等位基因的RA患者和携带2R等位基因的患者相比TYMS的mRNA的表达增多、RA疾病的活动度提高、MTX治疗时引起的骨髓抑制的风险增高,需加大剂量才能达到相同的治疗效果[28,37-38]。携带TYMS2R等位基因是减少MTX的毒性反应的保护性因素[28]。近期有研究发现,携带3R等位基因和MTX的疗效相关[29],可能的解释是3R等位基因可引起TS的表达,进而使MTX-PG对于TS的抑制作用降低[39]。含有1494de16缺失片段的患者TYMS mRNA的稳定性和表达下降,MTX的治疗效果可能提高[25,37]。
目前,大量研究发现ATIC基因变异也可能影响了MTX治疗效果[27],ATIC347C/G基因多态性可能与MTX的疗效及不良反应均有关[12-13,25]。675C等位基因可能增强MTX临床应答[40],而携带26293T/C的患者可能对MTX的应答率下降[25]。另有研究显示,雌激素受体1(ESR1)和雌激素受体2(ESR2)与MTX的疗效及不良反应无相关性[41]。MTX作用机制通路中最可能存在基因多态性的位点及结果见表2。
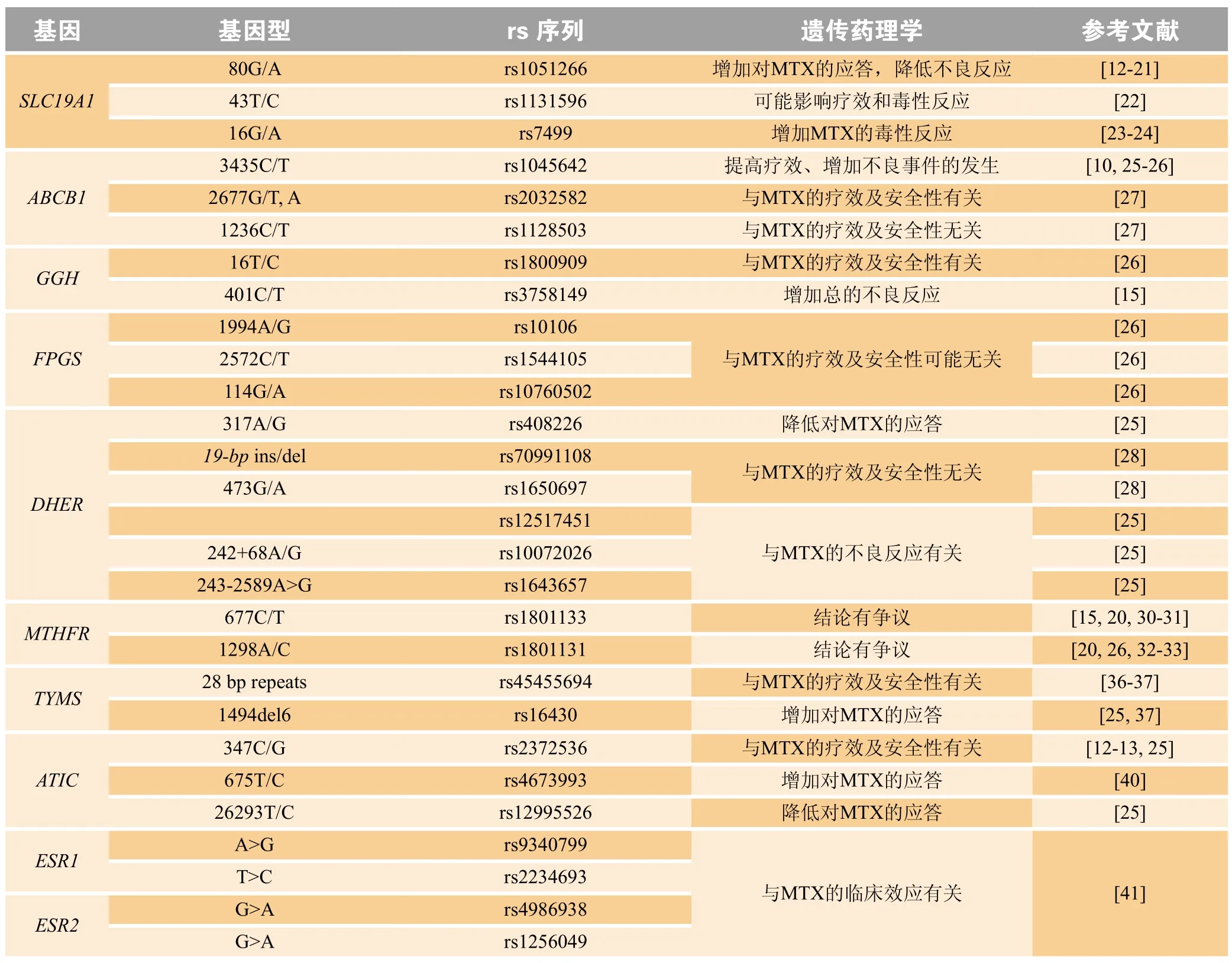
表2 甲氨蝶呤作用机制通路中可能存在基因多态性的位点Table 2 Possible gene polymorphisms in the methotrexate pathway in patients with rheumatoid arthritis
2.2 来氟米特遗传药理学
来氟米特系作为不能耐受MTX的早期RA的替代药物。国内常用剂量为20 mg · d-1,最初3 d给予负荷剂量50 mg · d-1,之后根据病情给予维持剂量10或20 mg · d-1,口服。但是 40% ~ 70% 的患者在治疗的第1年内会由于不良反应事件(如转氨酶升高、恶心、腹泻等)的发生而停药[12]。通常认为,SNPs影响了LEF的药效/药动学参数,进而影响了LEF的疗效和不良事件的发生。LEF为前药,口服可迅速吸收,在胃肠道与肝中迅速转化为活性代谢产物A771726,药物大概在7周后达到稳态血药浓度,根据药物浓度不同,其发挥作用的机制也不同。A771726一方面可逆性地抑制二氢乳酸脱氢酶(DHODH),从而影响活化淋巴细胞的嘧啶从头合成,发挥抗增殖效应,这种抑制作用的强弱取决于靶细胞对嘧啶从头合成途径的依赖程度;另一方面高浓度A771726能够抑制T、B淋巴细胞的T细胞受体和B细胞受体相关酪氨酸激酶的活性,阻断信号传导,从而抑制活化淋巴细胞因子TNF和IL-17的产生[42]。通过检测A771726的浓度可能有助于预测LEF的治疗作用和不良反应的指标。有文献报道A771726的稳态血药浓度和类风湿关节炎患者病情评价评分(DAS28)有关[43],也与LEF引起的相关不良事件有关[44]。LEF的作用机制及代谢途径见图3。
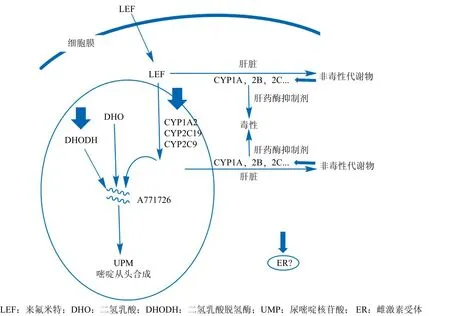
图3 简化的来氟米特作用机制及代谢途径Figure 3 Abbreviated illustration of the mechanism of leflunomide and its metabolic pathway
2.2.1 代谢酶编码基因多态性与来氟米特临床表现LEF口服后大部分被肝药酶细胞色素P450(CYP450)代谢成A771726。CYP450分布于全身各组织,在肝脏中含量最多。CYP450是一个超家族,由一个共同的祖先基因衍生进化而来。迄今为止,人类CYP450已发现至少18个家族,确定了60多个基因[9]。CYP1A2、CYP2C19、CYP3A4在LEF代谢成A771726的过程中发挥着重要作用。目前,CYP1A2基因多态性被认为是影响LEF毒性的一个重要的预测因子。有研究探讨在105例RA患者中CYP1A2*1F、CYP1C19*2、CYP2C9*2、CYP1C19*17、CYP2C19*3的携带是否影响LEF的疗效或不良反应,结果发现携带CYP1A2*1F CC、CYP1A2*1F A等位基因的患者发生LEF相关的毒性反应的概率提高9.7倍,而CYP2C9、CYP2C19多基因型和LEF的毒性的关系暂未观察到[45]。另有研究观察了LEF治疗的RA患者中CYP1A2和CYP2C19基因多态性对A771726的药动学的影响,该研究纳入了67例RA患者,采用高效液相色谱法监测A771726稳态血药浓度;结果表明携带CYP2C19*2等位基因的患者较未携带者其A771726口服清除率提高71%;A771726平均稳态血药浓度与疗效有关,A771726的血浆浓度越高,CRP下降越明显,表现为抗炎作用越强;A771726的稳态血药浓度和LEF的不良反应发生率之间的关系暂未观察到[46]。另有研究显示,CYP3A4基因多态性与LEF的疗效及不良反应可能也无关[47]。以上研究表明:CYP2C19的基因多态性影响了A771726的血药浓度,从而可能影响RA患者对于LEF治疗的应答率,但可能并不影响LEF的安全性。
DHODH是一个单功能蛋白,位于线粒体膜的表面人类DHODH基因序列进化中高度保守,只存在1个由于编码错误而导致的多基因型。携带DHODHAA基因型的RA患者的关节肿胀数、视觉模拟评分法(VAS评分更低。O′Doherty等[48]分析了56例使用LEF治疗的病人,发现携带DHODH单倍型的患者对于药物的应答率下降,这表明这种单倍型的功能性的变异可能会引起患者对LEF的敏感性下降。
2.2.2 其他基因多态性与来氟米特临床表现大量研究表明女性对LEF的反应性不及男性[49-50]。雌二醇受体水平可能参与调控了LEF在胞内的作用,雌激素受体(ESR)的状态可能影响LEF对于RA患者的疗效,携带ESR1rs9340799 AA和rs2234693 TT等位基因的患者对LEF的敏感性提高(治疗12个月后);ESR1rs9340799-rs2234693AT单倍型携带者对药物的敏感性更高,G-C单倍型对药物的敏感性可能下降;ESR2基因rs4986938和rs1256049基因多态性则与药物的疗效无关[51]。LEF代谢途径中最可能存在基因多态性的位点(见表3)。

表3 来氟米特作用途径中可能存在基因多态性的位点Table 3 Possible gene polymorphisms in the LEF pathway in patients with rheumatoid arthritis
2.3 柳氮磺吡啶遗传药理学
SASP作为不能耐受MTX的早期RA患者的替代药物,临床上适应证也包括轻至重度的溃疡性结肠炎。SASP治疗RA的机制尚未完全明确,有部分研究认为其可能是限制相关炎症细胞因子的产生,如抑制IL-6、TNFα等,并促进中性粒细胞凋亡等。SASP临床常见不良反应包括恶心、消化不良、皮疹、头痛、腹痛等。一些剂量依赖性的不良反应可通过减少剂量得到缓解。SASP口服给药时肠道细菌将SASP分解成磺胺嘧啶(SP)和5-氨基水杨酸(5-ASA),SP在肠道内吸收较好,代谢效率较高,5-ASA在肠道吸收效果相对较差,SASP的不良反应的发生与磺胺嘧啶有关。磺胺嘧啶在N-酰胺转移酶(NAT)的作用下可转成乙酰化磺胺嘧啶,因此此途径的代谢率取决于乙酰化代谢表型。慢乙酰化代谢表型的患者更容易对磺胺嘧啶产生不良反应。血浆SASP的水平和其代谢产物SP主要受N-酰胺转移酶2(NAT2)的基因多态性影响。SASP的作用机制和代谢途径见图4。
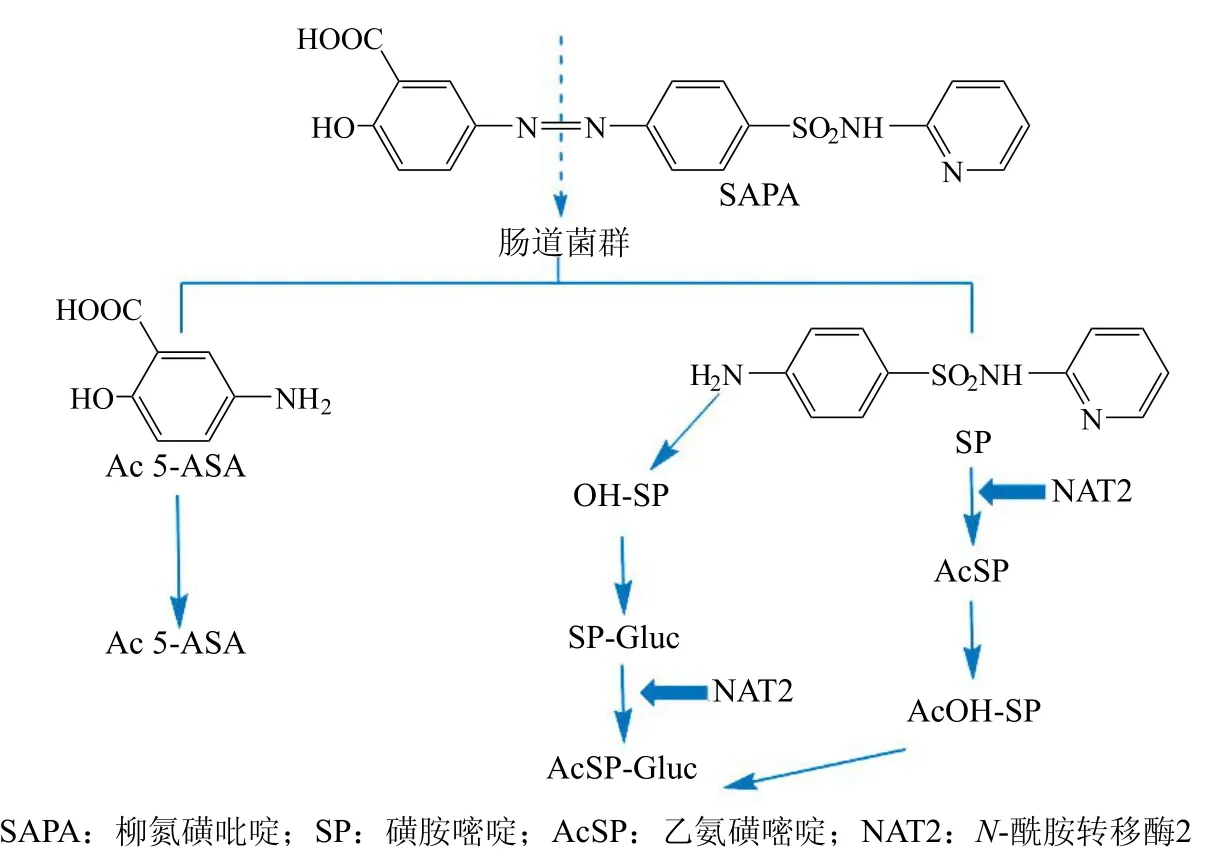
图4 简化的柳氮磺吡啶代谢途径图Figure 4 Abbreviated illustration of the metabolic pathway of sulfasalazine
NAT主要催化SP进行乙酰化代谢,人体NAT主要分为NAT1和NAT2这2种亚型,二者由独立的基因进行编码[9]。NAT2存在明显的基因多态性,一些突变可以导致其酶活性的改变,主要有3种表型,即慢代谢型、中间代谢型和快代谢型。亚洲人群中的慢代谢型比例为10% ~ 30%,而欧美人群的慢代谢型比例为40% ~70%[8]。目前已发现至少88种不同类型的NAT2等位基因,其中野生型被命名为NAT2*4[9]。NAT2的基因多态性在SASP的代谢中发挥重要作用。Wiese等[52]研究显示:血浆SAPA受NAT2和ABCG2的影响,早期RA患者接受包括SASP在内的DMARDs治疗,在纠正常规变量后,部分患者由于NAT2表型影响而发生毒性反应。Kita等[53]研究也表明:NAT2慢代谢者发生不良反应的发生率(62.5%)较快代谢者不良反应的发生率(8.1%)高,并且存在统计学差异。
2.4 羟氯喹药物遗传药理学
HCQ可单药治疗症状较轻的RA患者,临床更常见的是与MTX二联或与MTX、SASP三联使用。横断面研究显示我国HCQ的联合用药占95%[1]。临床常用剂量为200 mg,每日2次。HCQ是系统性红斑狼疮(SLE)的基础用药,在无禁忌证的情况下,可以长期使用[54]。因此,临床上HCQ更广泛地用于SLE患者,但存在个体差异,对约40%的患者无效[55]。HCQ的遗传药理学研究主要针对SLE展开。口服的HCQ 75%以上经胃肠道吸收,入血后与血浆蛋白结合,经ABCG2等转运蛋白转运后[56],30% ~ 60%经肝代谢,被CYP2D6、CYP3A4、CYP3A5、CYP2C8等酶作用代谢为去乙基羟氯喹(DHCQ)、去乙基氯喹(DCQ)和双去乙基氯喹(BDCQ),其中DHCQ为主要代谢产物而BDCQ浓度最低[57]。一项队列研究发现,HCQ治疗盘状红斑狼疮的过程中,尽管CYP2C8变异引起患者对药物的应答率增高,但在延缓病情进展方面并未显示出效果[55]。罗雪梅等[58]研究发现,CYP3A4* 1G等位基因突变可使HCQ血药浓度降低,而ABCG2等位基因突变对HCQ的血药浓度无明显影响。Lee等[59]研究了韩国人群中最易发生基因变异的CYP(CYP2D6*10,CYP3A5*3、CYP3A4*18B)的基因多态性是否影响血中HCQ、DHCQ浓度([HCQ]、[DHCQ])以及[DHCQ][HCQ]比值,结果纳入的194例RA患者在服用HCQ 3个月,调整了年龄、性别、剂量、SLE疾病活动指数评分后,携带CYP2D6*10(rs1065852)的G/G的基因型的患者[DHCQ]:[HCQ]比值最大,在基因型为A/A的患者中比值最小;携带CYP2D6*10(rs1135840)的C/C基因型患者[DHCQ]: [HCQ]比值最大,在基因型为G/G的患者中最小;CYP3A5*3和CYP3A4*18B与[HCQ]、[DHCQ]以及[DHCQ]: [HCQ]比值均未发现相关性。该研究认为,[DHCQ]: [HCQ]比值可能与韩国人群中CYP2D6的基因多态性有关,HCQ的代谢途径见图5;HCQ代谢途径中可能存在基因多态性的位点见表4。
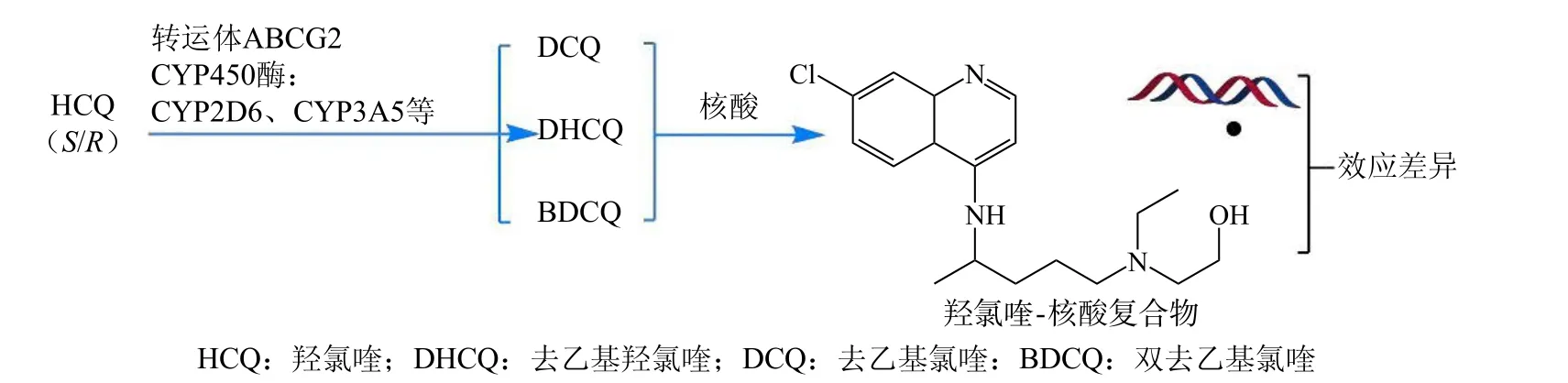
图5 简化的羟氯喹代谢途径Figure 5 Abbreviated illustration of the metabolic pathway of hydroxychloroquine

表4 羟氯喹代谢途径中可能存在基因多态性的位点Table 4 Possible gene polymorphisms in the hydroxychloroquine pathway in patients with systemic lupus erythematosus
3 结语
目前,RA的发病机制尚未完全明确,通常认为系多种因素共同作用的结果。2018年指南的发布对于促进临床患者合理诊疗给予了有效指导。在用药方面,由于治疗药物新的循证医学证据的积累,新版指南较2010年版指南用药推荐更加明确。肯定了包括MTX在内的csDMARDs在治疗过程的首选地位,并重点推荐了MTX、LEF、SASP及HCQ;肯定了bDMARDs在RA治疗过程中的作用并作为单一csDMRADs治疗未达标时的联合用药的选择,另外,重点推荐了TNF-α拮抗剂及IL-6拮抗剂托珠单抗;同时首次推荐了口服小分子靶向制剂JAK抑制剂托法替布。新版指南中也明确了“类风湿关节炎的诊疗流程”。相信随着新指南在临床的推广,RA患者的治疗获益将提高。虽然ACR、EULAR及中国RA指南都在强调个体化用药,但各指南均未纳入个体化用药的建议,“千人一方、千人一药”的现状还可能存在很久,不同患者可能由于个体差异而未达到有效治疗并可能增加药物相关不良事件的发生。随着相关基因标志物的检出,或许对改善这一临床现状有一定的参考和应用的价值。
csDMARDs中的 MTX、LEF、SASP、HCQ广泛应用于临床,但仍难于预测药物对哪些人群更有效,哪些更易发生不良反应。药物遗传药理学的大量研究表明基因多态性与药物的疗效和不良反应可能有关。目前,MTX、LEF、SASP、HCQ的药物遗传药理学研究大部分集中在研究药物转运体(SLC家族、ABC转运体)、药物代谢酶(Ⅰ相药物代谢酶CYP450家族、Ⅱ相药物代谢酶NAT家族)、药物受体(雌激素受体)和作用靶点(如TYMS酶等)等方面,截至2019年3月15日,在Pharma GKB数据库中收载MTX有关遗传多态性的临床注释128条,证据级别2A ~ 4级;LEF收载临床注释4条,证据级别3 ~ 4级;SASP收载临床注释7条,其中对于葡萄糖-6-磷酸脱氢酶缺乏的患者,美国食品药品监督管理局(FDA)警示需要注意磺胺引起的不良反应,其他位点的基因多态性的效应证据级别多在3 ~4级;未收载HCQ临床注释。这些研究进展为临床药物选择提供了一些思路,但一些因素仍制约着相关研究结果,如研究结论的多样性及非重复性。对于有望可作为临床标志物的基因位点,如MTHFR677TT、NAT2*4等也仍需大量大样本、多中心、设计严谨合理的研究验证,这需要国家支持和多方共同努力。同时需指出以上主要基于SNP的研究,药物的疗效和毒性往往是多基因、多位点综合作用的结果,很多非遗传因素也会产生干扰,如联合用药、吸烟和饮食等生活习惯以及环境等因素的复杂性决定了寻找有临床意义的药物相关基因位点非常困难,同时也提示仅仅依靠药物基因组学或治疗药物监测不能为指导患者用药提供全面的参考信息以进行精准用药,必须将多种方法相结合,充分考虑可能对药物疗效及安全性产生影响的因素。

