自身免疫性疾病的治疗进展
孙凌云
(南京大学医学院附属鼓楼医院风湿免疫科,江苏 南京210008)
自身免疫性疾病是一类由于机体自身免疫系统紊乱而导致的多脏器、多系统损害的慢性疾病,主要包括系统性红斑狼疮(systemic lupus erythematosus,SLE)、类风湿性关节炎(rheumatoid arthritis,RA)、干燥综合征(Sjogren′s syndrome,SS)、多发性肌炎与皮肌炎(polymyositis,PM/dermatomyositis,DM)等。这类疾病通常累及关节、肌肉、骨骼及关节周围的软组织,患者一经确诊应当及时用药治疗,避免疾病进一步发展造成肝肾等器官或系统的损害。临床上常用的糖皮质激素和传统改善病情的抗风湿药物(diseasesmodifying antirheumatic drugs,DMARDs)具有良好的抗炎、止疼以及改善或延缓病情进展的作用,至今仍作为临床治疗风湿免疫病的一线选择。然而,针对一线治疗单一或联用方案反应不佳或无法耐受者,需要考虑其他具有潜在疗效的治疗方案,如干细胞移植、生物制剂或新型植物药制剂,以及一些可能调节或抑制免疫的抗风湿候选药物,以期缓解这类难治性风湿病患者的病情、改善其生活质量。
1 干细胞移植
干细胞是一类具有高度自我更新能力和多向分化潜能的细胞,有强大的组织修复和免疫调节能力。干细胞移植疗法主要指造血干细胞移植和间充质干细胞(mesenchymal stem cells,MSCs)移植。前者用于自身免疫性疾病的治疗,在短期内显示出一定的疗效,但该方法费用高,且患者经历化疗药物预处理后不良反应大,长期随访复发率高,目前临床已不推荐使用该疗法[1]。MSCs则由于低免疫原性、无免疫排斥[2]、多向分化潜能、免疫调节、造血支持等优点,已作为新的治疗方法应用于难治性和重症自身免疫性疾病的治疗。
MSCs的免疫调节作用主要通过抑制T淋巴细胞、B淋巴细胞、自然杀伤细胞(natural killer cells,NKs)和树突状细胞(dendritic cells,DCs)的增殖与活化来发挥[3-4]。关于MSCs进一步调节B、T淋巴细胞和巨噬细胞的机制,可参见本期《间充质干细胞移植在治疗自身免疫性疾病中的应用进展》一文。目前,国内外关于MSCs移植治疗自身免疫性疾病的研究主要集中在多发性硬化症,其次是RA、SLE和狼疮性肾炎(lupus nephritis,LN)(数据来源:https://clinicaltrials.gov/,检索截止日期:2019年2月)。临床结果显示,在各疾病采用一线治疗后加用MSCs疗法,安全且有效,治疗后患者复发率低。尽管MSCs移植在传统方法治疗无效的免疫性疾病患者中显示出良好的临床疗效,且未出现严重的不良反应,但考虑到患者的移植疗效存在个体差异,有关适用对象的选择标准以及临床应用的给药途径、剂量、频次等均未形成共识或指南,未来需要进一步大规模的临床试验以指导其应用。
2 生物制剂
生物制剂是一类针对机体免疫、炎症调节分子或以受体为靶点的单克隆抗体或天然抑制剂的重组产物,具有良好的免疫调节及抗炎活性。在自身免疫性疾病中,生物制剂靶向作用于细胞因子和免疫细胞,通过特异性地针对某一类炎症介质,阻断疾病的炎症进程,从而改善及控制病情。根据作用的靶点不同,生物制剂主要分为3类:1)抗细胞因子活化的生物制剂;2)针对B淋巴细胞的生物制剂;3)针对T淋巴细胞的生物制剂。此外,还有一些针对辅助性T细胞17(T helper cell 17,Th17)的生物制剂或合成肽免疫原也进入风湿免疫疾病的临床试验或临床治疗,具体见表1。
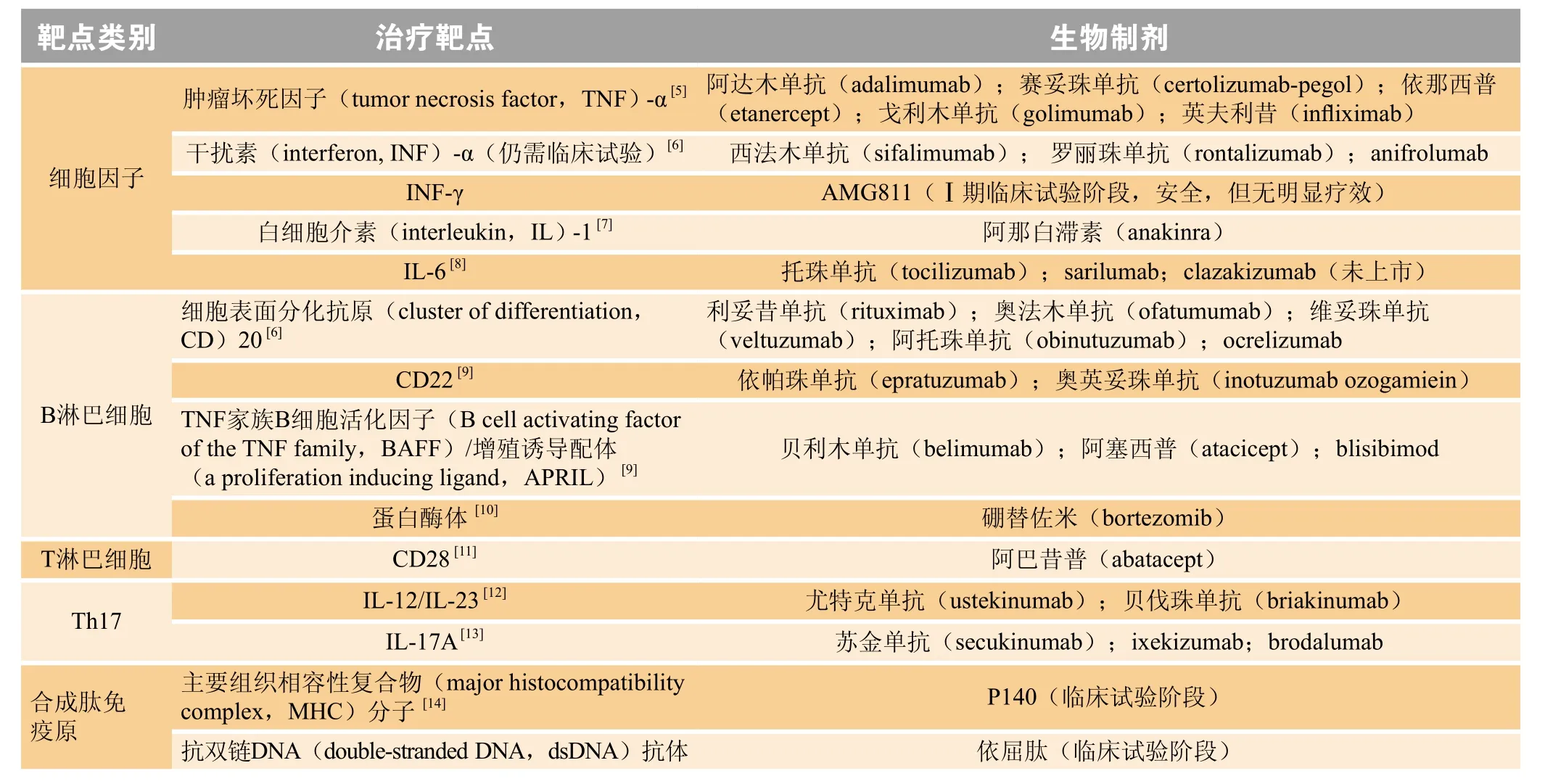
表1 目前用于自身免疫性疾病治疗的生物制剂Table 1 Biological agents for autoimmune diseases
目前,生物制剂在临床上主要用于治疗RA、银屑病关节炎(psoriatic arthritis,PsA)、强直性脊柱炎(ankylosing spondylitis,AS)以及 SLE。TNF-α抑制剂在RA、PsA和AS中的临床使用频率最高。当患者初次使用TNF-α抑制剂治疗失败或经历不良事件,原则上换用另一种TNF-α抑制剂,若出现严重副作用或经历2次及以上使用TNF-α抑制剂失败,则选用除TNF-α抑制剂以外的其他生物制剂。目前RA患者在非TNF-α抑制剂靶向生物制剂中,会首选利妥昔单抗和托珠单抗[15]。SLE患者常用针对B淋巴细胞的生物制剂,贝利木单抗是首个被美国FDA批准用于治疗SLE的生物制剂,2项Ⅲ期临床试验(BLISS-52和BLISS-76)[16-17]均证实其可缓解SLE患者症状并改善预后;而利妥昔单抗对不能耐受或传统疗效不佳或严重脏器受累的难治性SLE疗效较佳[18]。
理论上,表1中针对各治疗靶点的生物制剂对自身免疫性疾病应有一定改善作用,但免疫疾病发病机制复杂,这些生物制剂的疗效及安全性尚需未来高质量的临床多中心随机对照试验进行验证。
3 改善病情的抗风湿药物
目前,DMARDs仍是临床上治疗自身免疫性疾病的基本药物。鉴于同一治疗方案在不同个体中显示的疗效和不良反应差异大,研究者们将目光投向遗传药理学,希望通过基因标志物的测定助推个体化给药。传统DMARDs主要包括甲氨蝶呤(methotrexate,MTX)、羟氯喹(hydroxychloroquine,HCQ)、硫唑嘌呤(azathioprine,AZA)和柳氮磺吡啶(sulfasalazine,SSZ)等。新型DMARDs包括环孢素(cyclosporine A,CsA)、霉酚酸酯(mycophenolate mofetil,MMF)、来氟米特(leflunomide,LEF)等。其中,有关MTX、HCQ、SSZ和LEF的基因多态性研究已于本期《传统合成改善病情抗风湿药的遗传药理学研究进展》一文中详细阐述,现对余下3类DMARDs的基因多态性研究进行补充。
3.1 传统改善病情的抗风湿药物的基因多态性研究
AZA是巯基嘌呤的1-甲基-4-硝基咪唑-5-基衍生物,在免疫性疾病中的应用对象主要是炎症性肠病(in flammatory bowel disease,IBD)患者[19-20],此外,该药也用于妊娠的SLE患者、自身免疫性肝炎(autoimmune hepatitis,AIH)及SS等疾病的患者。该药的优势在于其经济性、妊娠安全性及低肝毒性,但是,仍有约10% ~ 30%的患者服药后因AZA相关的不良反应而停药,其中以白细胞减少最为常见[21-23],并且这一严重不良反应在亚洲人群的发生率较高[24-26]。
为了评估患者服用AZA发生骨髓抑制的风险,建议患者用药前进行AZA代谢相关酶的基因检测,包括硫嘌呤甲基转移酶(thiopurine methyltransferase,TPMT)和核苷酸焦磷酸酶15(nucleotide triphosphate diphosphatase 15,NUDT15)。前者是FDA推荐的监测位点,但在中国人群的突变频率低[27-30]。一项涉及87名在笔者所在医院风湿免疫科就诊并服用AZA的患者的研究结果提示:TPMT*3C的基因突变频率仅为4.6%,而NUDT15R139C的突变频率达到32.1%,NUDT15R139C突变与服用硫唑嘌呤导致白细胞减少显著相关[31]。中国IBD治疗药物监测专家共识[32]中推荐患者用药前进行NUDT15基因多态性检测,以预测用药后骨髓抑制的风险,但研究结果是否适用于其他免疫性疾病有待多中心的大样本研究。
3.2 新型改善病情的抗风湿药物的基因多态性研究
3.2.1 环孢素CsA是一种钙调磷酸酶抑制剂,通过影响细胞因子的转录从而抑制T淋巴细胞活化,发挥免疫抑制作用。CsA体内代谢的肝药酶主要是细胞色素P450(cytochrome P450,CYP450)3A4 和 CYP3A5,经肠道时部分药物还会被P-糖蛋白(P-glycoprotein,P-gp)泵出胞外,减少药物的吸收。研究表明CYP3A5*3突变型纯合子患者的血药浓度更高[33-34],CYP3A4*1B、*18B等位基因携带者可能有药物清除率升高的趋势[35-37],CYP3A4*22携带者则显示出较高的剂量调整浓度[38-39]。编码P-gp的ABCB1基因中的3种多态性,即C1236T、G2677T/A和C3435T,对CsA代谢及疗效的影响较小[40-42],未来研究可以针对单倍型进行分析。此外,一些参与调节CYP活性或CsA药理作用发挥路径中涉及的分子,包括过氧化物酶体增殖剂激活受体α(peroxisome proliferators-activated receptor alpha,PPAR-α)[43]、CYP450 氧化还原酶(cytochrome P450 oxidoreductase,POR)[44]、孕烷X受体(pregnane X receptor,PXR)[45]及甲酰肽受体 1(formyl peptide receptor 1,FPR1)[46]的基因多态性,也可能对CsA的代谢及疗效产生影响。然而,目前研究多在脏器移植患者中开展,考虑到CsA在风湿免疫疾病中的普遍应用,未来应以自身免疫性疾病患者为研究对象开展CsA基因多态性的研究。
3.2.2 霉酚酸酯MMF口服后快速脱酯化为活性产物霉酚酸(mycophenolic acid,MPA),作用于次黄嘌呤单磷酸脱氢酶(inosine-5′-monophosphate dehydrogenase,IMPDH),抑制T、B淋巴细胞增殖,临床上常用于治疗SLE、LN,并能改善硬皮病患者的间质性肺炎[47]。MPA是肝脏尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronosyl transferaseenemy,UGT)的底物,可被转化为无活性产物7-O-葡萄糖苷酸霉酚酸(7-O-MPA-glucuronide,MPAG)和少部分的酰基葡萄糖苷酸霉酚酸(MPA acyl glucuronide,Ac MPAG),后者可能与MPA不良反应有关[48]。进入血液循环的MPA代谢物经肾小管上皮细胞外排,此过程涉及ATP结合盒亚家族C2(ATP-binding cassette subfamily C member 2,ABCC2)及可溶性阴离子转运体(solute carrier organic anion transporter,SLCO)家族[49]。因此,当前与MMF药动学相关的基因多态性研究主要集中在代谢酶 UGT1A9[50-52]、1A8[50,52]、2B7[52-54]亚家族,以及转运酶ABCC2[55-56]和SLCO1B1[57]、1B3[56]亚家族。而MMF的作用靶点IMPDH[58]的基因多态性也常被研究与药物药效学相关性。鉴于国外研究的对象主要为器官移植患者,且国内相关研究缺乏,未来需要从大规模多中心的临床研究来探索中国人基因多态性与MMF药动学及药效学相关性。
3.3 生物类改善病情的抗风湿药物的基因多态性研究
生物类DMARDs,即改善病情的抗风湿药物生物制剂。目前有关生物类DMARDs的遗传药理学研究不多,主要集中于TNF-α抑制剂。研究表明:与RA易感性相关的遗传变异与TNF-α抑制剂治疗的反应无显著相关性,包括CD28基因的rs1980422和CCL21基因的rs2812378等[59]。一项涉及65名使用阿达木单抗/英夫利昔单抗的银屑病患者的研究显示:包括jagged 2(JAG2)和 adrenoceptor alpha 2A(ADRA2A)基因在内的10个单核苷酸多态性,与抗TNF-α药物的治疗应答相关[60]。依那西普在银屑病中的应答情况与CD84基因多态性(rs6427528)之间也有强烈关联[61]。尤特克单抗是针对Th17的生物制剂,有研究证实人类白细胞抗原(human leukocyte antigen,HLA)-Cw 6可预测患者对尤特克单抗的反应,而IL12Brs6887695 GG基因型表达和rs3212227 非AA基因型表达显著增加了HLA-Cw6阳性患者治疗成功的可能性[62]。
由于生物制剂的疗效和安全性仍待进一步验证,未来更明确的药理学作用可能有助于确定影响生物制剂应答的相关基因多态性。
4 植物药制剂
植物药制剂是我国特有的一类传统DMARDs。该类药是从传统中药中提取的具有抗炎及免疫调节作用的活性成分,常见的具有调节免疫功能的中药活性成分包括苷类、多糖、生物碱及黄酮类。其中,雷公藤多苷片和白芍总苷片对机体的免疫抑制作用较为典型,目前在临床上已被广泛应用于自身免疫性疾病的治疗。研究发现,不同剂量雷公藤总苷可显著抑制小鼠脾淋巴细胞转化[63],阻断T细胞的活化信号[64],并抑制外周血单核细胞IL-13的释放[65]。芍药苷可以下调胶原诱导的关节炎模型小鼠IL-6和IL-12水平,抑制DCs成熟,从而下调Th1和Th17细胞数和百分比[66];白芍总苷对Th细胞的这种抑制作用在临床患者中也得到了验证[67]。
目前,还有大量中药经临床前试验证实具有免疫调节作用,有望成为抗风湿免疫病的候选药物。研究显示柴胡总苷可抑制刀豆素A诱导的小鼠T细胞增殖,并减少其释放 IL-2、IFN-γ、TNF-α[68]。丹参多糖则通过抑制IFN-α及IL-1β mRNA基因表达发挥免疫抑制作用[69]。Xu等[70]的研究表明钩吻碱可对刀豆素A诱导的T淋巴细胞及脂多糖(lipopolysaccharide,LPS)诱导的B淋巴细胞产生抑制增殖作用。维药槌果藤则在治疗RA模型大鼠研究中显示了下调TNF-α、IL-17a水平的作用,效果与雷公藤相当[71-73]。此外,雪菊的黄酮类、苯丙素类、倍半萜类和甾醇类成分展现了良好的抗炎、抗氧化作用[74],也为发掘雪菊抗痛风潜力提供药效学基础。
中医药凝聚了中华民族几千年来的实践经验,是中国古代科学的瑰宝。但其要在现代科学文明背景下取得突破并走向世界,必须借助现代技术与试验方法提取、分离和纯化出有效成分,并明确药效机制。相信未来更多高质量的科学实验数据将作为支撑,从而推动将中药作为免疫调节剂的新药研发。
5 具有免疫调节作用的药物
维生素D是一种脂溶性维生素,常用于抗佝偻病,在体内经肝肾代谢为生物作用形式——1,25-二羟基维生素 D3[1,25-dihydroxyvitamin D3,1,25(OH)2D3]。近来发现1,25(OH)2D3与自身免疫相关,具有多种免疫调节、抗炎和免疫抑制特性。研究表明:SLE、RA、多发性硬化症、克罗恩病和溃疡性结肠炎等自身免疫性疾病患者的维生素D水平较低,并且低维生素D水平与疾病严重程度相关[75]。补充维生素D有助于免疫系统下调Th1细胞、上调Th2细胞,减少自身免疫反应的发生。体内外研究发现,1,25(OH)2D3的免疫调节和免疫抑制效应包括:减少IL-2、IL-12和IL-6的产生;减少INF-γ的产生;下调TNF水平;上调IL-4、IL-5 IL-10水平;抑制B淋巴细胞分泌和产生自身抗体[76]。此外,考虑到一些研究表明维生素D3对抗原呈递细胞、活化的T/B淋巴细胞的作用基于存在于这些细胞中的维生素D受体,未来应关注维生素D受体激动剂在开发辅助自身免疫性疾病治疗方面的潜力。
辅酶Q10(coenzyme Q10,CoQ10)是一种人体内合成的脂溶性抗氧化剂,该酶有一定抗炎作用,并能促进免疫系统功能,是一种常见的膳食补充剂。Jhun等[77]的研究结果提示,CoQ10与二甲双胍联用能改善小鼠胶原诱导的关节炎以及线粒体功能障碍。对酵母多糖诱导的关节炎小鼠予以CoQ10处理,观察到CoQ10减轻关节炎的严重程度并降低了血清免疫球蛋白浓度,同时减少了Th17细胞和破骨细胞的分化,表明CoQ10可能是RA的潜在治疗物质[78]。同一研究团队还验证了益生菌复合物、锌和CoQ10的组合对胶原诱导的关节炎模型小鼠的疗效,结果显示该组合疗法通过抑制促炎细胞因子的表达、调节Th17/Treg平衡改善了自身免疫性关节炎,可作为RA治疗的重要候选物。
6 展望
自身免疫性疾病常用的糖皮质激素、免疫抑制剂等药物,其临床疗效在大多数患者中得到了验证,但长期用药可能引发一系列不良反应,并且考虑到受累器官对不同免疫抑制剂的敏感性存在差异,个体化的药物选择将是一个难题,需要临床医生结合患者的临床表现类型使用适宜的制剂。以狼疮为例,其治疗方案的选择可参考本期《免疫抑制药物在重症狼疮中的应用》一文。新型疗法的开发可为患者提供更多的选择尤其对于一些难治性、重症患者而言,采用几种药物合并治疗的联合疗法值得探究。
目前治疗前景最好的是干细胞移植疗法,临床研究证实其在多种免疫疾病治疗中安全有效,但其对于不同自身免疫性疾病的调控机制有待进一步阐明。参与自身免疫调节相关的药物在临床上已显示出较好的治疗潜力,但其有效性和治疗方案还需要更多大规模的临床前、临床研究证实。生物制剂的优势在于其靶向作用,虽疗效显著,但过敏和严重感染的风险也大,且有研究报道机体可能再产生针对单抗的抗体,存在耐药问题和用药安全等隐患,临床需引起关注。此外,目前生物制剂的价格昂贵。相较之下,中国传统的植物药制剂的开发空间较大,且原药成本低,其主要发展瓶颈在于明确有效成分并进行分析和提纯。综上,这些具有潜力的免疫疗法除需继续确证临床疗效及安全性外更重要的是探索其发挥作用的机制,以期为进一步明确自身免疫性疾病的发病机制、开发类似或有关的可能疗法提供新思路。

