DACT1错义突变与先天性心脏病易感性的相关性研究
王 鹤 彭 瑞 段文元 王红艳, 姚晓英
先天性心脏病(CHD)在新生儿中发病率约0.9%[1, 2]。Wnt信号通路是调控心脏发育的重要信号通路之一,主要包括经典的Wnt/β-catenin信号通路、非经典的平面细胞极性(PCP)信号通路和Wnt/Ca2+信号通路。Dishevelled(DVL)蛋白在这3条Wnt信号通路中均发挥重要作用,是Wnt信号通路的一个中枢调节蛋白[3, 4]。Wnt信号通路的失调会导致早期心脏发育异常或CHD[5-8]。
DACT1基因编码的DACT1蛋白是Wnt信号通路的负调控因子。DACT1与DVL蛋白相互结合并在细胞内共定位,且与Axin、GSK-3、CKI、β-catenin组成复合体[4]。DACT1主要通过拮抗DVL2的功能发挥作用。DACT1蛋白可促进VHL与DVL2互作,加速DVL2泛素化,从而介导因蛋白聚集引发的自噬,降解DVL2[9]。过表达非洲爪蟾XDpr(DACT1同源基因)会抑制Dvl介导的经典和非经典Wnt信号通路,同时降低β-catenin应答基因及JNK活性;反之,抑制内源性XDpr基因表达,β-catenin和JNK信号通路都被激活[4]。在非洲爪蟾卵细胞中敲低XDpr后,亦有类似Wnt信号通路过度激活的表型,表现为脊索和头部结构缺失[4];敲除小鼠Dact1基因,PCP信号通路失调,纯合突变小鼠几乎在出生后1 d内全部死亡,泌尿生殖系统和消化道发育异常,部分新生小鼠还存在脊柱裂[10, 11]。人DACT1基因突变或表达失调可导致神经管畸形(NTD)、结肠癌或肝细胞癌[12-14]。但DACT1基因在心脏发育或CHD中的作用还未见报道。本研究拟筛选与CHD相关的DACT1基因突变,并对突变的生物学功能进行初步研究。
1 方法
1.1 伦理和知情同意 本研究方案和外周静脉血的收集均经复旦大学生命科学学院伦理委员会批准[伦研批第(216)号]。受试者或其父母/监护人签署知情同意书。
1.2 病例组来源 2008年8月至2011年1月收集的来自中国山东地区汉族人群的散发CHD的连续就诊患儿,均通过超声心动图或手术明确诊断。排除:①综合征型;②有CHD家族遗传病史。
1.3 对照组来源 与病例组同时期同医院的体检健康儿童(山东地区的汉族人群),经过听诊和影像学检查排除了患有CHD的儿童,同时排除有CHD家族史的儿童。
1.4DACT1基因测序和生物信息学分析 提取外周静脉血基因组DNA(德国Qiagen公司血液基因组DNA提取试剂盒)。靶向DACT1基因编码区进行测序,由江苏基谱生物科技发展有限公司完成(美国illumina公司Hiseq 2000测序仪)。以hg19/GRCh37(NM_016651)为参考序列,使用SNP nexus工具对单核苷酸变异(SNV)进行注释[15]。将获得的所有突变与数据库dbSNP(version137)和千人基因组进行比对,排除已有研究报道的“已知(known)”位点,得到无报道的“新发现(novel)”位点,或未见病例研究的稀有突变位点,并将病例组与对照组SNV进行比对,得到病例特异性的新发现或稀有DACT1错义突变位点,进一步进行Sanger法验证,引物见表1。用SIFT和PolyPhen-2软件分析错义突变位点的有害性,并用GEPR和在线分析软件Clustal Omega进行保守性分析[16, 17]。
1.5 突变相关的生物学功能分析
1.5.1 质粒构建 提取HEK293T细胞(中科院典型培养物保藏委员会细胞库)的总RNA [天根生化科技(北京)有限公司总RNA提取试剂盒],反转录[天根生化科技(北京)有限公司FastQuant cDNA第一链合成试剂盒]后PCR扩增得到人DACT1基因的cDNA。通过酶切、连接反应,将人DACT1编码区序列连接到pcDNA3.1(-)B-myc/his载体(美国Invitrogen公司)上,获得野生型DACT1的表达质粒。在该表达质粒的基础上,设计引物,利用KOD-plus酶(日本Toyobo公司)进行单点突变,从而得到与DACT1错义突变位点一致的点突变质粒。利用同样的方法,将人DVL2基因编码区克隆至载体pCMV6-HA (美国Origene公司)。所有质粒都经过测序验证。PCR反应的引物利用在线引物设计软件Primer3(http://primer3.ut.ee)设计,引物序列见表1。

表1 引物序列
注 测序引物1和2:突变位点验证的测序引物;DACT1和DVL2:构建DACT1和DVL2表达质粒的引物;C1486T、C1598A、G1659C和T1891A为DACT1定点突变引物
1.5.2 蛋白质免疫印迹实验 将HEK293T细胞均匀铺于6孔板,待细胞密度达70%左右时用Lipofectamine 2000[赛默飞世尔科技(中国)有限公司]转染。为检测DACT1突变型的蛋白表达水平,将野生型和突变型DACT1表达质粒分别与pCMV6-AC-GFP质粒(美国Origene公司)共转,GFP作为内参。为检测DACT1突变型蛋白的功能,将野生型和突变型DACT1表达质粒分别与DVL2表达质粒和pCMV6-AC-GFP质粒共转。转染24 h后,收取细胞,裂解后提取蛋白质,用于蛋白质免疫印迹实验,用ECL显影液(上海天能科技有限公司)及化学发光成像系统(上海天能科技有限公司)进行显影和图像纪录。实验中所用抗体包括His标签抗体(美国Proteintech公司,1∶3 000稀释)、HA标签抗体(美国Proteintech公司,1∶3 000稀释)、GFP抗体(美国Origene公司,1∶10 000稀释)、羊抗鼠二抗[艾比玛特生物医药(上海)有限公司,1∶10 000稀释]。
1.5.3 双荧光素酶报告基因实验 经典Wnt信号通路被活化时β-catenin入核,与转录因子TCF/LEF结合形成复合物,促进下游调控基因的转录。质粒Topflash(上海吉满生物科技公司)的荧光素酶报告基因的启动子区包含多个TCF/LEF结合位点,因此Topflash质粒的荧光素酶的强弱直接反应了经典Wnt信号活性。本研究将野生型和突变型DACT1表达质粒分别与报告基因质粒Topflash共转染HEK293T细胞,检测DACT1对经典Wnt信号通路的调控作用。
PCP信号通路被活化时,可以通过JNK激活下游靶蛋白c-Jun。检测PCP信号通路活性时常用的报告基因体系[PathDetect in Vivo Signal Transduction Pathway trans-Reporting Systems (美国Agilent Technologies公司)]包含pFA2-cJun和pFR-luc 2个质粒。表达质粒pFA2-cJun表达的c-Jun被PCP 信号激活时启动报告质粒pFR-luc的荧光素酶报告基因的表达。本研究将野生型和突变型DACT1表达质粒分别与pFA2-cJun、pFR-luc共转染HEK293T细胞,观察DACT1突变对PCP 信号通路的影响。
具体操作:将HEK293T细胞均匀地铺在24孔板中,待细胞密度达70%左右时用 Lipofectamine 2000 [赛默飞世尔科技(中国)有限公司]转染,编码海蜃(renilla)荧光素酶的内参报告质粒pRL-TK(美国Promega公司)被共转染用于校正转染效率。转染24 h后,收取细胞,裂解、离心后,检测上清液中的萤火虫(firely)和renilla荧光素酶活性(美国Promega公司的双荧光素酶报告实验系统)。
1.6 统计学方法 蛋白质免疫印迹实验结果利用ImageJ软件进行灰度分析,灰度分析结果以及双荧光素酶报告基因实验结果都采用双尾非配对t检验分析显著性,P< 0.05为差异有统计学意义。
2 结果
2.1 一般情况 病例组404例,年龄(2.9±2.7)岁;对照组213名,年龄(7.1±3.7)岁;病例组和对照组的男女比例分别为1.2∶1和1∶1。病例组包括圆锥动脉干畸形138例(33.5%)、隔膜缺损138例(33.5%)、右室流出道梗阻44例(10.7 %)、房室间隔缺损21例(5.1%)、动脉导管未闭17例(4.1%)、左室流出道梗阻17例(4.1%)、肺静脉回流异常12例(2.9%),复合型心脏异常10例(2.4%)、心脏异位3例(0.7%)、其他4例(1.0%)。
2.2DACT1基因测序结果分析 通过对两组进行DACT1基因的编码区、5’UTR和3’UTR区域的靶向深度测序分析,在3例CHD中筛选到4个DACT1基因编码区的新发现或稀有的错义突变,为c.1486C>T (p.S441L)、 c.1598C>A (p.S478R)、c.1659G>C (p.E499Q)和c.1891T>A (p.M576K),分别简称为DACT1S441L、DACT1S478R、DACT1E499Q和DACT1M576K。其中DACT1S441L和DACT1S478R来自于同一患儿,分别位于2条不同染色体。DACT1S441L和DACT1E499Q2个错义突变在ExAC数据库中没有报道,为本研究发现的CHD病例特有的新突变;DACT1S478R和DACT1M576K在ExAC数据库有报道,其最小等位基因频率(MAF)分别是8.4×10-6和8.9×10-6,为稀有错义突变 (表2)。对携带这4个突变的CHD病例的DNA样品进行了Sanger测序验证,均为杂合突变(图1A)。
2.3DACT1错义突变氨基酸位点的生物信息学分析 图1B显示,用GERP和Clusstal Omega分析软件对4个突变的氨基酸位点进行保守性分析,DACT1S478R和DACT1E499Q在人、黑猩猩、牛、大鼠、小鼠和羊6个物种中保守性很高,位点DACT1S441L和DACT1M576K无很强保守性。表2显示,用SIFT和PolyPhen-2对突变位点的有害性进行评估,DACT1S441L被SIFT评价为有害突变(0.01);DACT1E499Q被PolyPhen-2评价为可能有害(0.978),DACT1S478R和DACT1M576K被SIFT和PolyPhen-2预测为无有害性。
2.4DACT1突变对DACT1蛋白表达和功能的影响 通过对DACT1WT进行单点突变,分别获得与4个体内突变位点一致的点突变质粒DACT1S441L、DACT1S478R、DACT1E499Q和DACT1M576K。
2.4.1 突变对DACT1蛋白表达水平的影响 在HEK293T细胞中分别表达野生型和突变型DACT1基因并共转pCMV6-AC-GFP作为内参,图2A蛋白质免疫印迹实验显示,4种突变型对DACT1蛋白的表达水平均无明显影响。
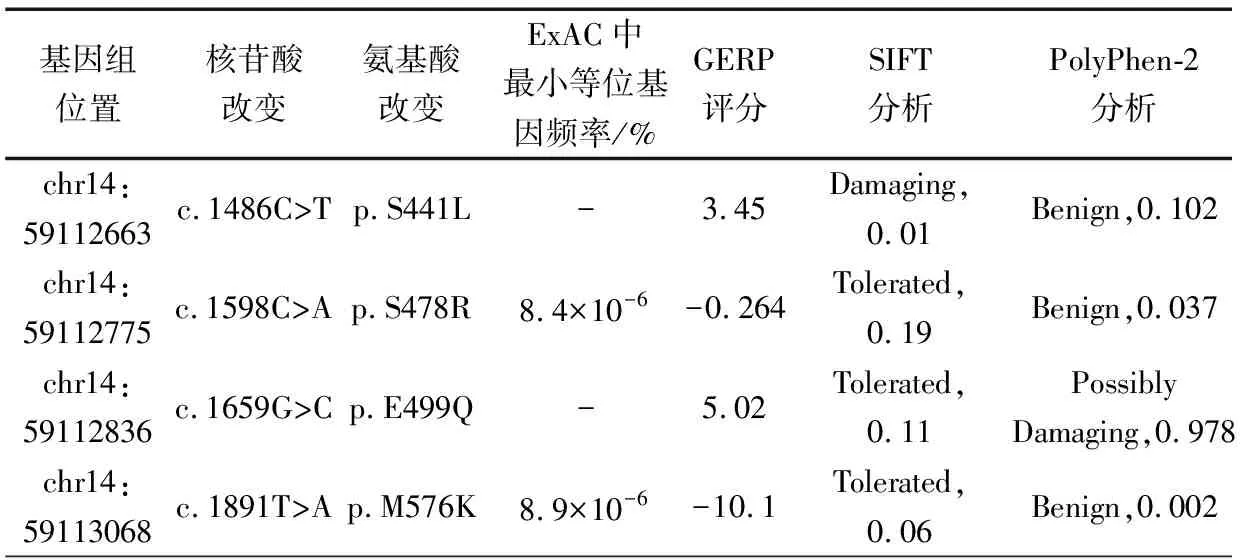
表2 DACT1突变位点信息和生物信息学分析结果
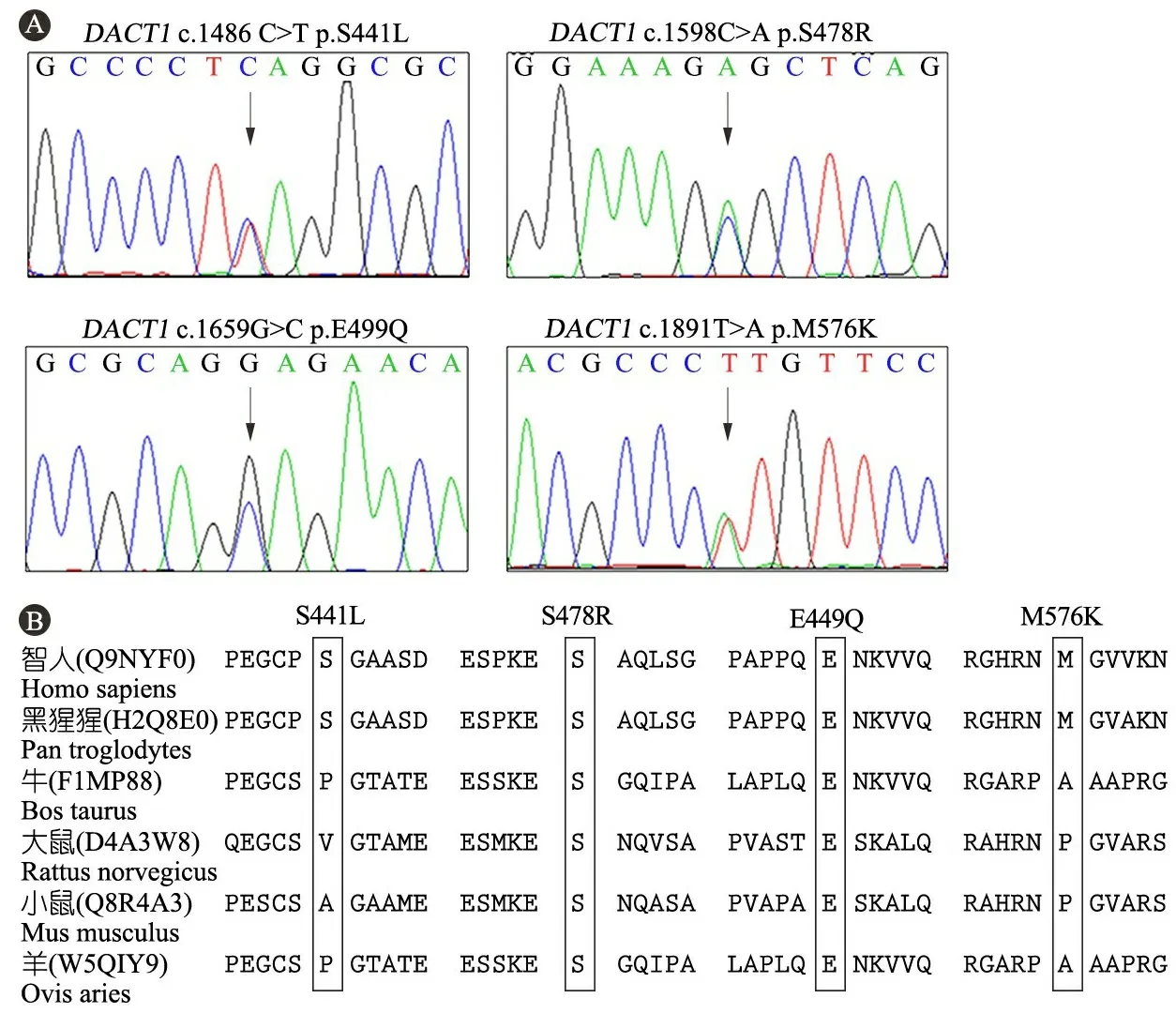
图1DACT1基因CHD病例中特有的4个错义突变位点的保守性分析
注 A: c.1486 C>T(p.S441L),c.1659G>C(p.E499Q),c.1598C>A(p.S478R)和c.1891T>A(p.M576K)突变的Sanger测序结果图,黑色箭头位置为发生突变的位置。 B: 6种脊椎动物中DACT1蛋白部分氨基酸顺序排列,黑框显示突变氨基酸的位置
2.4.2DACT1突变对DVL2蛋白表达的影响 在HEK293T细胞中,将野生型和突变DACT1分别与DVL2共表达,同时共转GFP作为内参,用蛋白质免疫印迹法检测外源DVL2蛋白水平,并利用灰度分析进行计算。图2B显示,与空载的对照组相比,野生型DACT1可以显著下调共表达的DVL2蛋白水平(P<0.05)。与野生型DACT1相比较,DACT1E499Q对DVL2蛋白的下调作用显著减弱(P<0.05),其他3个突变型的DACT1蛋白与野生型相比对DVL2蛋白的作用差异无统计学意义。
2.5DACT1突变对经典Wnt信号通路及PCP信号通路的影响 图2C显示,与对照比较,野生型DACT1显著下调经典Wnt信号通路(P<0.001)和PCP信号通路(P<0.001)的活性;与野生型DACT1相比,DACT1E499Q显著降低了对经典Wnt信号通路(P<0.01)和PCP信号通路(P<0.01)的抑制作用,其他3种突变型DACT1与野生型DACT1相比对2种信号通路的作用差异无统计学意义。
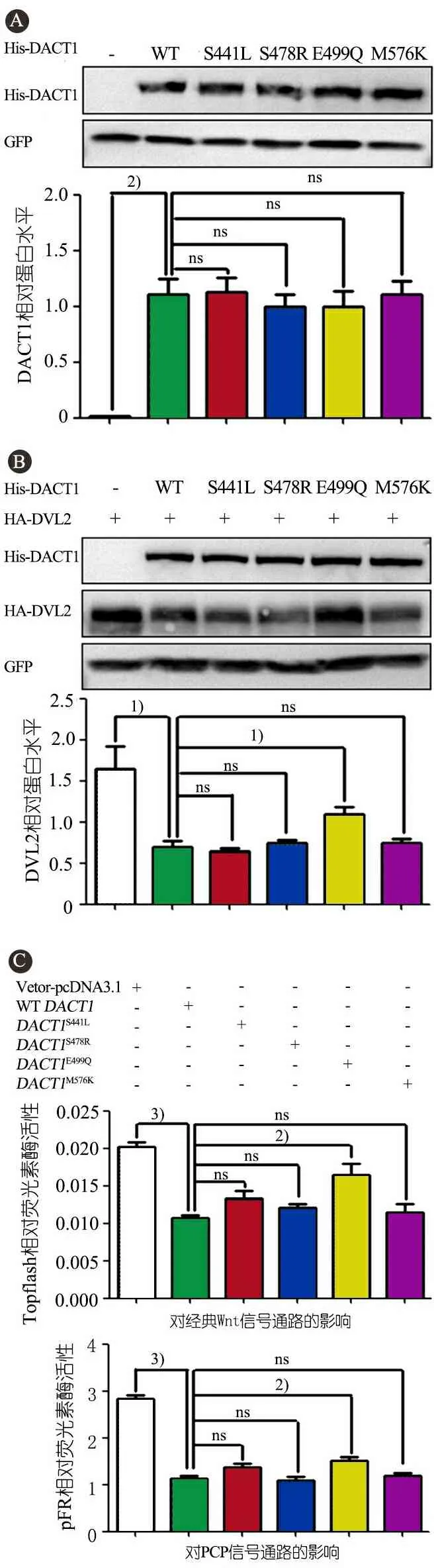
图2DACT1点突变对DACT1、DVL2蛋白表达以及对经典Wnt信号通路和PCP信号通路的影响
注 实验采用HEK293T细胞。A: DACT1蛋白表达;B:DVL2蛋白表达;C:对经典Wnt信号通路的影响;D:对PCP信号通路的影响。1)P<0.05,2)P<0.01,3)P<0.001,ns:差异无统计学意义
3 讨论
Wnt信号通路在胚胎发育中起重要作用。既往已有多项研究探讨了Wnt信号通路在哺乳动物心脏形成和心肌细胞分化中的作用,Wnt信号通路的精确调控对于哺乳动物的心脏发育过程有重要意义[18]。DVL2在Wnt信号通路的调节中处于中枢位置,在β-catenin依赖的经典Wnt信号通路和β-catenin不依赖的非经典Wnt信号通路中都发挥重要作用[3]。Dvl2敲除的小鼠实验结果显示Dvl2为心脏锥体动脉发育中的关键介质[6]。DACT1可通过与DVL2互作,加速其降解,以此调节Wnt信号通路。虽然DACT1对Wnt信号通路的调节作用已有研究,但对DACT1在CHD发生的过程中是否有贡献作用,尚无相关报道。
本研究中通过对404例散发CHD病例和213名健康对照的DACT1基因进行靶向测序,筛选出2个病例特有的新杂合错义突变DACT1S441L和DACT1E499Q,以及2个病例特有的稀有杂合错义突变DACT1S478R和DACT1M576K。蛋白质免疫印迹实验及双荧光素酶报告基因实验的结果表明,突变型DACT1E499Q对DVL2蛋白的下调水平减弱,并显示出对经典Wnt信号通路和PCP信号通路的抑制作用的部分丧失。表明DACT1E499Q突变可能是散发CHD的风险因素。
散发的CHD是性状复杂的疾病,通常是许多基因或者1个基因的多个等位基因和环境共同作用导致最终的疾病表型。通常有两种假说用于解释CHD,分别为常见疾病/常见突变和常见疾病/稀有突变。前者认为,少数基因座位上的常见等位基因相互作用会导致疾病发生,而后者认为许多基因座上的罕见等位基因可以单独引起疾病[19]。已有研究表明,这两种假设都是正确的,主要取决于研究的疾病和基因的不同[20]。 因此,本研究在病例中鉴定出的错义突变位点DACT1S441L、DACT1S478R和DACT1M576K,未观察到对DVL2蛋白水平和功能的影响,原因之一可能为,在病例体内复杂的环境中,这些突变位点与其他基因的突变协同作用而共同促进CHD的发生。为了验证本文结论,可扩大测序样本量,并用合适的动物模型行体内实验。
致谢
本研究工作得到了复旦大学现代人类学教育部重点实验室和复旦大学遗传工程国家重点实验室的技术支持。

