酸枣仁中斯皮诺素对睡眠剥夺大鼠下丘脑MCH、 Orexin-A 表达的影响
廖丹琼, 储利胜, 张建平, 方 燕, 李 琳, 周 青
(1. 浙江中医药大学临床实践教学中心, 浙江 杭州 310053; 2. 浙江中医药大学基础医学院生理学教研室, 浙江 杭州 310053; 3. 浙江中医药大学基础医学院人体解剖与组织胚胎学教研室, 浙江 杭州 310053)
睡眠疾病可严重影响生活质量, 降低工作效率, 随着生活节奏加快及生活方式改变, 其发病率不断升高, 据报道, 严重失眠症的发生率约为9.38%, 全球27%左右的患者受其困扰[1]。 目前, 临床治疗失眠症的药物主要是化学合成类镇静催眠药, 但长期使用会产生不良反应和依赖性[2]。
酸枣仁为鼠李科植物酸枣Ziziphus jujuba Mill. var.spinosa (Bunge) Hu ex H. F. Chow 的干燥成熟种子, 性味甘、 酸、 平, 归肝、 胆、 心经, 具有养心补肝、 宁心安神、敛汗、 生津等功效, 是公认的有效安神药, 所含黄酮类成分斯皮诺素是发挥镇静催眠作用的主要活性物质[3], 研究表明[4], 给予大鼠低于睡眠剂量的戊巴比妥后, 斯皮诺素可显著诱发睡眠, 并呈剂量依赖性地增强戊巴比妥诱导睡眠, 缩短睡眠潜伏期, 延长睡眠时间, 但其作用机制尚不清楚。 因此, 本实验采用改良多平台睡眠剥夺法建立失眠模型, 观察酸枣仁有效活性成分斯皮诺素对大鼠下丘脑黑色素浓集激素(MCH) 和食欲素-A (Orexin-A) 表达的影响, 初步探讨该成分改善睡眠的可能作用途径, 为失眠症临床治疗提供高效、 安全的治疗方案。
1 材料
1.1 动物 健康雄性SD 大鼠120 只, 体质量200~250 g,由上海斯莱克实验动物有限公司提供, 动物生产许可证号SCXK (沪) 2017-0005。
1.2 试药 斯皮诺素(成都克洛玛生物科技有限公司, 批号72063-39-9, 含有量99%); 地西泮(北京益民药业有限公司, 国药准字H11020897, 2.5 mg/片); 一抗MCH 山羊(货号SC-14509)、 一抗Orexin-A 山羊 (货号SC-8070)(美国Santa cruz Biotechnology 公司); 二抗Alexa fluor 488驴抗山羊 (货号705-545-147)、 驴血清 (货号017-000-121) (北京吉比埃生物技术有限公司); 大鼠MCH ELISA试剂盒(上海江莱生物科技有限公司, 货号JL21041); 大鼠Orexin-A ELISA 试剂盒(上海远慕生物科技有限公司,货号YM-SZ1838); RNA 提取试剂(Trizol 试剂盒) (美国Invitrogen 公司, 货号15596018); β-actin (碧云天生物技术研究所, 货号H015); RT-PCR 试剂盒(上海美吉生物医药科技有限公司, 货号DPRT-20)。
1.3 仪器 纯水器(2000D 型, 北京长风仪器仪表公司);倒置相差显微镜(TE2000-S 型, 日本Nikon 公司); 冰冻切片机(德国Leica 公司); 实时定量PCR 仪(美国Stratagene 公司); Multiskan Ascent 酶标仪(美国Thermo 公司)。
2 方法
2.1 造模 采用改良多平台睡眠剥夺法[5]。 将大鼠置于设有水槽平台的睡眠记录箱内, 平台周边注满水, 大鼠在平台上可自行摄食饮水, 并可在平台间活动, 当它们进入睡眠状态时, 由于全身肌肉张力降低后头部触水而惊醒, 共进行睡眠剥夺72 h。
2.2 分组 60 只大鼠按数字表法随机分为对照组、 模型组、 地西泮组、 斯皮诺素组, 每组30 只。 对照组大鼠于模型组相同时间点放入正常环境的睡眠箱(未设置水槽平台) 内常规饲养, 给予生理盐水; 模型组大鼠造模后给予生理盐水; 地西泮组大鼠造模后给予地西泮(0.8 mg/kg),1 次/d; 斯皮诺素组大鼠造模后给予斯皮诺素(15 mg/kg), 给药组均按10 mL/kg 体积于晚上19: 00 灌胃给药, 对照组、 模型组于同时间点给予等体积生理盐水,连续2 d。
2.3 大鼠下丘脑MCH 阳性反应表达检测 末次给药后4 h, 大鼠腹腔注射10%水合氯醛麻醉, 立即断头处死, 取全脑, 脑组织经固定、 蔗糖脱水、 OCT 包埋后切片, 厚度30 μm, 置于PBS 缓冲液中, 4 ℃下保存。 然后, 切片浸入PBS 缓冲液中漂洗, 10%驴血清、 0.3%Triton-X-100 封闭液处理30 min, 加入一抗混合液[含5%驴血清、 0.3%Triton-X-100、 山羊抗MCH (1 ∶2 000) 或Orexin-A (1 ∶2 500)的PBS 缓冲液], 4 ℃下孵育过夜, 漂洗, 用含5%驴血清、0.3%Triton-X-100、 Alexa Fluor488 驴抗山羊IgG 荧光二抗(1 ∶1 000) 的PBS 缓冲液避光孵育2 h, 漂洗, 裱片, 封片, 荧光显微镜下观察。 再应用多功能真彩病理图像系统,分析各组MCH、 Orexin-A 阳性表达的光密度、 面密度、 阳性细胞数。
2.4 大鼠下丘脑MCH、 Orexin-A mRNA 表达检测 末次给药后4 h, 大鼠腹腔注射10%水合氯醛麻醉, 立即断头处死, 取全脑, 冰台上剥离下丘脑组织, Trizol 法提取总RNA, 以RNA 为模板将其逆转录成cDNA; PCR 扩增按照相应试剂盒说明书操作步骤进行, 反应体系为20 μL, 冰上依次加入逆转录产物cDNA 1 μL、 引物1 μL、 TaqMan GEx MASTER Mix 10 μL, 加双蒸水补至20 μL。 以β-actin为内 参, 正 向5′-CGAGCTGTCTTCCCATCCA-3′, 反 向5′-TCACCAACGTAGCTGTCTTTCTG-3′, 扩增基因片段320 bp;MCH 正向5′-ATGAAGCTTTCCGTTGGTA-3′, 反 向5′-CTACACTTCCCAGCAAGGTC-3′, 扩增基因片段175 bp; Orexin-A 正 向 5′-ATTCGGTCTGCCTGTCCC-3′, 反 向 5′-ACCGCAACCGCCTTAGCT-3′, 扩增基因片段215 bp, 扩增条件为95 ℃预变性5 min, 95 ℃反应30 s, 60 ℃反应30 s, 共40个循环。 然后, 扩增产物通过琼脂糖凝胶中电泳, 在凝胶图像扫描系统中检测其吸光度, 分别计算MCH、 Orexin-A吸光度与β-actin 吸光度的比值, 以此表示最终结果。
2.5 大鼠下丘脑MCH、 Orexin-A 水平 将下丘脑组织置于生理盐水中煮5 min, 充分匀浆, 匀浆液置于EP 管中,室 温 下 放 置 2 h, 加 入 NaOH 处 理, 4 ℃下 离 心(3 000 r/min) 10 min, 吸取上清液置于EP 管中备用, 按照ELISA 试剂盒说明书操作步骤检测MCH、 Orexin-A 水平。 将0.1 mL 稀释待测样品加于已包被反应孔中, 37 ℃下温育1 h, 30 倍蒸馏水稀释浓缩, 每孔加入洗涤液, 静置30 s 后弃去, 重复3 次, 拍干, 再加入0.1 mL 酶标抗体, 37 ℃下孵育0.5~1 h, 洗涤, 每孔依次加入显色剂A、B 各50 μL, 轻轻振荡混匀, 37 ℃下避光显色15 min, 再加入终止液50 μL终止反应, 空白孔调零, 450 nm 波长处测定吸光度。
2.6 统计学分析 通过SPSS 17.0 软件进行处理, 数据用s) 表示, 组间比较采用t 检验; 以P<0.05 为差异有统计学意义。
3 结果
3.1 斯皮诺素对MCH 阳性表达的影响 图1 显示, 在大鼠下丘脑外侧区, 4 组均可观察到MCH 阳性表达, 主要位于细胞质和细胞膜, 其中对照组、 地西泮组、 斯皮诺素组较明显, 而模型组呈散在分布, 表达较少。 表1 显示, 与对照组比较, 模型组大鼠下丘脑MCH 阳性表达光密度、 面密度、 细胞数显著减少(P<0.01); 与模型组比较, 斯皮诺素组三者显著增加(P<0.01)。
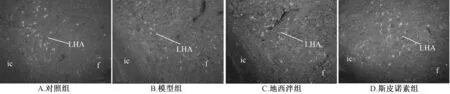
图1 斯皮诺素对MCH 阳性表达的影响
表1 斯皮诺素对MCH 阳性表达的影响(s, n=10)

表1 斯皮诺素对MCH 阳性表达的影响(s, n=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,##P<0.01
组别 光密度/% 面密度/% 阳性细胞数/个对照组 203.52±25.04 277.92±30.36 43.56±5.58模型组 65.41±11.12∗∗ 105.40±15.99∗∗ 22.15±5.43∗∗地西泮组 122.10±15.33## 165.14±19.05## 33.09±5.63##斯皮诺素组 121.43±15.87## 164.03±20.13## 33.03±5.04##
3.2 斯皮诺素对Orexin-A 阳性表达的影响 图2 显示, 在大鼠下丘脑外侧区, 4 组均可观察到Orexin-A 阳性表达,主要位于细胞质和细胞膜, 其中模型组呈密集型分布, 表达增加, 而对照组、 地西泮组、 斯皮诺素组呈散在分布,表达减少。 表2 显示, 与对照组比较, 模型组Orexin-A 阳性表达的光密度、 面密度及细胞数显著增加(P<0.01);与模型组比较, 斯皮诺素组三者显著减少(P<0.01)。
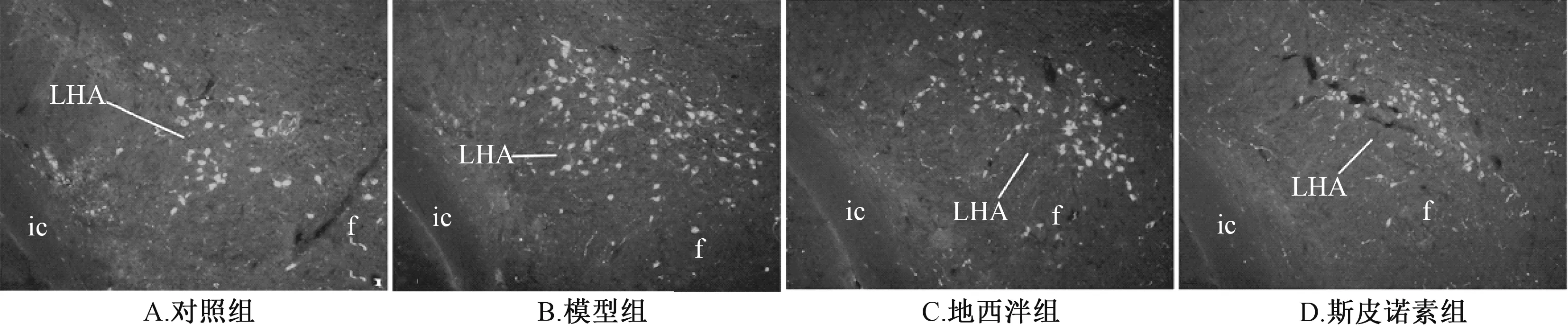
图2 斯皮诺素对Orexin-A 阳性表达的影响
3.3 斯皮诺素对MCH、 Orexin-A mRNA 表达的影响 表3显示, 与对照组比较, 模型组MCH mRNA 表达显著降低,Orexin-A mRNA 表达显著升高(P<0.01); 与模型组比较,斯皮诺素组前者mRNA 表达显著升高, 后者mRNA 表达显著降低(P<0.01)。
表2 斯皮诺素对Orexin-A 阳性表达的影响s, n=10)
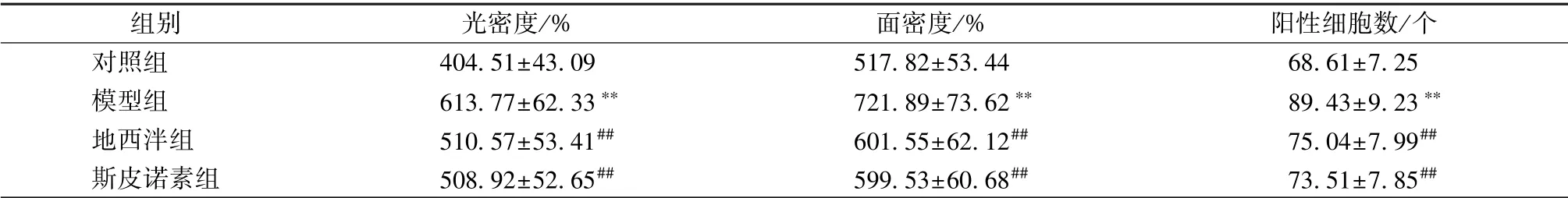
表2 斯皮诺素对Orexin-A 阳性表达的影响s, n=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,##P<0.01
对照组 404.51±43.09 517.82±53.44 68.61±7.25模型组 613.77±62.33∗∗ 721.89±73.62∗∗ 89.43±9.23∗∗地西泮组 510.57±53.41## 601.55±62.12## 75.04±7.99##斯皮诺素组 508.92±52.65## 599.53±60.68## 73.51±7.85##
表3 斯皮诺素对MCH、 Orexin-A mRNA 表达的影响0)
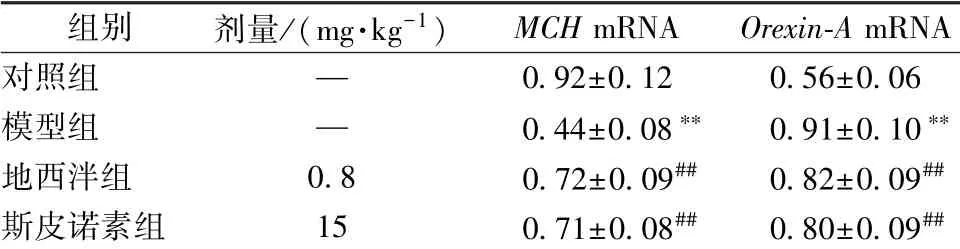
表3 斯皮诺素对MCH、 Orexin-A mRNA 表达的影响0)
注:与对照组比较,∗∗P<0.01;与模型组比较,##P<0.01
对照组 — 0.92±0.12 0.56±0.06模型组 — 0.44±0.08∗∗ 0.91±0.10∗∗地西泮组 0.8 0.72±0.09## 0.82±0.09##斯皮诺素组 15 0.71±0.08## 0.80±0.09##
3.4 斯皮诺素对MCH、 Orexin-A 水平的影响 表4 显示,与对照组比较, 模型组MCH 水平显著降低, Orexin-A 水平显著升高(P<0.01); 与模型组比较, 斯皮诺素组前者水平显著升高, 后者水平显著降低(P<0.01)。
表4 斯皮诺素对MCH、 Orexin-A 水平的影响, n=10)
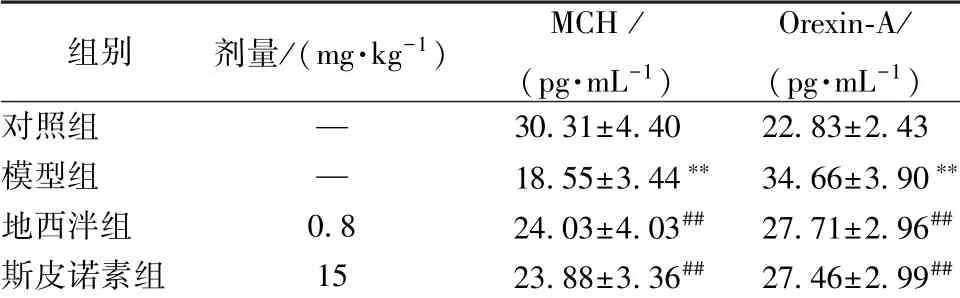
表4 斯皮诺素对MCH、 Orexin-A 水平的影响, n=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,##P<0.01
组别 剂量/(mg·kg-1) MCH /(pg·mL-1)Orexin-A/(pg·mL-1)对照组 — 30.31±4.40 22.83±2.43模型组 — 18.55±3.44∗∗ 34.66±3.90∗∗地西泮组 0.8 24.03±4.03## 27.71±2.96##斯皮诺素组 15 23.88±3.36## 27.46±2.99##
4 讨论
文献报道, 大鼠预先(注射戊巴比妥24 h 前) 给予对氯苯丙氨酸后, 可明显缩短戊巴比妥诱导的睡眠时间, 延长睡眠潜伏期, 而斯皮诺素能减弱上述失眠效应, 减少睡眠潜伏期, 延长睡眠时间[4]。 李佳虹等[3]利用受体配体结合技术的原理, 结合HPLC、 LC-MS/MS 技术研究酸枣仁中镇静催眠活性成分, 发现斯皮诺素可与地西泮竞争结合脑组织中苯二氮艹卓受体, 可能发挥了类似的镇静催眠作用。由此推测, 斯皮诺素对睡眠剥夺所致失眠发挥了改善作用,但具体作用机制尚不明确。
MCH 神经元主要位于下丘脑外侧区, 少量散在分布于未定带区域, 其所发出的轴突广泛分布于大脑各个区域,如弓状核、 背内侧核、 室旁核、 腹内侧核, 以及下丘脑以外脑区, 如嗅区、 海马、 基底核和中隔、 网状结构等, 可能通过轴突分布作用于上述的脑区或核团, 直接或间接传递信号, 从而发挥功能调节作用[6]。 Blanco-Centurion 等[7]采取光遗传技术激活下丘脑外侧区MCH 神经元, 可显著增加白天自由活动大鼠的非动眼、 动眼睡眠时间; Vetrivelan等[8]采取上述方法在小鼠实验研究中获得相似结果; 王娟等[9]研究表明, 10、 20 mg/kg 斯皮诺素均分别剂量依赖地增加慢波睡眠2.5、 3.1 倍, 减少觉醒量35.9%、 54.6%,但5 mg/kg 时不影响动物的睡眠-觉醒量。 本实验参照既往研究中斯皮诺素用量, 并结合课题组前期预实验结果, 将其终质量浓度设定为15 mg/kg, 然后检测该成分对睡眠剥夺大鼠下丘脑MCH 神经元阳性表达的影响, 发现斯皮诺素对改良多平台睡眠剥夺法所致MCH 神经元低表达具有改善效果。
Orexin 神经元主要位于下丘脑侧下及穹窿周围区, 其所发出兴奋性投射可到除小脑之外的中枢神经系统其他脑区, 尤其以高密度纤维投射至下丘脑以及脑干单胺能神经元, 参与睡眠-觉醒的调节[10], 其Fos 表达与觉醒呈明显正相关, 而与睡眠呈显著负相关, 激活后可促进和维持觉醒[11]。 本实验发现, 斯皮诺素对改良多平台睡眠剥夺法所致Orexin-A 神经元高表达具有抑制效果。
MCH 是含有48 个氨基酸的神经肽, 哺乳动物中它主要定位于下丘脑外侧区和未定带区, 一些激活睡眠的神经元能表达MCH 物质, 可增加慢波睡眠向快波睡眠转变, 延长快波睡眠持续时间[12], 同时也是机体能量内稳态系统中调节睡眠的重要调节因子[13]。 本实验发现, 斯皮诺素对改良多平台睡眠剥夺法所致MCH 表达下降有改善作用。
Orexin-A 是由下丘脑Orexin 神经元合成的小分子神经神经肽, 含33 个氨基酸, 序列在哺乳动物中相同, 它可增加觉醒及抑制睡眠, 是觉醒的重要启动子[14], Thannickal等[15]报道, 发作性睡病患者下丘脑Orexin-A 神经元总体缺失了33%, 其mRNA、 蛋白表达也明显降低。 本实验发现,斯皮诺素对改良多平台睡眠剥夺法所致Orexin-A 表达增加有抑制作用。
Kitka 等[16]认为, Orexin 神经元能轴突投向参与睡眠调控的脑区, 对觉醒起到关键调节作用; MCH 神经元可抑制其周围及下丘脑的Orexin 神经元, 从而促进睡眠发生。结合本实验结果, 推测斯皮诺素可能是通过上调下丘脑MCH 神经元及其递质表达, 再抑制Orexin-A 表达, 从而对睡眠剥夺大鼠起到改善睡眠的效果。
综上所述, 酸枣仁中斯皮诺素(15 mg/kg) 对改良多平台睡眠剥夺法所致大鼠下丘脑MCH 低表达、 Orexin-A 高表达有逆转作用, 提示该成分改善睡眠疾病的可能作用途径, 有望为失眠症的中药治疗开辟新途径。

