铁皮枫斗颗粒对糖尿病大鼠肾脏的保护作用
常景芝, 蒋建平, 李宜川, 刘国玲, 郭 辉, 刘 青, 芦 琨, 刘 嘉,关红亚
(1. 商丘医学高等专科学校基础医学部, 河南 商丘 476100; 2. 郑州大学附属郑州中心医院, 河南 郑州 450000)
糖尿病肾病是糖尿病引起的微血管并发症之一, 危害性大, 致死率高, 糖尿病肾病肾小球系膜细胞膜上葡萄糖转运蛋白-1 (GLUT-1) 的高度表达被认为是其重要发病机制[1]。 研究表明, 高糖可通过激活p38 丝裂原活化蛋白激酶(P38 MAPK), 促进系膜细胞增殖, 从而增加下游结缔组织生长因子(CTGF) 合成[2-4], 后者可促进成纤维细胞增生, 与许多组织器官的纤维化发生发展密切相关[5]。 铁皮枫斗Dendrobium candicum Wall. ex Lindl. 为铁皮石斛加工后的干品, 其主要成分为石斛多糖、 石斛碱、 总氨基酸等, 具有益胃生津、 滋阴清热等药理作用[6]。 本实验拟通过建立糖尿病大鼠模型, 探讨铁皮枫斗颗粒对其肾脏的保护作用及机制。
1 材料
1.1 药物 铁皮枫斗颗粒购自浙江天皇药业有限公司, 批号1501063; 厄贝沙坦购自赛诺菲(杭州) 制药有限公司,批号1411027。
1.2 动物 健康雄性大鼠70 只, 体质量200~220 g, 购自山西医科大学动物实验中心, 动物生产许可证号SCXK(晋) 20150001。
1.3 试剂 链脲佐菌素 (批号SLBB7534V) 购自美国Sigma 公 司; 血 肌 酐 (批 号1310024)、 尿 素 氮 (批 号14021217)、 血 糖 ( 批 号 1407049)、 尿 蛋 白 ( 批 号1408067) 检测试剂盒购自中生北控生物科技股份有限公司; 血管内皮生长因子ELISA 检测试剂盒(批号1403045)购自武汉博士德生物技术有限公司; GLUT-1 (批号SP0023)、 CTGF (批号SP0022) 免疫组化试剂盒购自北京博奥森生物技术有限公司; 兔抗GLUT-1 (批号BS0472R)、兔抗CTGF (批号BS0472R) 购自英国Abcam 公司; 逆转录 试 剂 盒 ( 批 号 00264978)、 PCR 试 剂 盒 ( 批 号00392278) 购自美国Thermo Scientific 公司; PCR 引物(批号HB1411099005) 购自上海生工生物工程有限公司。
1.4 仪器 日立7600 型全自动生化分析仪(日本日立公司); 罗氏Accu-Chek 血糖测定仪(瑞士罗氏公司); Bio-Rad 500 型酶标仪(美国Bio-Rad 公司); ABI 7500 型实时荧光定量PCR 仪(美国ABI 公司)。
2 方法
2.1 建模及分组 大鼠随机分为正常组(12 只) 和造模组(70 只), 造模组大鼠腹腔注射l%链脲佐菌素(60 mg/kg),对照组大鼠腹腔注射等体积枸橼酸缓冲液(0.1 mol/L),72 h 后尾静脉采血, 测定血糖浓度, ≥16.7 mmol/L 时为建模成功。 造模组大鼠随机分为模型组、 厄贝沙坦组(17.5 mg/kg)、 铁皮枫斗颗粒组, 其中最后一组根据临床每天服用剂量和文献[7] 又分为低剂量(0.2 g/kg)、 中剂量(0.4 g/kg)、 高剂量(0.8 g/kg), 给药组大鼠每天灌胃1 次, 连续8 周, 正常组、 模型组大鼠给予等体积生理盐水。
2.2 标本收集 在第4、 8 周, 称定大鼠体质量, 尾静脉采血, 测定血糖浓度, 并收集24 h 尿液用于测定24 h 尿蛋白; 在第8 周末, 腹腔注射水合氯醛麻醉大鼠后静脉取血,分离血清, -20 ℃下保存, 用于测定血肌酐、 尿素氮。 取大鼠双肾, 充分灌洗后称定质量, 右肾取一部分肾皮质,固定于4%聚甲醛中, 剩余部分置于液氮中保存待用。
2.3 生化指标检测 血糖仪测定血糖, 自动生化分析仪测定血肌酐、 尿素氮、 24 h 尿蛋白, 双抗体夹心ELISA 法测定血管内皮生长因子。 肾质量指数=右肾质量/体质量。
2.4 大鼠肾皮质GLUT-1、 CTGF 表达检测 免疫组化采用SP 法。 按照标准步骤, 分别加入GLUT1 一抗(1 ∶200)、CTGF 一抗(1 ∶100) 孵育, 再加入二抗, 显色并复染,设置阳性、 阴性对照。 高倍显微镜下(×400) 每张切片随机选取5 个不同的视野, 测定光密度值, 取平均值。
2.5 肾脏病理学检测 取石蜡包埋的大鼠肾皮质, 按照标准步骤切片, 常规HE 染色, 光学显微镜下观察其病理形态学变化。
2.6 大鼠肾皮质GLUT-1、 CTGF 蛋白表达检测 采用Western blot 法。 取肾组织裂解, 匀浆, 测定上清蛋白浓度, 6% SDS-PAGE 电泳、 转膜、 封闭后, 分别加入GLUT-1 一抗、 CTGF 一抗, 4 ℃下孵育过夜, 洗涤液(TBST) 洗涤3 次后, 加入用HRP 标记的二抗, 室温下封闭2 h, 再加入TBST 洗涤3 次, 每次10 min, 按照蛋白检测说明书,采用ECL 发光法检测蛋白。
2.7 大鼠肾皮质GLUT-1、 CTGF mRNA 表达检测 采用RT-PCR 法。 Trizol 法抽取总RNA 后, 逆转录试剂盒将总RNA 逆转录为cDNA, 在实时荧光定量PCR 仪上进行定量分析。 以GAPDH 为 内 参, GLUT-1 正 向5′-TCTGGCATCAACGCTGTCTTC-3′, 反向5′-CGATACCGGAGCCAATGGT-3′; CTGF 正向5′-TAGCTGCCTACCGACTGGAA-3′, 反向5′-CTAGAACAGGCGCTCCACT-3′; GAPDH 正 向5′-GAAATCCCATCACCATCTTCCAGG-3′, 反 向 5′-GAGCCCCAGCCTTCTCCATG-3′, 反应条件为95 ℃预变性5 min, 95 ℃15 s,60 ℃退火30 s, 40 个循环, 72 ℃终末延伸5 min。 再应用2-△△Ct法对结果进行分析。
2.8 统计学分析 通过SPSS 19.0 软件进行处理, 作图选择GraphPad Prism 软件, 计量数据以表示, 非正态分布数据经对数转换后进行分析, 2 组间比较采用t 检验, 多组间比较采用单因素方差分析。 P<0.05 表示有显著性差异。
3 结果
3.1 常规指标 表1 显示, 在第4、 8 周, 模型组、 铁皮枫斗颗粒组、 厄贝沙坦组大鼠血糖浓度显著高于正常组(P<0.01), 但各组之间无显著差异(P>0.05)。 模型组大鼠体质量显著低于正常组(P<0.01), 而铁皮枫斗颗粒组(第8 周低剂量组除外)、 厄贝沙坦组显著高于模型组(P<0.05)。 与正常组比较, 模型组大鼠肾重指数显著增加(P<0.01); 与模型组比较, 铁皮枫斗颗粒组、 厄贝沙坦组大鼠肾重指数显著降低(P<0.01)。
表1 各组大鼠常规指标比较
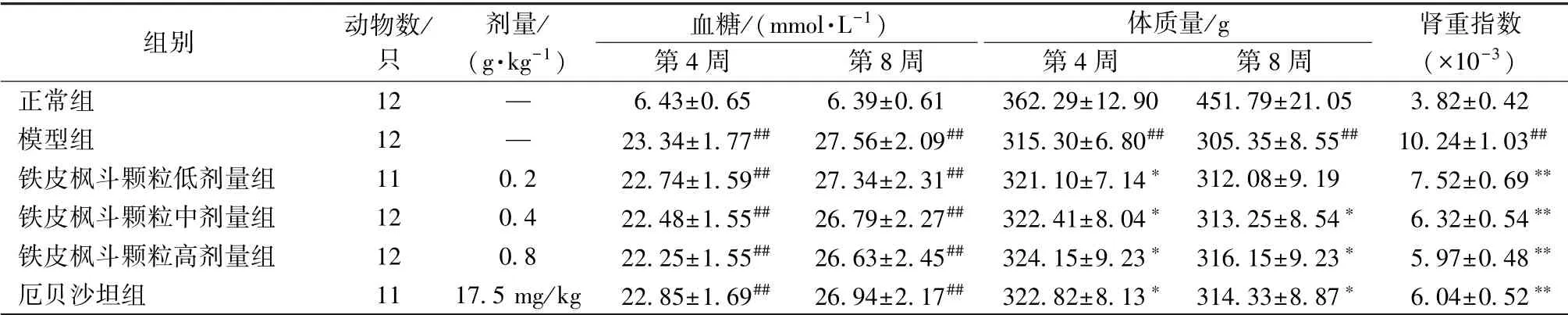
表1 各组大鼠常规指标比较
注:与正常组比较,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01
正常组 12 — 6.43±0.65 6.39±0.61 362.29±12.90 451.79±21.05 3.82±0.42模型组 12 — 23.34±1.77## 27.56±2.09## 315.30±6.80## 305.35±8.55## 10.24±1.03##铁皮枫斗颗粒低剂量组 11 0.2 22.74±1.59## 27.34±2.31## 321.10±7.14∗ 312.08±9.19 7.52±0.69∗∗铁皮枫斗颗粒中剂量组 12 0.4 22.48±1.55## 26.79±2.27## 322.41±8.04∗ 313.25±8.54∗ 6.32±0.54∗∗铁皮枫斗颗粒高剂量组 12 0.8 22.25±1.55## 26.63±2.45## 324.15±9.23∗ 316.15±9.23∗ 5.97±0.48∗∗厄贝沙坦组 11 17.5 mg/kg 22.85±1.69## 26.94±2.17## 322.82±8.13∗ 314.33±8.87∗ 6.04±0.52∗∗
3.2 生化指标 表2、 图1 显示, 与正常组比较, 模型组、铁皮枫斗颗粒组、 厄贝沙坦组大鼠血肌酐、 尿素氮、 24 h尿蛋白、 血管内皮生长因子显著升高(P<0.01); 与模型组比较, 铁皮枫斗颗粒组、 厄贝沙坦组上述生化指标显著下降(P<0.05, P<0.01), 其中铁皮枫斗颗粒组呈剂量依赖性。
表2 各组大鼠生化指标比较(
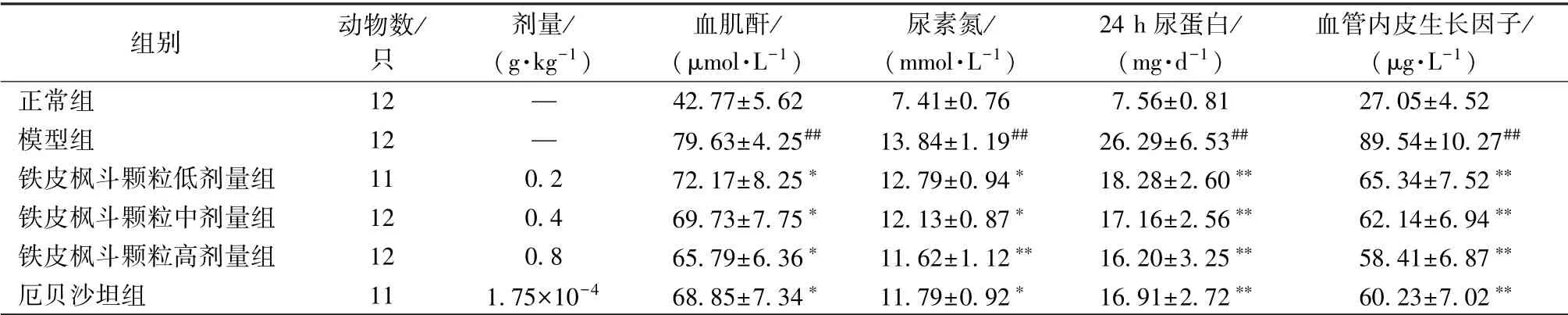
表2 各组大鼠生化指标比较(
注:与正常组比较,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01
组别 动物数/只剂量/(g·kg-1)血肌酐/(μmol·L-1)尿素氮/(mmol·L-1)24 h 尿蛋白/(mg·d-1)血管内皮生长因子/(μg·L-1)正常组 12 — 42.77±5.62 7.41±0.76 7.56±0.81 27.05±4.52模型组 12 — 79.63±4.25## 13.84±1.19## 26.29±6.53## 89.54±10.27##铁皮枫斗颗粒低剂量组 11 0.2 72.17±8.25∗ 12.79±0.94∗ 18.28±2.60∗∗ 65.34±7.52∗∗铁皮枫斗颗粒中剂量组 12 0.4 69.73±7.75∗ 12.13±0.87∗ 17.16±2.56∗∗ 62.14±6.94∗∗铁皮枫斗颗粒高剂量组 12 0.8 65.79±6.36∗ 11.62±1.12∗∗ 16.20±3.25∗∗ 58.41±6.87∗∗厄贝沙坦组 11 1.75×10-4 68.85±7.34∗ 11.79±0.92∗ 16.91±2.72∗∗ 60.23±7.02∗∗
3.3 肾脏病理变化 图2 显示, 正常组大鼠肾小球结构无明显病理变化; 模型组大鼠肾脏有病理变化, 表现为肾小球肥大、 系膜结构改变; 铁皮枫斗颗粒组、 厄贝沙坦组上述现象明显减轻, 其中铁皮枫斗颗粒组呈剂量依赖性。
3.4 大鼠肾皮质GLUT-1、 CTGF 表达 图3~5 显示, 与正常组比较, 模型组大鼠肾组织着色广泛、 浓集, GLUT-1、CTGF 表达显著增高(P<0.01); 与模型组比较, 铁皮枫斗颗粒组、 厄贝沙坦组大鼠肾组织着色范围相似, 但程度明显减轻, GLUT-1、 CTGF 表达显著下降(P<0.01), 其中铁皮枫斗颗粒组呈剂量依赖性。
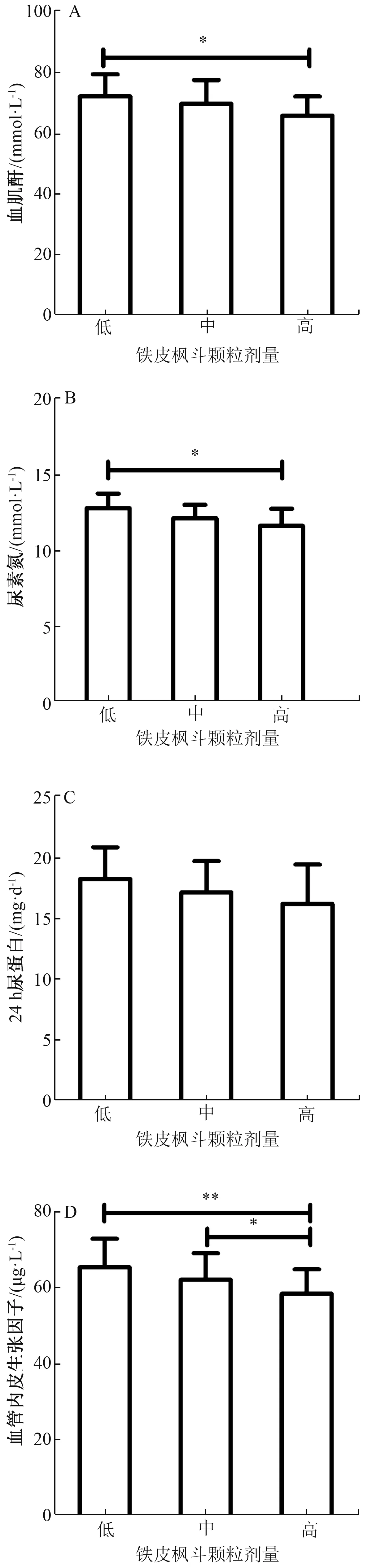
图1 不同剂量铁皮枫斗颗粒对大鼠血肌酐(A)、 尿素氮(B)、 24 h 尿蛋白(C)、 血管内皮生长因子(D) 的影响
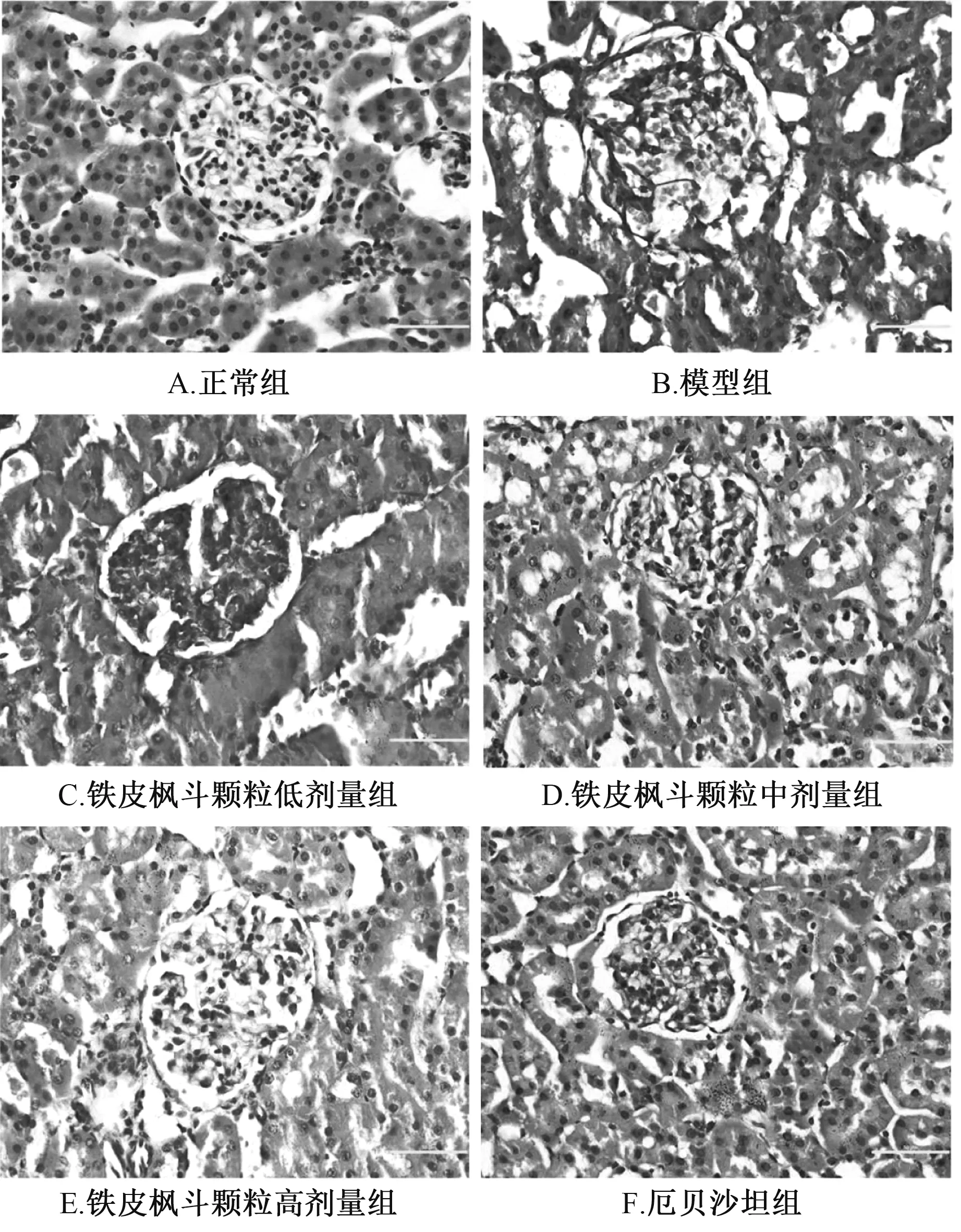
图2 各组大鼠肾脏病理变化(×400)
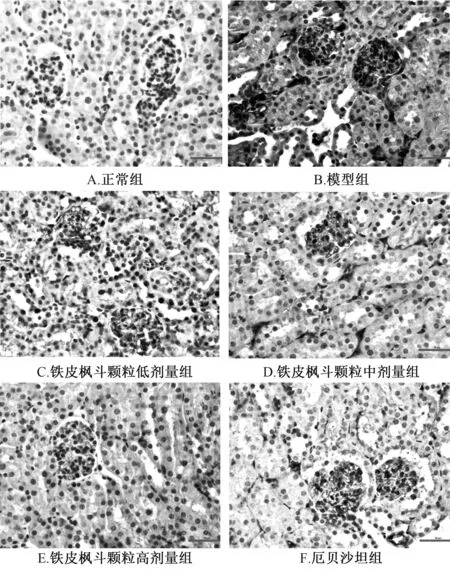
图3 各组大鼠肾皮质GLUT-1 表达(×400)
3.5 大鼠肾皮质GLUT-1、 CTGF 蛋白表达 图6 显示, 与正常组比较, 模型组GLUT-1、 CTGF 蛋白表达显著升高(P<0.01); 与模型组比较, 铁皮枫斗颗粒组、 厄贝沙坦组两者表达显著降低(P<0.01)。

图4 各组大鼠肾皮质CTGF 表达(×400)
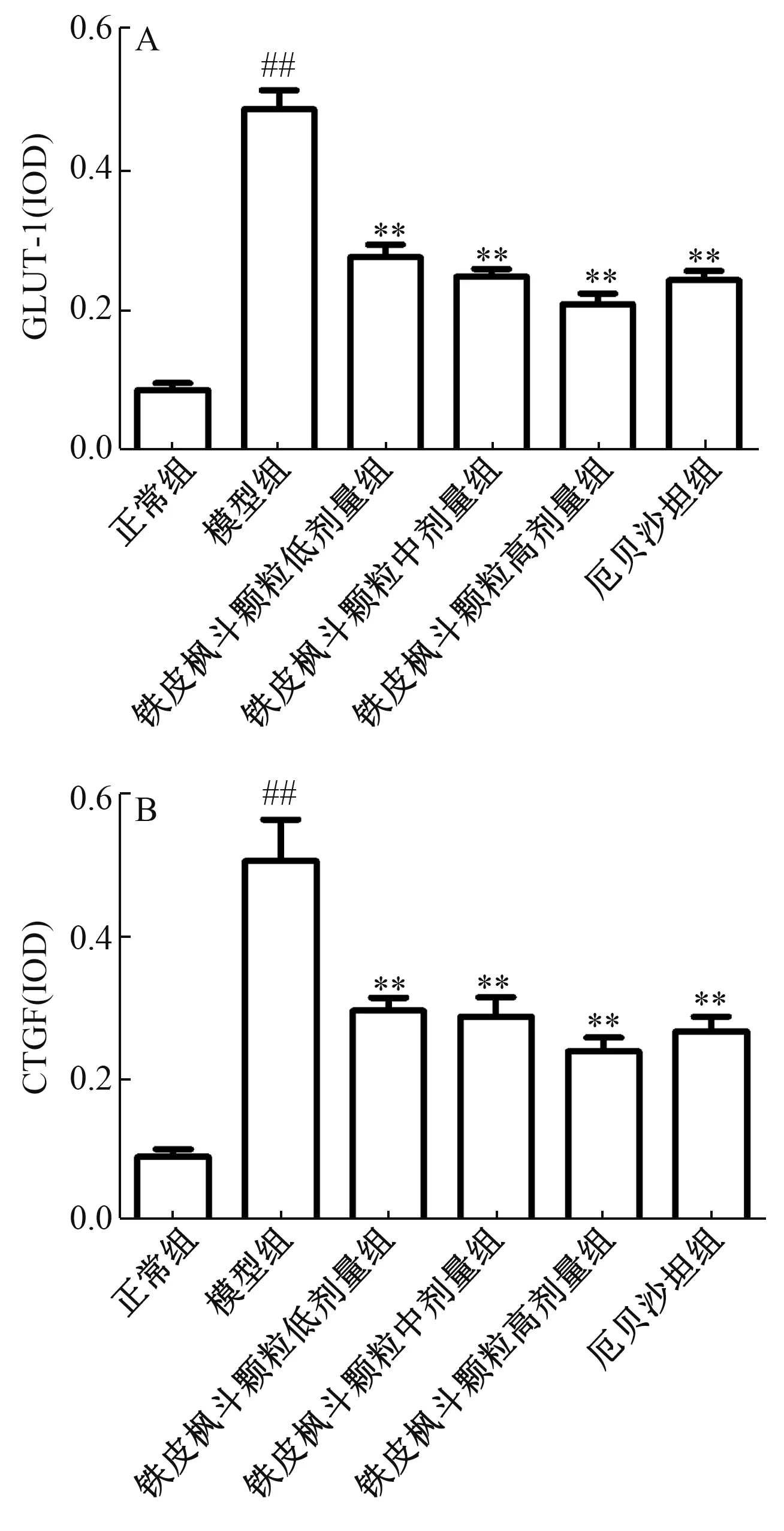
图5 各组大鼠肾皮质GLUT-1 (A)、 CTGF (B) 表达
3.6 大鼠肾皮质组织GLUT-1、 CTGF mRNA 的表达 图7显示, 与正常组比较, 模型组GLUT-1、 CTGF mRNA 表达显著升高(P<0.01); 与模型组比较, 铁皮枫斗颗粒组、厄贝沙坦组两者表达显著降低(P<0.05, P<0.01)。
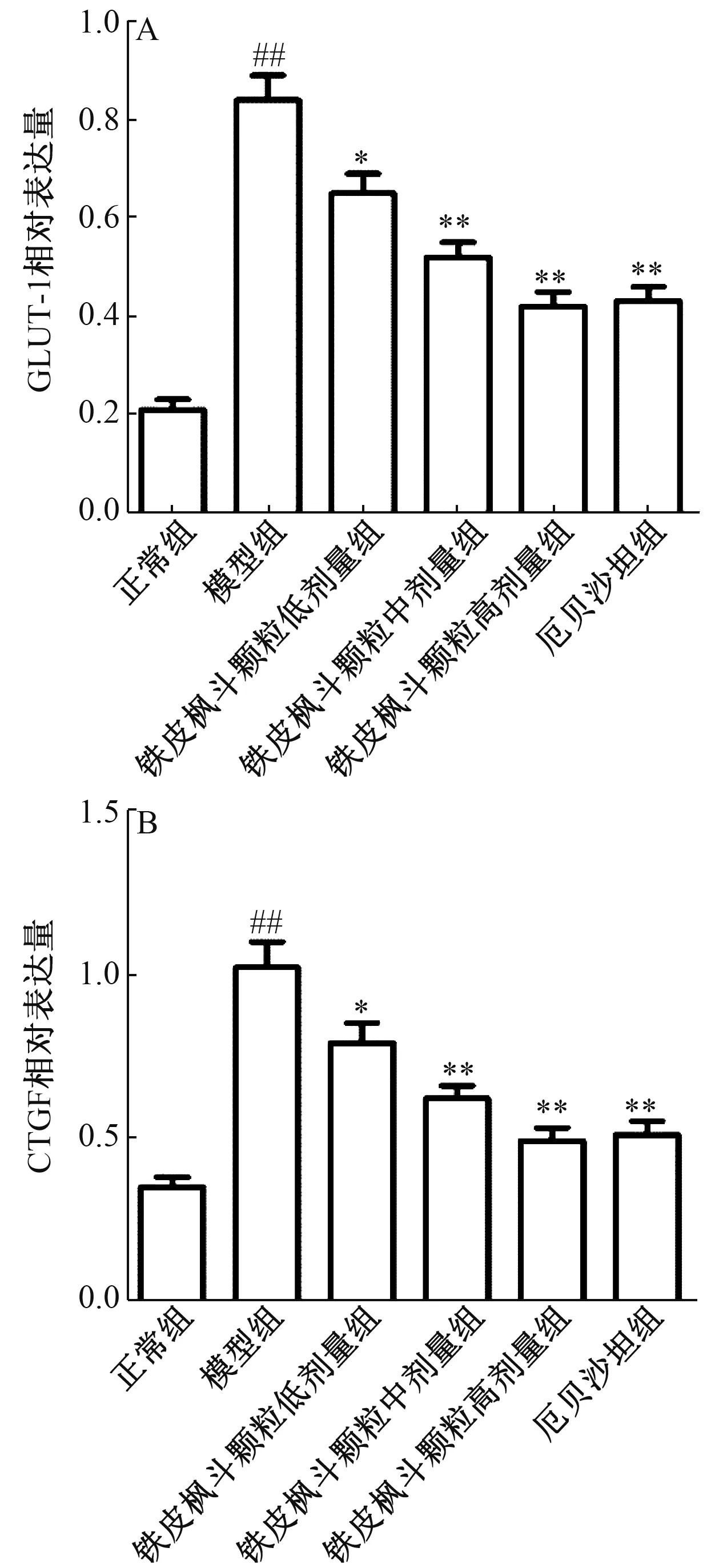
图6 各组大鼠肾皮质GLUT-1 (A)、 CTGF (B) 蛋白表达
4 讨论
高糖环境可导致组织局部缺氧, 缺氧诱导因子-1(HIF-1) 表达增加, 进而导致VEGF 表达上调, 被认为是糖尿病肾病的发病机制之一[8]。 本实验发现, 铁皮枫斗颗粒能显著降低大鼠血清中VEGF 表达, 并呈剂量依赖性。前期报道, 铁皮枫斗具有耐缺氧活性, 对糖尿病血管病变具有一定保护作用[9]; 本实验结果提示, 铁皮枫斗颗粒可能通过提高缺氧耐受来降低HIF-1 表达, 干扰大鼠体内VEGF 表达, 从而延缓糖尿病肾病进程, 发挥保护肾脏的作用。
葡萄糖转运蛋白是调控细胞内糖摄入及糖代谢的第一道关卡, 在介导糖尿病组织损伤中起着重要作用。 GLUT-1是GLUT 最主要的亚型, 其高表达可提高肾小球对葡萄糖的吸收, 增加糖尿病肾病风险。 受到各种胞外信号刺激后,P38 MAPK 信号转导通路是细胞内信号传递的共同通路[4,10], 而高糖可通过激活P38 MAPK 来增加下游转化生长因子TGF-β 合成, 并且CTGF 在TGF-β 致纤维化过程中也发挥着重要作用[11]。 前期研究显示, 肾小球、 肾小管、肾间质纤维化在糖尿病肾病发生发展中起到了重要作用[12]; 本实验通过免疫组化、 Western blot、 RT-PCR 法检测大鼠肾皮质中GLUT-1、 CTGF 蛋白、 mRNA 表达, 发现与模型组比较, 铁皮枫斗颗粒组其表达量显著降低, 并呈剂量依赖性。 由此可知, 铁皮枫斗颗粒能有效减少GLUT-1表达, 尽管对大鼠血糖浓度无明显影响, 但对糖尿病肾病进展具有抑制作用, 它对GLUT-1 表达的影响及耐缺氧活性可减少胞外信号刺激, 干扰P38 MAPK-CTGF 通路激活,从而减少下游TGF-β、 CTGF 表达。
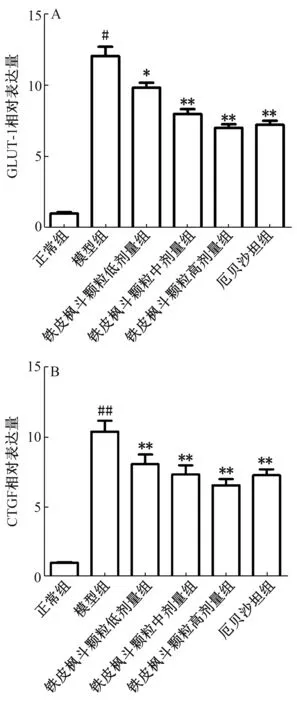
图7 各组大鼠肾皮质GLUT-1 (A)、 CTGF (B)mRNA 表达
铁皮枫斗颗粒治疗8 周后, 肾重指数、 血肌酐、 尿素氮、 24 h 尿蛋白等肾功能相关指标明显改善。 同时, 肾脏病理组织学检查发现该制剂能有效延缓大鼠肾病进展, 并呈剂量依赖性。
综上所述, 铁皮枫斗颗粒对糖尿病大鼠肾脏有保护作用, 其机制可能与调节VEGF、 GLUT-1、 CTGF 表达来延缓糖尿病肾病进展有关。

