逍遥散对脂多糖诱导抑郁样行为的影响
石博宇, 叶晓林, 罗 杰, 刘小波, 彭 希, 刘 蓉, 曾 南
(成都中医药大学药学院, 中药资源系统研究与开发利用省部共建国家重点实验室培育基地, 四川 成都 611137)
抑郁症是一种临床常见的精神障碍性疾病, 以持续性情绪淡漠、 悲观等为主要临床特征, 大量研究表明炎症反应与其病理生理机制密切相关。 逍遥散始载于宋代《太平惠民和剂局方》, 是中医调治情志活动异常的经典名方, 具有疏肝解郁、 养血健脾之功效, 主治肝郁血虚脾弱诸证; 现代药理研究显示, 它具有抗抑郁、 调节中枢单胺类神经递质水平、 调控体内激素水平、 调节免疫等药理作用。 本实验基于炎症可诱发抑郁症的认识及逍遥散具有一定抗炎作用的基础, 在体内、 体外实验采用脂多糖诱导抑郁样行为, 观察逍遥散对其影响, 以期为相关临床应用提供科学依据。
1 材料
1.1 动物 SPF 级C57BL/6J 小鼠, 雄性, 体质量18~22 g; SPF 级新生24 h SD 乳鼠; SPF 级SD 大鼠, 雄性, 体质量180~220 g, 均由成都达硕生物科技有限公司提供, 合格证号 SCXK (川)2013-24。
1.2 药物 逍遥散药材饮片(柴胡、 当归、 白芍、 白术、 茯苓、 薄荷、 生姜、 甘草) 购自成都太极大药房。 水煎液制备方法为按方剂组成要求[1]取相应量药材, 8 倍量水浸泡30 min, 加热煮沸后文火煎煮60 min, 趁热过滤药液, 再加6 倍量水同法分别煎煮40、 30 min, 合并3 次滤液,60 ℃下减压浓缩至所需浓度(1.5 g 生药/mL),生药量分别为30、 15 g/kg, 相当于成人临床日用量的30、 15 倍。 含药血清制备方法为将大鼠按体质量分层随机分为空白组和逍遥散高剂量组(30 g/kg), 连续灌胃给药7 d, 每天1 次, 末次给药1 h后麻醉大鼠, 腹主动脉取血, 3 500 r/min 离心10 min, 分 离 血 清, 每 组 混 合, 56 ℃水 浴30 min灭活, 0.22 μm 微孔滤膜过滤分装, -20 ℃下冷冻保存备用。
1.3 试剂 盐酸氟西汀胶囊(法国Patheon 公司,20 mg, 国药准字J20130010, 批号6607A); 盐酸氟 西 汀 (批 号 SLBM4298V)、 脂 多 糖 (批 号086M4159V)、 DAPI (批号066M4053V) (美国Sigma 公 司); Hanks 液 (批 号1752164)、 B-27(批号1813319)、 L-谷氨酰胺 (批号1816803)、Neurobasal-A 培养基(批号1852901) (美国Gibco公司); 胎牛血清(呼和浩特市草原绿野生物工程材料有限公司, 批号150501); DMEM 培养基(美国HyClone 公司, 批号AB10134657); 小鼠IL-6、TNF-α, 大鼠TNF-α ELISA 试剂盒(欣博盛生物科技有限公司, 批号M170221-004a、 M170221-102a、R170110-102a); 小鼠IL-6、 TNF-α, 大鼠TNF-α、IL-6 ELISA 试剂盒(上海依科赛生物制品有限公司, 批 号21G137、 21G152、 21G128、 21G156);小鼠IDO、 5-HT, 大鼠5-HT、 IDO ELISA 试剂盒(南京建成生物工程研究所, 批号01/2018、 01/2018、 02/2018、 02/2018); NO 检测试剂盒 (批号081216161111)、 乳酸脱氢酶细胞毒性检测试剂盒(批号112316170306) (上海碧云天生物技术有限公司); 兔源NeuN 单克隆抗体(美国Cell signaling Technology 公司, 货号5292S、 24307S); 山羊抗兔IgG/Cy3 [爱必信(上海) 生物科技有限公司, 批 号10、 AG04017512]; FastQuant RT Kit(Witn gDNase) 100rxn (批号Q5725)、 SuperReal PreMix Plus (SYBR Green) 20 μL×500rxn (批号Q5516) [天根生化科技(北京) 有限公司]。
1.4 仪器 3001 型酶标仪、 3111 二氧化碳培养箱、 ST16R 冷冻离心机、 NanoDrop2000 超微量分光光度计 (美国Thermo Fisher Scientific 公司);TS-200 小鼠悬尾测试仪 (成都泰盟科技有限公司); FV1200 激光共聚焦显微镜(日本Olympus公 司); iCycler iOMulticolor Real-Time PCR Dectection System (美国Bio-Rad 公司)。
2 方法
2.1 逍遥散对脂多糖致炎性抑郁样小鼠的影响 取C57BL/6 J 小鼠, 适应性饲养3 d 后按体质量分层随机分为空白组、 模型组、 氟西汀组(3.03 mg/kg) 及 逍 遥 散 低、 高 剂 量 组 (15、30 g/kg), 以0.02 mL/g 剂量连续灌胃给药12 d,每天1 次, 空白组、 模型组给予等体积蒸馏水, 第11 天除空白组外, 其余各组小鼠腹腔注射脂多糖(1 mg/kg) 造模, 共2 次, 每次间隔30 min, 空白组小鼠腹腔注射等量生理盐水[2]。 造模后, 所有小鼠于24 h 内完成行为学测试, 分批进行悬尾实验和强迫游泳实验, 完成行为学实验后小鼠取血分离血清, ELISA 法检测血清IL-6、 TNF-α 水平, 再剖取大脑皮层和海马组织, 4%多聚甲醛固定后制切片, 尼氏染色法观察海马神经元尼氏小体数,Image-Pro plus 图像分析软件测定海马CA3 区尼氏小体(×400) 表达平均光密度; 另取1 批大脑皮层和海马组织, PBS 缓冲液制备0.1 g/mL 组织匀浆, 离心, 收集上清液, ELISA 法检测IL-6、 TNFα、 5-HT、 IDO 水平。
2.2 逍遥散含药血清对脂多糖致海马神经元细胞炎症模型的影响
2.2.1 海马神经元细胞鉴定 将新生24 h 的SD乳鼠颈椎脱臼处死, 75%酒精消毒后置于盛有PBS液的平皿内, 剪开头部皮肤, 迅速剥离海马并置于冰冷PBS 液中, 移至盛有少量Hanks 液的小瓶中,眼科剪将组织剪成糜状, 加入0.25% 胰蛋白酶,37 ℃下消化25 min, 弃上清后用PBS 洗2 次, 每次5 min, 弃上清, 用含10%胎牛血清的DMEM 培养基终止消化, 反复吹打制成细胞悬液, 过150 目网筛, 收集细胞滤液, 离心(1 100 r/min、 4 ℃)5 min, 弃上清液, 加入适量含10% 胎牛血清的DMEM 培养基重悬细胞。 然后, 血球计数板计数细胞, 调节细胞密度5×105/mL, 接种神经细胞悬液于预先用poly-L-lysine 包被的48 孔培养板内,每孔350 μL, 37 ℃、 5% CO2培养箱中培养24 h后, 全量更换为含2% B-27、 1% L-谷氨酰胺的Neurobasal-A 培养液, 以后每3 d 半量换液。 再观察海马神经元生长形态[3], 并将培养12 d 的海马神经细胞用NeuN (1 ∶50 稀释) 一抗和Cy3 (1 ∶100 稀释) 二抗孵育, 1 μg/mL DAPI 染核, 激光共聚焦显微镜下观察鉴定神经元。
2.2.2 含药血清对脂多糖致海马神经元细胞损伤模型炎症和色氨酸代谢通路的影响 按“2.2.1”项下方法体外培养大鼠海马神经元细胞, 细胞在第7~10 天进入对数生长期, 将细胞随机分为空白组、 模型组、 氟西汀组 (10 μmol/L) 及空白血清、 含药血清低、 高剂量组(4%、 8%), 培养至第10 天, 将含5 μg/mL 脂多糖的培养基加入除空白组以外的各组培养孔中造模, 空白组加入不含B-27 的Neurobasal-A 培养基, 每孔350 μL。 24 h后, 各组细胞给予含氟西汀(10 μmol/L)、 空白血清 (4%、 8%)、 含药血清 (4%、 8%), 不含B-27 的Neurobasal-A 培养液, 空白组、 模型组均加入不含B-27 的Neurobasal-A 培养液, 每孔350 μL, 培养至第13 天, 收集上清, 检测NO、IL-6、 TNF-α 水平; 收集裂解液, ELISA 法检测5-HT、 IDO 水平; 提取各组海马神经元细胞总RNA,实时荧光定量PCR 法测定IL-6、 TNF-α、 5-HT1A、IDO1 mRNA 表达, 所有引物由英潍捷基(上海)贸易有限公司设计合成, 引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.3 统计学分析 通过SPSS 21.0 软件进行处理,数据以s) 表示, 符合正态分布者, 采用单因素方差分析或独立样本t 检验; 不符合者, 采用非参数秩和检验。 以P<0.05 为差异有统计学意义。
3 结果
3.1 逍遥散对不动时间的影响 表2 显示, 与空白组比较, 模型组小鼠2 个实验中不动时间显著延长(P<0.05, P<0.01); 与模型组比较, 逍遥散高剂量组2 个实验中不动时间显著缩短 (P <0.01), 低剂量组强迫游泳实验中不动时间显著缩短(P<0.01)。
表2 逍遥散对不动时间的影响s, n=6~7)Tab.2 Effect of Xiaoyao Powder on immobility time s, n=6-7)

表2 逍遥散对不动时间的影响s, n=6~7)Tab.2 Effect of Xiaoyao Powder on immobility time s, n=6-7)
注:与空白组比较,#P <0.05,##P <0.01;与模型组比较,∗P <0.05,∗∗P<0.01
空白组 — 178.24±6.82 121.55±13.92模型组 — 213.13±8.51## 141.97±12.17#氟西汀组 3.03 mg/kg 124.80±46.58∗∗ 124.07±9.33∗逍遥散组 15 196.69±19.29 98.48±17.27∗∗逍遥散组 30 171.15±4.16∗∗ 74.18±19.44∗∗
3.2 逍遥散对IL-6、 TNF-α 水平的影响 表3 显示, 与空白组比较, 模型组血清、 皮层IL-6、 TNF-α 水平及海马IL-6 水平显著升高(P <0.05, P <0.01); 与模型组比较, 逍遥散组血清IL-6 水平显著降低(P<0.05), 皮层TNF-α、 IL-6 水平显著下调(P<0.05, P<0.01), 并且低剂量组海马IL-6水平显著降低(P<0.05)。
3.3 逍遥散对5-HT、 IDO 水平的影响 表4 显示, 与空白组比较, 模型组海马、 皮层5-HT 水平显著降低(P<0.05, P<0.01), 皮层IDO 水平显著升高(P<0.05); 与模型组比较, 逍遥散组海马5-HT 水平显著上调, 皮层IDO 水平显著下调(P<0.05, P<0.01), 并且高剂量组皮层5-HT 水平显著上调(P<0.01)。
表3 逍遥散对IL-6、 TNF-α 水平的影响 n=4~6)Tab.3 Effects of Xiaoyao Powder on IL-6 and TNF-α levels n=4-6)
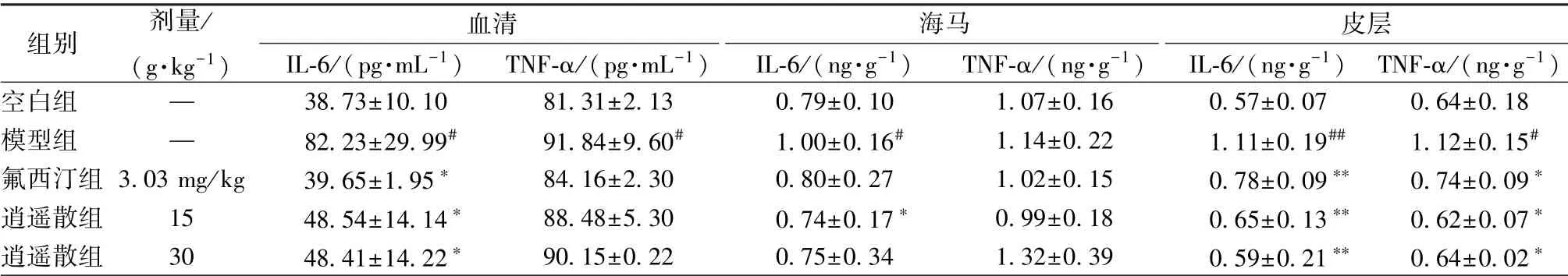
表3 逍遥散对IL-6、 TNF-α 水平的影响 n=4~6)Tab.3 Effects of Xiaoyao Powder on IL-6 and TNF-α levels n=4-6)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01
组别 剂量/(g·kg-1)皮层IL-6/(pg·mL-1) TNF-α/(pg·mL-1) IL-6/(ng·g-1) TNF-α/(ng·g-1) IL-6/(ng·g-1) TNF-α/(ng·g-1)血清海马空白组 — 38.73±10.10 81.31±2.13 0.79±0.10 1.07±0.16 0.57±0.07 0.64±0.18模型组 — 82.23±29.99# 91.84±9.60# 1.00±0.16# 1.14±0.22 1.11±0.19## 1.12±0.15#氟西汀组3.03 mg/kg 39.65±1.95∗ 84.16±2.30 0.80±0.27 1.02±0.15 0.78±0.09∗∗ 0.74±0.09∗逍遥散组 15 48.54±14.14∗ 88.48±5.30 0.74±0.17∗ 0.99±0.18 0.65±0.13∗∗ 0.62±0.07∗逍遥散组 30 48.41±14.22∗ 90.15±0.22 0.75±0.34 1.32±0.39 0.59±0.21∗∗ 0.64±0.02∗
表4 逍遥散对5-HT、 IDO 水平的影响, n=5)Tab.4 Effects of Xiaoyao Powder on 5-HT and IDO levels , n=5)
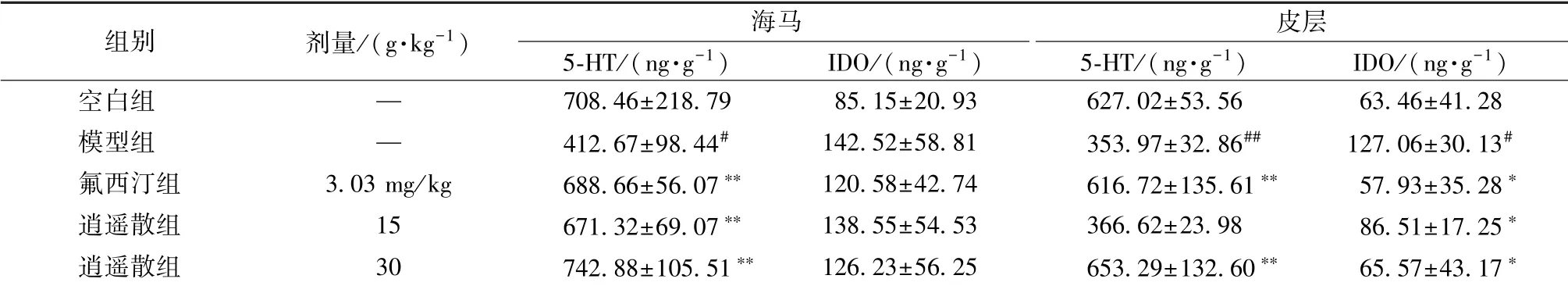
表4 逍遥散对5-HT、 IDO 水平的影响, n=5)Tab.4 Effects of Xiaoyao Powder on 5-HT and IDO levels , n=5)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01
空白组 — 708.46±218.79 85.15±20.93 627.02±53.56 63.46±41.28模型组 — 412.67±98.44# 142.52±58.81 353.97±32.86## 127.06±30.13#氟西汀组 3.03 mg/kg 688.66±56.07∗∗ 120.58±42.74 616.72±135.61∗∗ 57.93±35.28∗逍遥散组 15 671.32±69.07∗∗ 138.55±54.53 366.62±23.98 86.51±17.25∗逍遥散组 30 742.88±105.51∗∗ 126.23±56.25 653.29±132.60∗∗ 65.57±43.17∗
3.4 逍遥散对尼氏小体的影响 表5、 图1 显示,与空白组比较, 模型组小鼠海马神经元损伤, 排列不规则, 分层不清楚, 尼氏小体数减少, 呈较明显空泡状, 平均光密度显著降低(P<0.01); 与模型组比较, 逍遥散高剂量组平均光密度显著增加(P<0.05)。
表5 逍遥散对尼氏小体的影响±s, n=6)Tab.5 Effect of Xiaoyao Powder on Nissl bodies n=6)

表5 逍遥散对尼氏小体的影响±s, n=6)Tab.5 Effect of Xiaoyao Powder on Nissl bodies n=6)
注:与空白组比较,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01
组别 剂量/(g·kg-1) 平均光密度空白组 — 48.14±5.03模型组 — 28.69±3.40##氟西汀组 3.03 mg/kg 39.37±4.96∗∗逍遥散组 15 31.48±2.34逍遥散组 30 33.03±7.90∗
3.5 大鼠原代海马神经元细胞体外生长形态观察及鉴定 海马神经元细胞接种24 h 后, 其中有很多神经胶质细胞, 其胞体较小, 数量较少, 再进行全量更换为Neurobasal-A 培养液培养24 h 后, 神经胶质细胞数量减少, 海马神经元细胞数目增多,而且胞体饱满。 随着培养时间延长, 神经元细胞纯度更高, 长出神经突触, 并呈现聚团生长, 胞体饱满, 有光泽, 细胞生长到第10 天时细胞聚集成团,神经突触明显增长。
NeuN 是神经元特异标记物, 神经元细胞可被NeuN-Cy3 标记为红色。 图2 显示, 经NeuN、 DAPI双染色后, 培养12 d 的细胞红色、 蓝色荧光分布基本重合, 表明所培养细胞为成熟神经元细胞, 纯度可达95%以上。
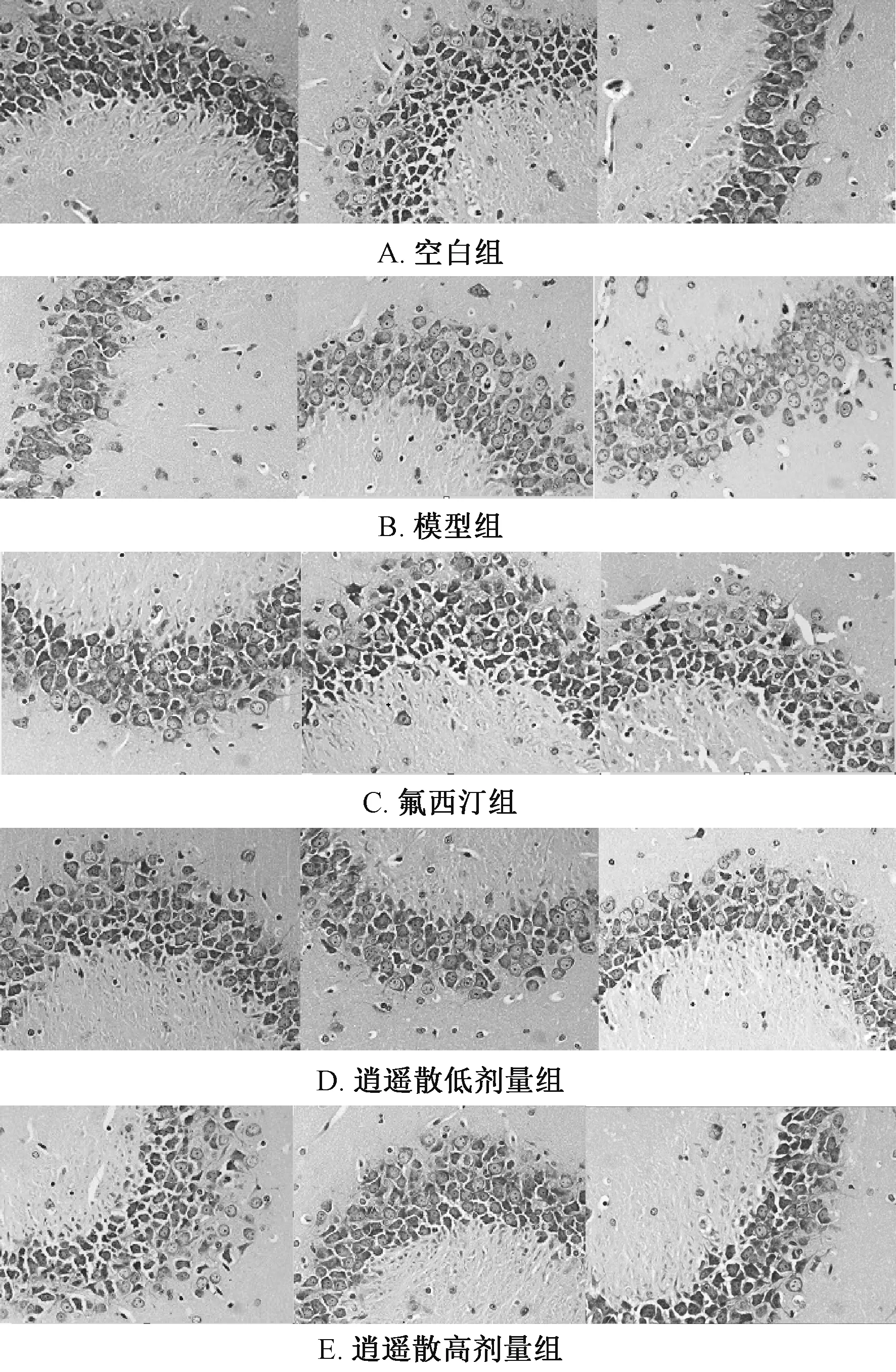
图1 逍遥散对尼氏小体的影响(×400)Fig.1 Effect of Xiaoyao Powder on Nissl bodies (×400)
3.6 含药血清对NO、 IL-6、 TNF-α水平的影响 表6 显示, 与空白组比较, 模型组NO、 IL-6、 TNF-α 水平显著升高 (P <0.01); 与模型组比较, 含药血清高剂量组三者水平显著下调(P<0.01)。

图2 大鼠原代海马神经元细胞鉴定Fig.2 Identification of primary hippocampalneuron cells in rats
表6 含药血清对NO、 IL-6、 TNF-α 水平的影响=4~6)Tab.6 Effects of medicated serum on NO, IL-6 and TNF-α levels=4-6)
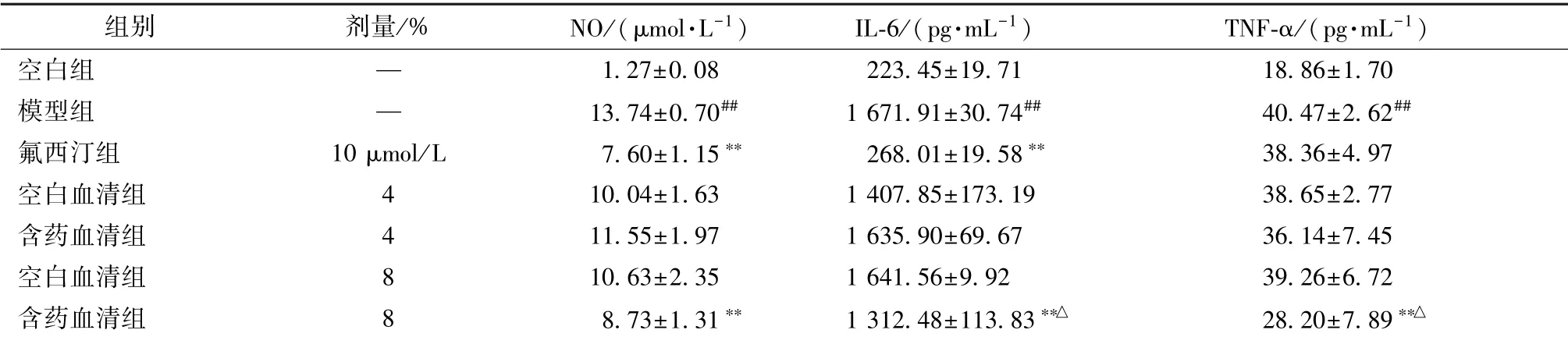
表6 含药血清对NO、 IL-6、 TNF-α 水平的影响=4~6)Tab.6 Effects of medicated serum on NO, IL-6 and TNF-α levels=4-6)
注:与空白组比较,##P<0.01;与模型组比较,∗∗P<0.01;与空白血清高剂量组比较,△P<0.05
空白组 — 1.27±0.08 223.45±19.71 18.86±1.70模型组 — 13.74±0.70## 1 671.91±30.74## 40.47±2.62##氟西汀组 10 μmol/L 7.60±1.15∗∗ 268.01±19.58∗∗ 38.36±4.97空白血清组 4 10.04±1.63 1 407.85±173.19 38.65±2.77含药血清组 4 11.55±1.97 1 635.90±69.67 36.14±7.45空白血清组 8 10.63±2.35 1 641.56±9.92 39.26±6.72含药血清组 8 8.73±1.31∗∗ 1 312.48±113.83∗∗△ 28.20±7.89∗∗△
3.7 含药血清对5-HT、 IDO 水平的影响 表7 显示, 与空白组比较, 模型组5-HT 水平显著降低(P<0.05), IDO 表达显著增加(P<0.01); 与模型组比较, 含药血清高剂量组5-HT 水平显著上调, IDO 水平显著下调(P<0.01), 低剂量组IDO水平显著下调(P<0.01)。
3.8 含药血清对IL-6、 TNF-α mRNA 表达的影响 表8 显 示, 与 空 白 组 比 较, 模 型 组IL-6、TNF-α mRNA 表达显著增加(P<0.05, P<0.01);与模型组比较, 含药血清组两者mRNA 表达显著下调(P<0.05, P<0.01)。
表7 含药血清对5-HT、 IDO 水平的影响(x±s, n=5~6)Tab.7 Effects of medicated serum on 5-HT and IDO levels±s, n=5-6)

表7 含药血清对5-HT、 IDO 水平的影响(x±s, n=5~6)Tab.7 Effects of medicated serum on 5-HT and IDO levels±s, n=5-6)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗∗P<0.01;与空白血清低剂量组比较,▲P<0.05;与空白血清高剂量组比较,△P<0.05,△△P<0.01
空白组 — 51.66±16.17 1.22±0.21模型组 — 29.77±11.41# 1.65±0.16##氟西汀组 10 μmol/L 57.95±13.24∗∗ 0.79±0.18∗∗空白血清组 4 29.52±5.37 2.04±0.64含药血清组 4 43.77±14.92 1.12±0.14∗∗▲空白血清组 8 20.21±4.88 2.13±0.66含药血清组 8 74.82±8.51∗∗△△ 1.25±0.09∗∗△
表8 含药血清对IL-6、 TNF-α mRNA 表达的影响,n=4~5)Tab.8 Effects of medicated serum on IL-6 and TNF-α mRNA expressions s, n=4-5)

表8 含药血清对IL-6、 TNF-α mRNA 表达的影响,n=4~5)Tab.8 Effects of medicated serum on IL-6 and TNF-α mRNA expressions s, n=4-5)
注:与空白组比较,#P <0.05,##P <0.01;与模型组比较,∗P <0.05,∗∗P<0.01;与空白血清低剂量组比较,▲▲P<0.01;与空白血清高剂量组比较,△P<0.01, △P<0.05
空白组 — 1.04±0.40 1.20±0.38模型组 — 7.49±1.09## 9.73±2.01#氟西汀组 10 μmol/L 4.43±0.92∗∗ 4.08±1.09空白血清组 4 5.87±1.10 7.17±0.42含药血清组 4 1.52±0.18∗∗▲▲ 0.86±0.30∗▲▲空白血清组 8 6.09±0.58 7.06±0.76含药血清组 8 2.15±0.14∗∗△△ 1.07±0.03∗△
3.9 含药血清对5-HT1A、 IDO1 mRNA 表达的影响 表9 显示, 与空白组比较, 模型组5-HT1A mRNA 表达显著降低(P<0.01), IDO1 mRNA 表达显著升高(P<0.01); 与模型组比较, 含药血清组5-HT1A mRNA 水平显著上调(P<0.01), IDO1 mRNA 水平显著下调(P<0.01)。
表9 含药血清对5-HT1A、 IDO1 mRNA 表达的影响(x±s, n=4~5)Tab.9 Effects of medicated serum on 5-HT1A and IDO1 mRNA expressionss, n=4-5)

表9 含药血清对5-HT1A、 IDO1 mRNA 表达的影响(x±s, n=4~5)Tab.9 Effects of medicated serum on 5-HT1A and IDO1 mRNA expressionss, n=4-5)
注:与空白组比较,##P<0.01;与模型组比较,∗∗P<0.01;与空白血清低剂量组比较,▲▲P <0.01;与空白血清高剂量组比较,△P <0.01,△P<0.05
空白组 — 1.04±0.01 0.87±0.39模型组 — 0.34±0.05## 2.17±0.19##氟西汀组 10 μmol/L 0.76±0.05∗∗ 0.99±0.30∗∗空白血清组 4 0.35±0.03 1.92±0.17含药血清组 4 0.57±0.09∗∗▲▲ 0.74±0.23∗∗▲▲空白血清组 8 0.31±0.03 1.82±0.34含药血清组 8 0.67±0.13∗∗△△ 1.07±0.42∗∗△
4 讨论
炎症反应参与了抑郁症的发生发展过程, 细胞因子水平异常与神经精神综合征发生存在必然联系[4], 炎性细胞因子会通过影响大脑神经传递和可塑性来触发氧化应激, 抑制成年神经发生等途径。 从而诱发抑郁症[5]。 脂多糖刺激机体诱导产生的炎性细胞因子能激活吲哚胺2, 3-双加氧酶(IDO), 它是一种能由IL-6、 IFN -α、 IFN -γ、 TNFα 中1 种或几种结合的细胞因子激活若干炎症信号通路激活的酶, 可导致色氨酸(TRP) 更多地代谢为犬尿氨酸(KYN), 进而引起神经毒性产物的增加, 抑制海马神经元的可塑性[6-7], 同时被色氨酸羟化酶 (TrpH) 和1-芳香族氨基酸脱羧酶 (LAADC) 代谢成5-HT 的色氨酸减少, 导致后者合成水平下降, 并引起强迫游泳不动时间延长、 飞溅测试梳洗时间减少等抑郁样行为, 给予细胞因子抑制剂米诺环素后能间接阻断IDO 激活, 表现出阻止抑郁症的发展[8]。 Corona 等[9]报道, LPS 诱导的IDO 激活会导致趋化因子受体缺陷小鼠(CX3CR1-/-小鼠) 产生抑郁样行为, 小胶质细胞激活和脑内5-HIAA/5-HT 比率增加, 给予IDO 抑制剂1-MT 后可缓解该状况。 另外, 非甾体抗炎药物阿司匹林也能在通过下调细胞因子(IL-6、 TNFα) 释放来减轻炎性反应的同时, 缩短SD 大鼠强迫游泳的不动时间从而缓解抑郁样行为[10]。
逍遥散具有良好的抗抑郁作用, 方中君药柴胡有效成分柴胡皂苷抗炎作用明显[11], 其机制与抑制炎 症 介 质 (IL-1、 IL-6、 TNF-α 等) 释 放 有关[12]; 臣药当归、 白芍均具有抗炎作用, 前者所含阿魏酸能提高吞噬细胞功能, 抑制IL-1β、 JNK信号通路来发挥神经保护作用, 而后者所含芍药苷、 牡丹酚等可抑制IL-6、 TNF-α 等炎性因子分泌; 佐药白术、 茯苓、 生姜[13]、 薄荷[14], 以及使药甘草[15]均可通过抑制炎症因子释放来发挥抗炎作用, 有效成分包括白术内酯、 茯苓多糖、 姜黄素、 薄荷酮、 甘草黄酮等。 课题组前期采用二甲苯致小鼠耳肿胀实验及醋酸致小鼠腹腔毛细血管通透性增高实验, 也发现逍遥散具有一定抗炎作用, 显示出其处方药物抗炎作用的整合表现。
本实验结果显示, 脂多糖刺激可引起小鼠出现悬尾、 强迫游泳不动时间延长等抑郁样行为, 而且小鼠血清、 皮质、 海马中IL-6、 TNF-α 水平明显升高, 提示抑郁样行为与IL-6、 TNF-α 水平升高存在一定相关性; 它也可诱导小鼠皮层、 海马中IDO水平上调, 5-HT 水平下降, 海马CA3 区锥体细胞形态不规则, 细胞间隙增大, 排列不齐, 甚至尼氏小体消失, 提示该模型小鼠抑郁样行为发生与炎性反应有关; 体内实验显示, 逍遥散能缩短模型小鼠强迫游泳实验、 悬尾实验中不动时间, 降低外周及中枢皮层、 海马IL-6、 TNF-α、 IDO 水平, 提高5-HT 水平; 体外实验显示, 含药血清可对抗脂多糖诱导的海马神经细胞炎性因子异常释放及其mRNA表达, 并提高模型细胞5-HT 分泌水平及5-HT1A mRNA 的表达。
综上所述, 逍遥散对脂多糖诱导的神经炎症抑郁样模型有对抗作用, 其机制可能与直接上调5-HT 水平及其受体功能, 或通过阻断炎性因子诱导的IDO 激活途径来抑制TRP-KYN 代谢途径, 促使更多TRP 向5-HT 转化, 并同时降低KYN 及其下游神经元毒性代谢物的产生, 或保护神经元、 促神经元增殖分化有关。 同时也进一步表明, 逍遥散的抗抑郁作用是多途径、 多靶点模式。

