Caveolin-1、Met蛋白在日光性角化病、鲍温病和皮肤鳞状细胞癌中的表达
魏 云 吴丽娟 丁高中 冯雨苗 孙 澜
近年有研究发现,皮肤鳞状细胞癌(cSCC)约占所有皮肤恶性肿瘤的20%,其中cSCC的确诊例数以每年2.6%的比例逐年升高[1]。日光性角化病(AK)和鲍温病(BD)分别被认为是癌前病变、原位鳞癌,在临床及组织病理上可能代表了 cSCC 在不同演进阶段的表现或进展过程。本研究对AK、BD、cSCC中的Caveolin-1蛋白与Met蛋白表达情况及意义进行阐述,探讨二者在cSCC发生、发展过程中的可能作用,并且有可能为以后cSCC的靶向治疗提供理论依据。
1 材料与方法
1.1 一般材料 本研究共纳入55例病例和12例肿瘤边缘正常皮肤。其中正常皮肤12例,平均年龄(63.42±7.077)岁,男8例,女11例,AK 19 例,男8例,女11例,平均年龄(71.68±11.982)岁;BD 17例,男 5例,女12例,平均年龄(63.94±9.404)岁;cSCC 19例,男7例,女12例,平均年龄(79.16±8.681)岁。以上所有标本来源于2010年1月至2016年12月南京医科大学附属苏州医院皮肤科临床资料及蜡块保存完整并且经过本院病理科确诊为上述三种疾病的病例(已经剔除脱片、组织残缺不全或折片的标本,选取组织完整的标本进行观察和分析)。本研究通过南京医科大学附属苏州医院伦理委员会批准进行。
1.2 方法 采用免疫组化SP法检测Caveolin-1与Met蛋白在肿瘤边缘正常皮肤、AK、BD、cSCC中的表达情况。试剂一抗选用Abcam company兔抗人Caveolin-1抗体(1∶100)、 Cell Signaling Technology company兔抗人Met抗体(1∶50);二抗选用北京中杉金桥公司SP免疫组化试剂盒。阴性对照:染色过程中用PBS缓冲液代替一抗。
1.3 结果判定 按阳性细胞所占百分比:≤5%,0分;6%~25%,1分;26%~50%,2分;>50%,3分。按细胞染色强度:无染色,0分;浅黄色,1分;黄色,2分;棕褐色,3分。根据阳性部位,随机选择5个高倍视野,每个视野数100个细胞,评分标准中按阳性细胞所占百分比与细胞染色强度乘积。Caveolin-1:0~3分,阴性;4分,+;6分,++;9分,+++。Met:0~1分,阴性;2~3分,+;4-6分,++;9分,+++。评分由两位病理医师随机双盲法独立进行,结果的判断标准通过查询参考文献获得。
1.4 统计学方法 采用SPSS 20.0统计软件进行统计学处理,等级资料采用Kruskal-wallis H秩和检验,率比较采用卡方及Fisher确切概率法,相关性分析采用spearman等级分析方法,P<0.05被认为有统计学差异。
2 结果
2.1 Caveolin-1及Met在肿瘤边缘正常皮肤中的表达情况 Caveolin-1表达于细胞的胞膜,Met表达于胞膜和胞质,正常皮肤中可见在基底膜表达(图1a,2a)。
2.2 Caveolin-1及Met在AK、BD、cSCC中的表达情况(图1b~1d,图2b~2d)
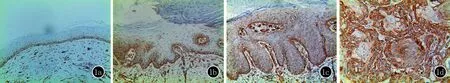
a:正常皮肤组织;b:AK;c:BD;d:cSCC
图1Caveolin-1免疫组化染色(×200)

a:正常皮肤组织;b:AK;c:BD;d:cSCC
2.2.1 Caveolin-1在肿瘤边缘正常皮肤、AK、BD、cSCC中阳性率依次为16.7%(2/12)、36.8%(7/19)、52.9%(9/17)、78.9%(15/19),可知Caveolin-1在四组之间呈现逐渐递增的表达趋势(表1)。四组间采用Kruskal-wallis H秩和检验,P=0.000124,有显著意义。组间阳性率比较采用卡方检验:cSCC组明显高于正常皮肤组χ2=11.519,P=0.001,差异有显著性。正常皮肤组与AK组、BD组χ2=1.453、3.932,Ps>0.05,无统计学意义。AK组与CSCC组χ2=6.909,P=0.009,差异有统计学意义。BD与AK组、cSCC组比较,χ2=0.942、2.731,Ps>0.05,无统计学意义。
2.2.2 Met在肿瘤边缘正常皮肤、AK、BD、cSCC中阳性率依次为8.3%(1/12)、26.3%(5/19)、58.8%(10/17)、84.2%(16/19),同样可知Met在四组之间呈现逐渐递增的表达趋势(表2)。四组间采用Kruskal-wallis H秩和检验,P=0.000013,有显著意义。组间阳性率比较采用卡方检验:BD组和cSCC组明显高于正常皮肤组χ2=7.617、17.098,P=0.009、0.000,差异有统计学意义。正常皮肤组与AK组χ2=1.524,P>0.05,无统计学意义。AK组与BD组、cSCC组χ2=3.901、12.880,Ps<0.05,差异有统计学意义。BD组与cSCC组比较,χ2=2.882,P>0.05,无统计学意义。

表1 Caveolin-1蛋白在正常皮肤、AK、BD、cSCC中的表达
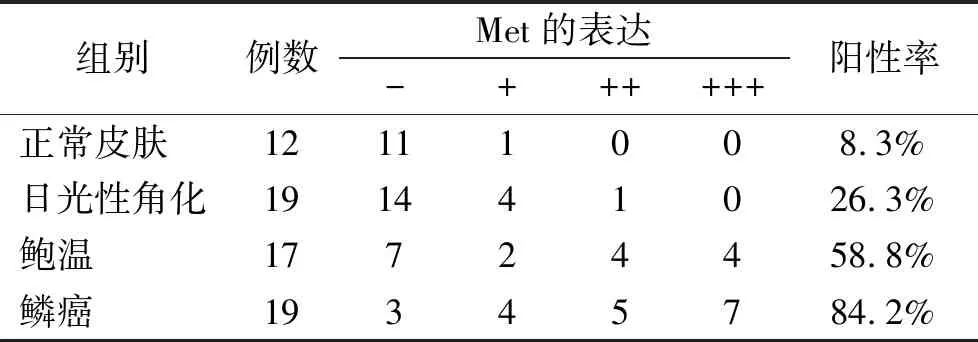
表2 Met蛋白在正常皮肤、AK、BD、cSCC组织中的表达
2.3 Caveolin-1与c-Met在皮肤鳞癌中表达的相关性 相关性分析结果显示Spearman等级相关系数r=0.484,P=0.036,皮肤鳞癌组织中Caveolin-1与Met表达呈正相关(表3)。
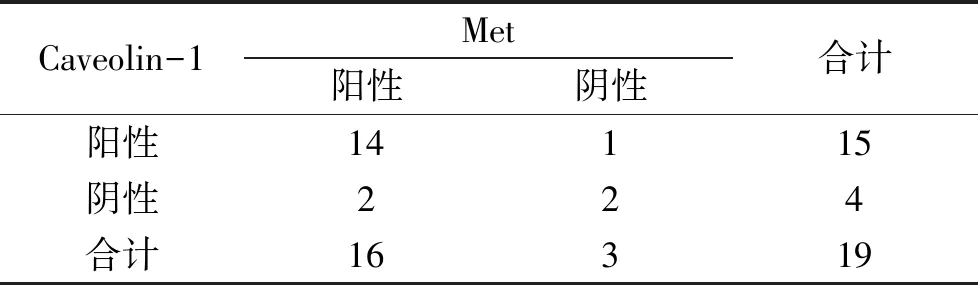
表3 鳞癌中Caveolin-1和Met表达关系19例
3 讨论
皮肤肿瘤的发生发展是一个多环节多因素的复杂过程。cSCC是白种人群中第二常见的恶性非黑素瘤皮肤癌[2],暴露于紫外线辐射是最大的危险因素。对于cSCC,AK及BD可作为其重要的癌前病变及原位癌阶段,在临床及组织病理上可能代表了cSCC在不同演进阶段的表现或进展过程。以往研究显示超过十年的AK 将有1%~10%发展为cSCC,年转化率低于千分之一[3],同时未经治疗的BD有3%~26%的病例发展为侵袭性cSCC[4]。因此探讨这些疾病的相关性可能会有助于减少恶变发生。
3.1 Caveolin-1在AK、BD及cSCC中的表达 Caveolin-1基因定位于人类染色体7q31.1-31.2,其结构主要包括中央高度保守的疏水区和两侧可变的N端、C端区域,在细胞膜内具有特殊的发夹样结构[5]。Caveolin-1在许多生理和病理活动中都扮演着重要的角色,不仅仅与胆固醇运输、信号传导等过程相关,也具有监管许多信号通路的作用。这些通路有如表皮生长因子受体,蛋白激酶C、G蛋白和Src家族酪氨酸激酶,同时这些通路的异常都可能诱发人类癌症的发展[6]。既往肿瘤的研究中,包括结肠癌、乳腺癌、 宫颈癌、胰腺癌、肺腺癌等都发现 Caveolin-1 的表达量是降低的,而相反在肺鳞癌、肝癌、食道癌、前列腺癌、膀胱癌中,Caveolin-1的表达却是增高的,并随着肿瘤的分化程度的下降和侵蚀能力的增强表达升高。这可能与肿瘤的来源和类型相关[7]。
本研究中发现在正常对照组中Caveolin-1表达于基底层细胞胞膜,在AK组、BD组、cSCC组表达率分别为36.8%、52.9%、78.9%,染色强度与恶性程度相关。推测Caveolin-1可能在AK、BD的侵袭进展中起着作用。而Langlois等[8]观察到在cSCC中Caveolin-1蛋白表达水平显著低于对照组正常皮肤细胞。此外Trimmer等[9]学者的研究认为Caveolin-1过表达具有降低皮肤鳞癌细胞增殖、迁移和侵袭能力。而降低Caveolin-1的表达同时增加侵袭能力和淋巴结转移。他们的结果和我们的实验结果相矛盾,并且具有争议性的结果在国内外多个研究中如宫颈鳞癌[10,11]、口腔鳞癌[12,13]也存在。我们考虑cSCC的病因和临床表现复杂,目前研究表明紫外线照射、人乳头瘤病毒感染、器官移植、化学制剂等因素均与cSCC的发病密切相关[1]。同时cSCC也常继发于一些皮肤疾病的基础上[14],如光化性角化病、着色性干皮病、盘状红斑狼疮、硬化萎缩性苔藓、扁平苔藓、寻常狼疮、疣状表皮发育不良、遗传性大疱性表皮松解症等。由此我们推测cSCC的异质性可能是本研究结果与国外研究结果出现矛盾的原因。
3.2 c-Met在AK、BD及cSCC中的研究情况 原癌基因c-Met位于人类第7号染色体 7q21-q31,同时c-Met属于酪氨酸激酶家族[15]。临床和基础实验研究发现,肝细胞生长因子与其受体c-Met结合并激活该受体的酪氨酸活性,可以引起酪氨酸的自身磷酸化[16],活化多条下游信号通路,调控细胞的生长、存活和迁移等功能。c-Met过表达在人类恶性肿瘤中被广泛发现,包括甲状腺癌、卵巢癌、胃癌、结直肠癌和肝癌等。
在皮肤病领域,对外阴鳞癌的研究表明[17],VIN I,II经过VINIII到VSCC ,c-Met表达量增加,说明c-Met表达与细胞分化程度有关,过表达与外阴鳞状细胞恶性转变有关。但对皮肤癌前病变及皮肤鳞状细胞癌少有研究报道。
本研究结果显示正常对照组中Met表达在基底层细胞的胞膜或胞浆中。在AK、BD、CSCC表达率分别为26.3%、58.8%、84.2%,表现为随着疾病病变程度的加深,阳性表达率也呈现增加趋势,染色强度也逐渐加深。同样,由此可推测Met在AK癌变,BD、cSCC的侵袭及进展中起着促进肿瘤细胞生长、增殖的作用。同时两两比较的结果显示AK和BD之间有显著差异,而AK与正常组、BD组与cSCC组无统计学意义。说明Met在日光性角化癌变为原位鳞癌中起到非常重要作用。若通过下调Met的表达可能抑制日光性角化病进展为鳞癌,可能为皮肤鳞癌的靶向治疗提供新的靶点。
3.3 Caveolin-1与Met在cSCC中的表达相关性及意义 Korhan等[18]在关于肝癌的研究报道中指出,一方面HGF引发的c-Met激活导致Caveolin-1酪氨酸14的磷酸化和表达的同时上升。为了证实Caveolin-1磷酸化可由c-Met激活,他们使用c-Met受体激酶抑制剂SU11274,阻断c-Met活化,同时抑制了Caveolin-1的磷酸化。结果表明Caveolin-1的磷酸化依赖c-Met激活。另一方面,研究发现Caveolin-1的异位表达加速了c-Met信号传导,导致迁移,侵袭和分支形态发生增强。通过沉默Caveolin-1的表达降低了c-Met的表达和细胞的迁移及侵袭潜能。得出C-met和Caveolin-1相互激活在肝癌的发生、发展、转移、侵袭中起着重要的作用。本实验中Caveolin-1与Met在cSCC中表达呈正相关,我们推测在cSCC中,Caveolin-1与Met在鳞癌的发生、发展、浸润中起着相互促进的作用。
综上所述,对于AK、BD可能发展成cSCC过程中,我们推测Caveolin-1与Met有相互促进、协调作用,促使cSCC发生。

