异型雄性罗氏沼虾遗传多样性的微卫星分析
吕 敏,黄光华,李 旻,杨 琼,卢小花,甘 晖,阮志德,黄立斌,杨彦豪,卢天和,马华威
(1.广西壮族自治区水产科学研究院,广西壮族自治区水产遗传育种与健康养殖重点实验室,广西 南宁 530021; 2.广西壮族自治区水产畜牧学校,广西 南宁 530021 )
罗氏沼虾(Macrobrachiumrosenbergii)是一种大型淡水虾,因其适水范围广、易养殖、肉质嫩滑、商业价值高等特点逐渐成为我国、东南亚乃至全世界重要的水产养殖品种。日益增长的罗氏沼虾产量难以满足逐渐上升的消费和市场需求,需进一步突破产量的限制因素以提高罗氏沼虾产额。由于雄虾较雌虾生长快、成熟个头大、养殖产出量高[1],因此,在苗种培育和养殖中解决导致性别和个体差异的机制是提高产量的关键。
已有研究发现,3种不同形态的雄性罗氏沼虾各具有不同规格的范畴[1]。幼体雄虾基于相对生长率分别被划分为“跳跃生长”和“滞后生长”两种类型[2],经60 d变态发育,前者个体比后者大15倍[3],并且变态发育成蓝色或橙色长臂的大个体雄性,后者发育成小个体雄性[4]。这3种不同形态型的雄虾虽然属于相同发育时期,但在行为、生理、形状上不同,并且其形态差异特征随着发育而逐渐显著,所以这3类形态型代表了其动态发育过程的不同阶段,每尾雄虾都可能通过橙色长臂形态型自小个体蜕变成蓝色长臂形态型[5-6]。虾个体形态差异受遗传和环境影响,但形态遗传是性别二态性状,雌性形态显著可控(h2≈5),雄性形态遗传不可控[7]。
关于罗氏沼虾遗传多样性已有诸多研究,如朱其建等[8]研究了罗氏沼虾抗病选育群体的遗传多样性,陈雪峰等[9]研究了人工养殖与选育对罗氏沼虾遗传多样性的影响,孙成飞等[10]采用微卫星分析法研究了罗氏沼虾6个养殖群体遗传多样性,蒋钦杨等[11-12]对罗氏沼虾不同地理群体的遗传多样和变异情况进行了研究,甘西等[13]开展了罗氏沼虾遗传多样性的RAPD研究,Divu等[14]分离出了罗氏沼虾微卫星,并进行了遗传多样性分析,Chareontawee等[15]对泰国养殖的罗氏沼虾的遗传多样性进行了研究,Liu等[16]研究了不同罗氏沼虾种群遗传多样性分析。不同形态型雄虾的产生有以下原因:(1)遗传差异、变态年龄等个体内在因素[17-18];(2)空间和资源受限等环境因素引起竞争[19];(3)种群地位等级、领地等种群内部社会因素[20]。近些年来,微卫星现代分子标记技术虽未能发现细微遗传差异[8,16],但因其能解决等位酶技术而广泛用于生物育种和遗传研究,具有多态性高、共显性遗传、重复性高和易检测等优点。目前,罗氏沼虾自主或者人为的长期近亲交配导致了种质退化,迫切要求对其进行鉴定区分,再加上罗氏沼虾雄性形态遗传不可控,造成了父本遗传差异精确性评估不足,严重影响了良种选育,因此利用微卫星标记技术摸清近亲交配形态型雄虾的个体生长遗传多样性有助于解决该现实问题。本研究基于罗氏沼虾蓝色长臂型、橙色长臂型、小个体型3种不同形态型的近亲交配雄虾群体,利用8个微卫星位点研究其遗传多样性,旨在为其良种选育提供科学依据。
1 材料与方法
1.1 样品采集
试验虾为广西种群近亲交配成年雄性罗氏沼虾,200尾,由国家级(南宁)罗氏沼虾良种场提供,于良种场中心实验室5 m×5 m×1.8 m养殖池中养殖4个月。基于颜色、行为、生长特征及锯齿状螯,将试验虾分为蓝色长臂型、橙色长臂型、小个体型3种形态型雄虾[21-24]。每种形态型虾50尾,共收集150尾,蓝色长臂型、橙色长臂型、小个体型体质量分别为(14.48±1.05) g、(10.04±1.15) g、(5.86±0.66) g。
1.2 DNA提取
罗氏沼虾腹部肌肉组织基因组DNA提取按照Wizard基因组DNA纯化试剂盒(美国Promega公司)步骤提取,利用紫外分光光度计测定提取液在260 nm和280 nm的吸光值(OD),依据OD260 nm/OD280 nm比率测定DNA含量和纯度,用双蒸液定容1∶40后至-20 ℃保存。
1.3 PCR扩增
PCR反应液制备,共50 μL:10.0 μL 5×PCR buffer,5.0 μL MgCl2(2.5 mmol/L),1.0 μL dNTP (0.2 mmol/L),2.0 μL上下游引物(0.4 μmol/L),24.75 μL无菌 ddH2O,0.25 μL Taq聚合酶,2.0 μL DNA模板,灭菌去离子水补齐。DNA微卫星引物设计参照文献[15]的方法(表1)。PCR反应程序:95 ℃预变性3 min;按照95 ℃变性30 s进行40个循环,每对引物的实际退火温度为48~60 ℃,反应30 s,72 ℃延伸30 s;最后72 ℃延伸40 s,4 ℃保温。PCR扩增产物经2.5%琼脂糖凝胶电泳检测结束后,红色凝胶染红,紫外显色。然后采用聚丙烯酰胺电泳评价PCR产物数,反应液加入含有1×Tris-硼酸(TBE)缓冲液的凝胶体系,在75 V条件下泳动8 min,然后凝胶成像系统(美国AlphaInnotech公司)下观察,以20 bp扩展DNA梯型(美国Linza公司)为参考标准目测法观察等位基因分型和大小。
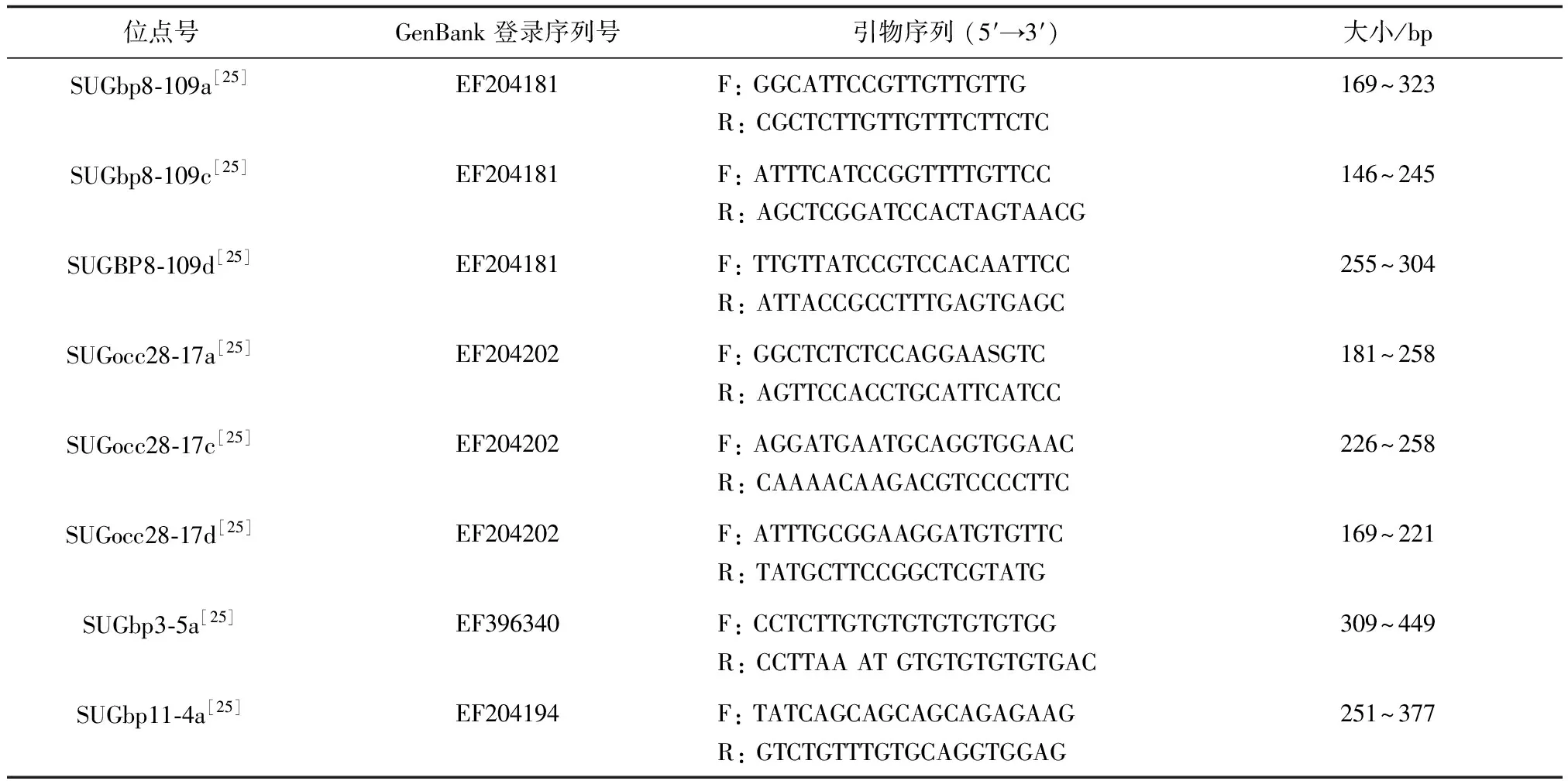
表1 罗氏沼虾8个微卫星位点的特性
注:F:正向,R:反向.
1.4 数据分析
记录每尾雄虾的等位基因数、等位基因复制数、观察杂合度、期望杂合度、基于哈代—温伯格平衡定律的精确偏差值,并利用ARLEQUIN 3.11分析微卫星位点差异[26]。遗传分化程度采用F统计分析,如种群等位基因频率参数[群体内近交系数FIS、总群体近交系数FIT、群体间分化系数FST)],参照文献[27]方法计算基因流(Nm)[Nm=FST×0.25(1-FST)/FST×FIS]。用对基因Nei系数法测定基因间距,基于非加权配对算数平均法利用POPGEN 1.32软件构建系统树图[28]。
2 结果与分析
2.1 种群遗传多样性
由表2可知,除小个体型的SUGbp8-109a位点外,其他位点遗传信息呈多态性,所有统计分析中要移除该位点。3种形态型的雄虾种群显示高度遗传差异,蓝色长臂型、橙色长臂型、小个体型的等位基因数分别为2.985、3.782和2.827,观察杂合度分别为0.556、0.474和0.475。哈代—温伯格平衡定律的精确偏差值(P)采用Markov链方法评估,随后被Bonferroni多重假设试验校正。除了橙色长臂型的SUGbp8-109a、SUGbp8-109c、SUGocc28-17d位点以外,其他位点显著偏移。
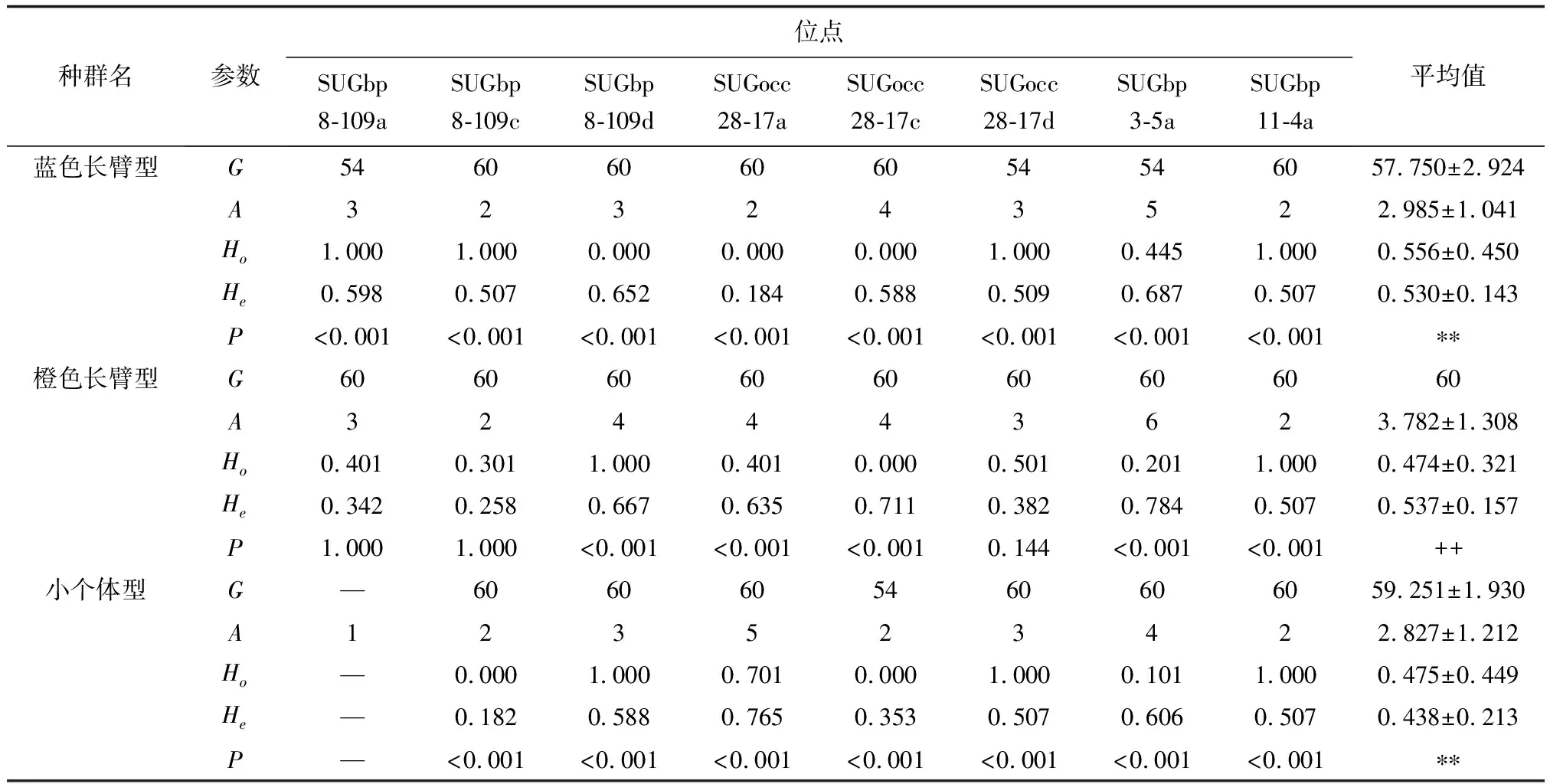
表2 3种形态型雄性罗氏沼虾8个卫星位点遗传多样性
注:G.基因拷贝数,A.等位基因数,Ho.观察杂合度,He.期望杂合度,P.哈代—温伯格平衡定律偏差值.—.无多态性,**.非常显著,++.不显著.
2.2 样本遗传分化和关系
样本群体间遗传分化系数平均值为0.2877,说明样本分化呈现显著差异(表3)。样本基因流平均值为0.7452,SUGbp8-109d位点基因流最大,为1.1074,SUGbp8-109a位点基因流最小,为0.2044。全部样本的总群体近交系数和群体内近交系数值呈显著差异(P<0.05)。由表4可知,最大基因距离位于蓝色长臂型和小个体型,为1.0369,最小基因距离位于蓝色长臂型和橙色长臂型,为0.7497。
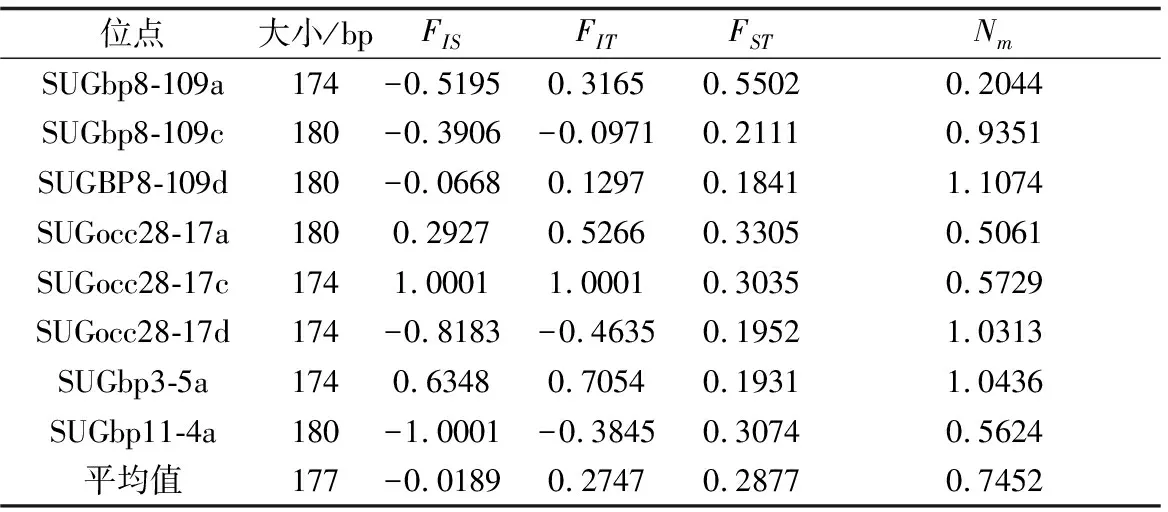
表3 3种形态型雄性罗氏沼虾8个微卫星位点F统计值
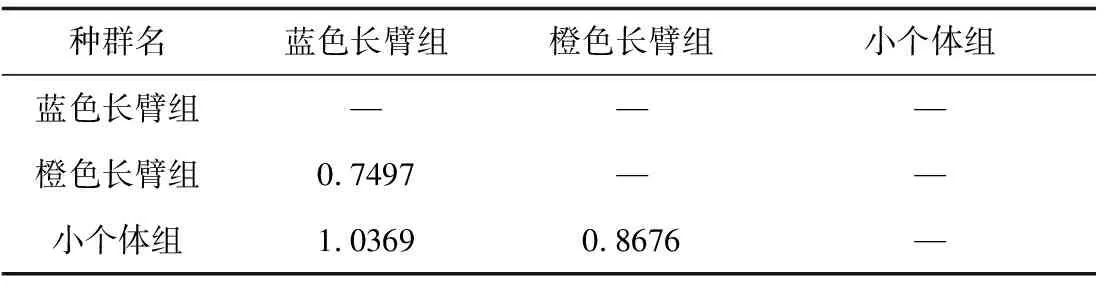
表4 3种形态型雄性罗氏沼虾8个微卫星位点Nei数据的基因间距
3 讨 论
3.1 种群遗传多样性
微卫星分子标记技术作为一种最有效率的中性分子标记工具广泛应用于水产养殖领域[25,29-30]。目前,国内外学者采用微卫星分子标记技术对罗氏沼虾遗传多样性进行了研究[8,15,29],但主要研究不同种群的遗传多样性,对自然或者人工近亲交配获得的同性别间遗传信息获知较少。本研究中,以8个易识别、高度多态的罗氏沼虾微卫星位点为标准,研究3个近亲雄虾组遗传结构。结果显示,除了小个体型的SUGbp8-109a位点,所有微卫星位点均显示高度差异性;另外,蓝色长臂型、橙色长臂型、小个体型分别含有24、28、22个不同等位基因,表明3组雄虾中的等位基因具有较高的多样性和丰度。利用6个微卫星位点研究野生罗氏沼虾群体遗传多样性发现,每个位点的平均等位基因数呈高度多样性[14],然而,仅通过每个微卫星标记位点的等位基因数获取该种基因多样性有限[32]。
基因杂合度又称基因多样性,是指示基因差异的最佳参数[33]。由试验结果可知,所有采样组中观察杂合度平均值低于期望杂合度平均值,表明雄性罗氏沼虾的杂合度下降。3组样品中的观察杂合度平均值为0.474~0.556,与已报道的罗氏沼虾野生种和繁殖种一致[14-15,31]。
3.2 样本遗传分化和关系
群体内近交系数表示基因随机配对的偏差程度,其值为正表示杂合具有显著不足,值为负表示存在过量杂合体。本研究中群体内近交系数为-0.0189,表示杂合体过剩,且过剩数量较少。除SUGocc28-17a,SUGocc28-17c、SUGbp3-5a位点外,所有位点的群体内近交系数值均为负数,说明这些位点具有过量的杂合体,可能是无效等位基因、基因分型错误、近亲繁殖或Wahlund效应造成的[34]。
卡方(χ2)和似然率(G2)用于检验基因位点上显著偏离(P<0.05)哈代—温伯格平衡定律的群体。本研究中,除了橙色长臂型的3个基因位点外,所有基因位点与哈代—温伯格平衡定律存在偏离,可能是由于无效等位基因的存在。通过对斑节对虾(Penaeusmonodon)[35-37]及泰国罗氏沼虾繁殖种群[15]遗传多样性的研究发现,基因分型误差也可能造成基因位点与哈代—温伯格平衡定律偏离;本研究结果可能与基因分型误差也有关系。小个体型中的SUGbp8-109a基因位点是无效等位基因,研究中要注意删除该位点以精确评价近亲交配和减少基因多样性丧失。另外,3组样品的基因间距为0.7497~1.0369,说明8个微卫星标记具有极高差异性,表明环境对样品组间遗传变异的影响呈同域分布性。蓝色长臂型与小个体型数值最大,说明两者基因间距最大;蓝色长臂型与橙色长臂型基因间距小,表明两者遗传上相近或同源。
3.3 近亲交配影响异型雄性的遗传多样性
近年来,对不同国家或区域的罗氏沼虾养殖种群和野生种群的基因多样性进行了研究[14-16]。本研究基于同一种群近亲交配基础上,选取3种不同形态型雄虾开展遗传多样性研究,并且未知造成3种形态型差异的专一位点基因,这种差异可能是由于遗传等基因因素、食源和生存空间等环境因素,以及自身内部群体因素等所致。雄性罗氏沼虾的显著差异不仅表现在能说明其遗传可能性的形态上,还体现在肝指数和生化特征上[38]。研究结果显示,经4个月养殖后,蓝色长臂型平均体质量为(23.34±1.26) g,橙色长臂型平均体质量为(18.39±1.37) g,小个体型平均体质量为(9.06±0.53) g,分别占研究样本群体的21%、62.5%、16.5%。因此,其存在形态学、解剖学和生理学上的差异[24,39]。
微卫星分子标记在罗氏沼虾群体遗传多样性研究中应用较多[40-43],而对近亲交配雄虾的遗传信息未见报道,由于雄性罗氏沼虾在遗传形态上不可控,研究其遗传多样性能为父本选育提供遗传信息,提高苗种质量。由以上讨论可知,通过近亲交配的3种形态型雄性罗氏沼虾存在遗传差异,这种遗传差异存在于形态和生理上,因此,本研究结果可为罗氏沼虾优质父本选育提供基础性遗传信息,同时也对调控雄性罗氏沼虾遗传发育具有一定意义。

