海洋经济软体动物肌肉副肌球蛋白分布特性初探
宋 扬,田元勇,张 晴,周晏琳,袁春红,刘俊荣
(1.大连海洋大学,食品科学与工程学院,辽宁 大连 116023; 2.岩手大学 农学部,日本 岩手县 0208550 )
经济贝类构成我国最重要的海水养殖产业,2016年我国海水养殖总产量约1.96×107t,其中经济贝类产量约为1.42×107t,占海水养殖总产量的72%[1]。除传统加工品外,活品贝类因高品质和高附加值越来越受到消费者欢迎和产业重视。活品贝类的品质除受捕后流通条件影响以外,与肌肉蛋白组分及理化性质有直接的关系,此外,不同经济品种之间的差异也不可忽视。与脊椎类的鱼体肌肉相比,副肌球蛋白为肌原纤维蛋白中主要组分之一,并以副肌球蛋白为核心,再结合肌球蛋白构成粗丝,因此,贝类的肌丝直径相比于脊椎动物更粗[2]。近些年,对副肌球蛋白结构[3-8]、蛋白表达及氨基酸序列[9-11]、凝胶性及免疫活性等功能特性[12-15]的研究颇多。Yphantis等[16]发现,硬壳蛤(Mercenariamercenaria)副肌球蛋白在提取过程中容易发生降解,提取液中加入0.01 mol/L EDTA,可得到分子量为210 ku的α型副肌球蛋白,而前人采用醇沉法得到的200 ku β型副肌球蛋白,为α型的降解产物。Yeung等[5]进一步证明,β副肌球蛋白是α副肌球蛋白C末端肽链部分降解产生。此外,在硬壳蛤肌肉中还发现了副肌球蛋白的聚合物[17],副肌球蛋白的聚合物是否在所有软体动物中存在,其为天然形成的还是在提取过程中形成的尚不明确。
副肌球蛋白在贝类肌肉紧张收缩机制中发挥重要作用[18],也会对贝类死后肌肉的变化产生重大影响,进而影响高端产品如刺身产品的品质。探究副肌球蛋白性质,便于进一步揭示贝类活品品质及死后贝类肌肉状态变化机理。另外,相对于鱼类肌动球蛋白凝胶机理,贝类副肌球蛋白独特的凝胶特性,在改善肌动球蛋白凝胶方面同样具有探索价值[13-14]。总之,有必要对贝类肌肉中副肌球蛋白的分布及性质进行先期系统研究。
选取菲律宾蛤仔(Ruditapesphilippinarum)、毛蚶(Scapharcasubcrenata)、皱纹盘鲍(Haliotisdiscushannaiino)、脉红螺(Rapanavanosa)及长蛸(Octopusvariabilis)等5个常见经济品种作为研究对象,在各品种可食部分的一般组成及特性比较基础上,重点对肌肉组织副肌球蛋白的分布特性进行初步鉴定,旨在逐步揭示蛋白组分特别是副肌球蛋白与贝类肌肉品质的关联机制,包括不同品种肌肉品质的差异,以及捕获后活品品质变化等机理。
1 材料与方法
1.1 试剂与仪器
所用化学试剂主要有SDS、聚丙烯酰胺及β-巯基乙醇(美国Sigma公司)。尿素、三羟甲基氨基甲烷、氯化钠、高氯酸等(国药集团化学试剂有限公司),所用试剂均为分析纯。
所用仪器设备有HG-200高速分散均质机(日本HSIANGTAI公司)、GL-21M高速冷冻离心机(德国HERMLE公司)、AE-6500平板电泳槽(日本ATTO株式会社)、Lambda 25紫外可见分光光度计(珀金埃尔默仪器有限公司)、L-8900全自动氨基酸分析仪(日立高新技术公司)、MALDI TOF/TOF 4800飞行时间质谱仪(AB SCIEX质谱系统公司)。
1.2 原料采集与样品处理
菲律宾蛤仔、毛蚶、脉红螺、皱纹盘鲍、长蛸于2016年6月购自大连新长兴水产品市场,全部为活品状态,运到实验室后立即进行处理。其中,菲律宾蛤仔及毛蚶分别取全部软体组织,闭壳肌(菲律宾蛤仔)及足肌(毛蚶),脉红螺与皱纹盘鲍取肌肉组织,长蛸取外套膜和足部。上述各样品采取后迅速于-40 ℃下保存待分析。
一般化学组成采用原料可食部位(菲律宾蛤仔、毛蚶全部软体组织,皱纹盘鲍、脉红螺除去内脏后软体组织,长蛸肌肉组织);氨基酸测定取各样品肌肉组织(菲律宾蛤仔闭壳肌,毛蚶、皱纹盘鲍、脉红螺足肌,长蛸外套膜)。
1.3 分析方法
1.3.1 一般化学组成分析
一般化学组成分析包括水分、粗脂肪、粗蛋白、总糖及灰分。分别采用直接干燥法(GB 5009.3—2010)测定水分含量,灼烧称量质量法(GB 5009.4—2010)测定粗灰分含量,凯氏定氮法(GB 5009.5—2010)测定粗蛋白质含量,索氏抽提法(GB/T 5009.6—2003)测定粗脂肪含量,采用分光光度法(GB 9695.31—2008)测定总糖含量。
1.3.2 氨基酸组成分析
采用酸水解法(GB/T 5009.124—2003)测定样品中氨基酸含量。分别称取各种类肌肉样品0.1 g,加入6 mol/L HCl于蛋白水解管中,吹入氮气密封后于110 ℃烘箱中水解24 h,采用定量滤纸过滤后,蒸馏水定容至25 mL,取4 mL在真空条件下50 ℃水浴蒸发,用4 mL 0.02 mol/L HCl溶解,稀释4倍后用0.45 μm滤膜过滤后,用氨基酸自动分析仪测定氨基酸含量,上样量20 μL。
1.3.3 蛋白质营养价值评价
根据联合国粮农组织/世界卫生组织专家委员会于1973年推荐的氨基酸评分标准模式(干基)[19],进行营养价值评定,氨基酸评分(AAS)和必需氨基酸指数(EAAI)按下式计算:
式中,n为比较的必需氨基酸个数,a、b、c、…、g为贝类肌肉蛋白质的必需氨基酸含量(%),ae、be、ce、…、ge为全鸡蛋蛋白质的必需氨基酸含量(%)。
1.3.4 蛋白组成及定量分析
分别称取5种软体动物肌肉样品5.0 g,加入4倍体积0.1 mol/L NaCl-20 mmol/L Tris-HCl (pH 7.0)缓冲溶液,以30 s为间隔,于10 000 r/min条件下均质3次,每次均质时间为30 s,以上操作在冰水浴中进行。分别取0.02 mL匀浆液,加入2.0 mL蛋白溶解液[含有2% SDS,8 mol/L尿素、2% β-巯基乙醇,50 mmol/L Tris-HCl (pH 8.0)],混匀后于100 ℃加热5 min。取0.01 mL用于SDS-PAGE分析。浓缩胶质量分数5%,分离胶质量分数7.5%,考马斯R-250染色,醋酸甲醇溶液进行脱色。使用Multimate Gauge软件对电泳图谱进行定量分析。
1.3.5 质谱分析
将SDS-PAGE干胶粒用0.4 mL 0.1 mol/L NH4HCO3/30% ACN脱色液清洗脱色至透明,弃上清液,加入 0.1 mol/L NH4HCO3,室温孵育15 min。弃上清液冻干,之后加入测序级Trypsin溶液,37 ℃酶解。吸出酶解液,转移至新EP管中,原管加入100 μL 60% ACN/0.1% TFA,超声15 min。合并酶解液并冻干,冻干样品用2 μL 20%乙腈复溶。取1 μL溶解样品,直接点于样品靶上,溶剂自然干燥后,再取0.5 μL过饱和CHCA基质溶液,点至对应靶位上并自然干燥。并用串联飞行时间质谱仪进行测试分析,激光源为355 nm波长的Nd:YAG激光器,加速电压为2 kV,一级质谱扫描范围为0~4000 Da,选择信噪比>50的母离子进行二级质谱(MS/MS)分析。数据使用Uniprot数据库进行比对分析。
1.3.6 数据处理
每个试验组均设3个平行,数据用平均值±标准差表示,经SPSS 17.0软件进行单因素方差分析,采用Duncan氏新复极差检验法进行显著性差异分析处理,P<0.05表示差异显著。
2 结 果
2.1 化学组成特性及氨基酸分布
2.1.1 可食部位的一般化学组成特性
菲律宾蛤仔、毛蚶、脉红螺、皱纹盘鲍及长蛸5个研究样本的一般化学组成(干基)分析结果见表1。总体来看,均呈现高蛋白低脂肪的基本化学特性,鲜品原料的水分含量为76%~83%,粗蛋白含量为60%~82%,粗脂肪含量低于4%,灰分7%~10%;总糖含量为10%~30%,也呈现了软体类多糖含量丰富的特征。
2.1.2 肌肉组织的氨基酸分布特性
对5种海洋经济动物肌肉中氨基酸种类和含量进行分析(表2)。除色氨酸在酸水解处理过程中被破坏未能检出,几种原料肌肉中均含有17种氨基酸,并且亮氨酸和赖氨酸在几种原料中的含量均较高,原料间无显著差异。非必需氨基酸中,丙氨酸、天冬氨酸、甘氨酸及谷氨酸含量较高,谷氨酸最多,含量为2.58~3.31 g/100 g。根据必需氨基酸评分,菲律宾蛤仔和毛蚶必需氨基酸指数分别为51.75、56.13。脉红螺、皱纹盘鲍、长蛸必需氨基酸指数分别为62.82、64.04、72.48。缬氨酸为菲律宾蛤仔、脉红螺、长蛸、皱纹盘鲍的第一限制性氨基酸,甲硫氨酸+半胱氨酸为毛蚶第一限制氨基酸。几种原料必需氨基酸/总氨基酸接近世界卫生组织/国际粮农组织推荐的模式35.38%,是优质食用蛋白源(表3)。

表1 5种海洋经济动物可食部位的一般化学组成 %
注:大写字母代表不同原料间湿基差异显著(P<0.05),小写字母代表不同原料间干基差异显著(P<0.05).其他表同.

表2 5种海洋经济动物肌肉蛋白的氨基酸组成比较 g/100 g湿基
注:**必需氨基酸.
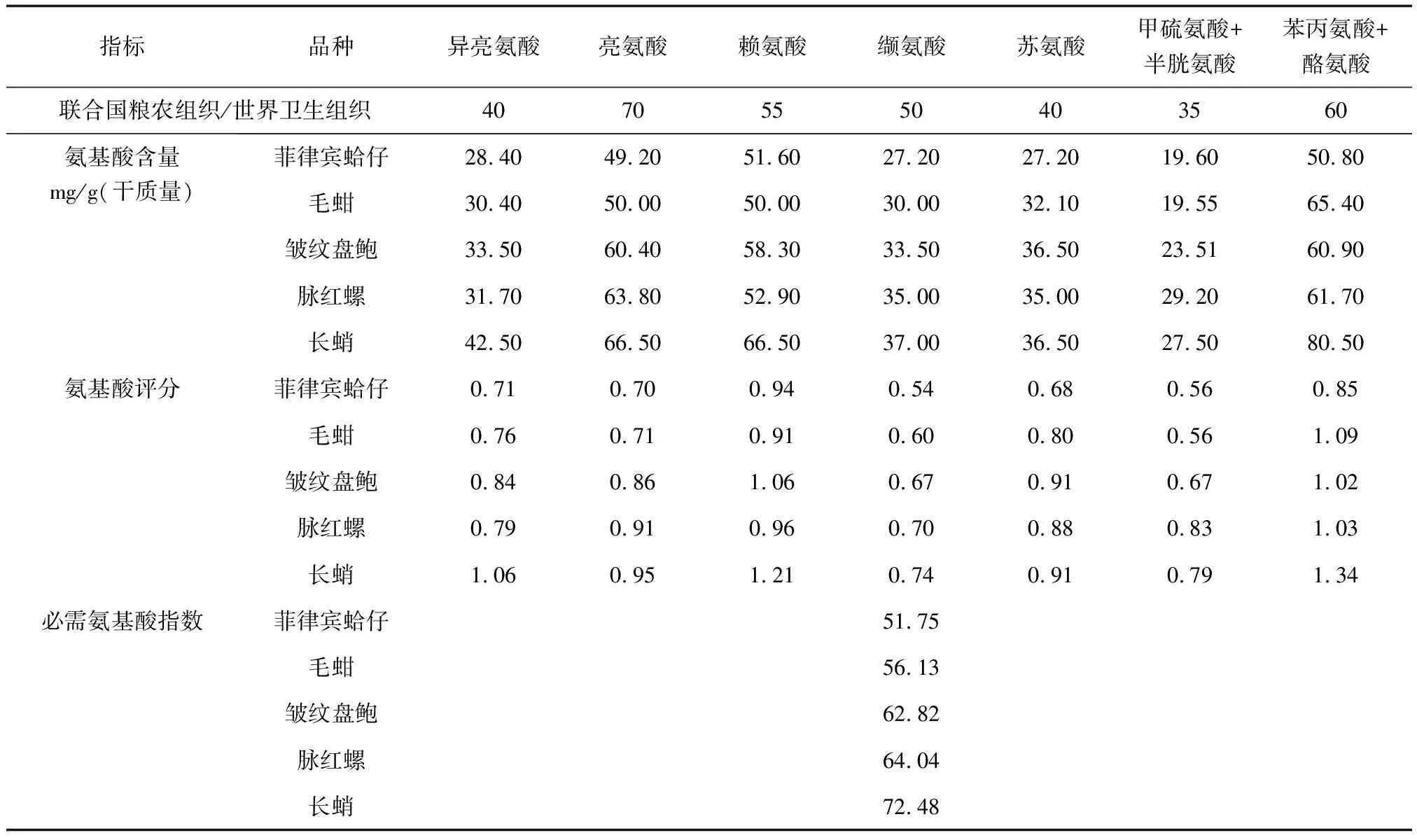
表3 5种海洋经济动物肌肉蛋白必需氨基酸评分比较
2.2 肌肉组织的蛋白组成与分布
2.2.1 肌肉蛋白组分分析
对5种海洋经济动物肌肉组织进行蛋白组成分析(图1)。结果表明,其共性特征体现在,均含有肌动蛋白(44.3 ku附近)、副肌球蛋白(97.2 ku附近)、肌球蛋白(200 ku附近)及肌球蛋白轻链等重要蛋白组分,此外,还含有水溶性蛋白条带。不同品种间肌肉蛋白组成的差异体现在未知蛋白聚合物上(200 ku以上),除头足类(长蛸)外,其余4种均出现分子量高于肌球蛋白(200 ku)的蛋白聚合物条带,从分子量估算,其极有可能是副肌球蛋白聚合体,后续对该条带进行了分析鉴定(见2.3);此外,值得关注的是,副肌球蛋白分子量的大小表现出品种间的差异,有待进一步探究。
2.2.2 肌肉蛋白组分的定量分析
进一步对5种海洋经济动物肌肉的蛋白组成进行定量分析(表4)。结果表明,肌球蛋白在毛蚶、长蛸、皱纹盘鲍中占比均大于20%,菲律宾蛤仔和脉红螺则为17%~18%;肌动蛋白含量平均约30%,其中毛蚶足肌中占比最大为38.74%,菲律宾蛤仔占比最小,为21.63%;副肌球蛋白单体在皱纹盘鲍、脉红螺、长蛸中含量约为25%,在毛蚶和菲律宾蛤仔肌肉中占比分别为17.08%、19.88%;此外,菲律宾蛤仔、毛蚶及皱纹盘鲍还分布有分子量高于200 ku的蛋白聚合物(2.3部分鉴定为副肌球蛋白聚合体),占比分别为7.47%、15.94%及15.31%。总体而言,副肌球蛋白在菲律宾蛤仔、毛蚶及皱纹盘鲍肌肉组织中含量比较丰富,依次为27.35%、33.02%和35.22%。
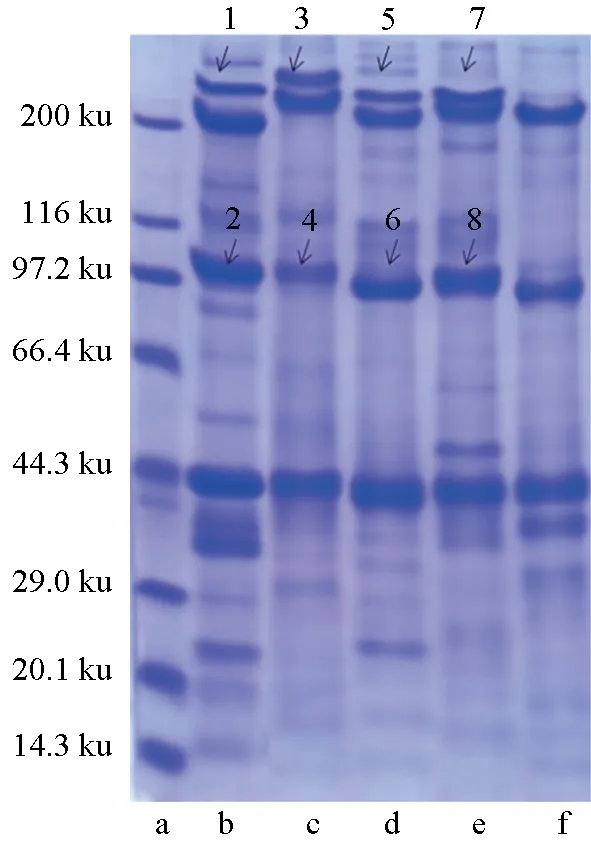
图1 5种海洋经济动物肌肉蛋白的SDS-PAGE分析a.标准蛋白; b.菲律宾蛤仔; c.毛蚶; d.皱纹盘鲍; e.脉红螺; f.长蛸.
2.3 副肌球蛋白的质谱分析与鉴定
菲律宾蛤仔、毛蚶、皱纹盘鲍以及脉红螺均在肌球蛋白条带上方出现未知蛋白条带,依次为图1中所示1、3、5、7;为进一步分析鉴定疑似副肌球蛋白聚合物的未知条带,结合副肌球蛋白条带(图1中2、4、6、8)进行质谱分析。
以菲律宾蛤仔为例,未知蛋白聚合物(条带1)和副肌球蛋白(条带2)在蛋白总分可信度高于95%条件下,均能够与同种副肌球蛋白匹配,覆盖率分别为23%和19%(表5),且从SDS-PAGE的移动距离可计算副肌球蛋白(条带2)分子量,为101.4 ku,未知蛋白聚合物(条带1)蛋白分子量为211.0 ku,由此,推测该未知蛋白聚合物即是副肌球蛋白聚合体(aPM)。同样,推定毛蚶(条带3)与皱纹盘鲍(条带5)为副肌球蛋白的聚合体。

表4 5种海洋经济软体动物肌肉蛋白组成分析结果 %
注:*未知蛋白条带经质谱分析为副肌球蛋白聚合体;**经质谱分析非副肌球蛋白聚合体.

表5 5种海洋经济软体动物肌肉组织中副肌球蛋白的分析鉴定
注:*长蛸,经分析鉴定,不含副肌球蛋白聚合体条带;**脉红螺,经分析鉴定,聚合体条带未鉴定为副肌球蛋白.
3 讨 论
相对于脊椎鱼类,副肌球蛋白在无脊椎动物中的分布具有突出的特点,也曾受到不同领域学者的关注。副肌球蛋白的研究始于20世纪初,起初研究主要以双壳贝类闭壳肌为研究对象,20世纪40年代中期获得命名“副肌球蛋白”[20],20世纪70年代,一些小型环节动物门和线性动物门的副肌球蛋白研究较为活跃[21-22]。在此之后20年间陆续有关于水产经济动物的研究。Melson等[23]对几种软体动物肌肉副肌球蛋白提取发现,含有0.01 mol/L EDTA与不含EDTA提取的硬壳蛤(Mercenariamercenaria)副肌球蛋白分子量相差7 ku,但是对美洲牡蛎(Crassostreavirginica)、左旋香螺(Busyconcontrarium)、西印度石鳖(Acanthopleuragranulata)无影响;Mykles[24]研究了美洲螯龙虾(Homarusamericanus)肌肉中蛋白组分,发现肌球蛋白重链分子量为175 ku、肌动蛋白分子量为41 ku、原肌球蛋白34 ku、副肌球蛋白分子量为96~99 ku;Costello等[25]研究表明,美洲螯龙虾不同组织肌肉中副肌球蛋白分子量分别为105 ku和110 ku;Sonobe等[3]报道,副肌球蛋白广泛存在于海参、海胆等后口动物平滑肌中,但脊椎动物中无论平滑肌还是横纹肌均没有副肌球蛋白,在无脊椎动物向脊椎动物过渡态的文昌鱼肌肉中不含副肌球蛋白,但在文昌鱼脊索中检测到了副肌球蛋白,其在进化过程中副肌球蛋白表达受到抑制,进而在进化过程中逐渐消失。到近些年才有关于副肌球蛋白功能性在原料学属性方面的研究[14-15,26]。总体来讲,有关水产经济类的研究缺乏系统连续性。
5种海洋经济软体动物蛋白分布呈现差异性,不同品种间蛋白组成差异可能影响肌肉蛋白的功能性。Fukuda等[14,27]研究表明,副肌球蛋白比肌动球蛋白具有更好的凝胶强度。当温度大于55 ℃,副肌球蛋白凝胶比肌动球蛋白具有更好的弹性,尤其在80 ℃,尽管蛋白含量很低,副肌球蛋白凝胶韧性远大于肌动球蛋白。王帅[28]等报道,鲢鱼(Hypophthalmichthysmolitrix)肌肉添加扇贝闭壳肌后,能明显地提高产品的凝胶强度。
菲律宾蛤仔、毛蚶、皱纹盘鲍肌肉中含有副肌球蛋白聚合体,关于副肌球蛋白聚合体的形成机制目前尚未见报道,为探讨是否为样品处理过程导致单体发生聚合,将菲律宾蛤仔闭壳肌直接用蛋白变性剂处理后进行SDS-PAGE分析,电泳结果显示,同样存在副肌球蛋白聚合体的条带,由此初步推测副肌球蛋白聚合体可能为天然存在。Watabe等[18,29]对硬壳蛤闭壳肌磷酸化研究发现,肌原纤维蛋白中只有副肌球蛋白聚合体能被内源性激酶磷酸化。此外,还证明了磷酸化位点位于副肌球蛋白C末端。“Catch”肌肉中副肌球蛋白磷酸化水平高于非“Catch”肌肉。聚合体的形成是否与磷酸化机制有关值得进一步探索。
经济软体动物肌肉蛋白组分具有动物源蛋白的共性,均含有肌球蛋白、肌动蛋白、副肌球蛋白及原肌球蛋白等主要蛋白组分。副肌球蛋白对软体类肌肉蛋白功能性质的影响值得关注,一方面,副肌球蛋白在软体类中含量十分显著,另一方面,副肌球蛋白的分布特性具有品种的差异性。本研究为揭示蛋白组分特别是副肌球蛋白与贝类肌肉品质关联机制的前期工作,进一步的研究将在不同品种肌肉品质的差异以及捕获后活品品质变化机理等方面开展。

