LI-RADS与亚洲肿瘤峰会标准对小肝癌的诊断效能分析
王 影,余深平
(1.中国科学技术大学附属第一医院影像科,安徽合肥 230000;2.中山大学附属第一医院放射科,广东广州510080)
肝细胞癌(hepatocellular carcinoma,HCC)发病率高,死亡率高,是肝硬化患者的最常见死因之一[1]。出现症状后才发现的肝细胞癌通常直径较大,预后差,5年生存率只有0~10%。但是小肝癌的5年生存率大于50%,部分可治愈[2]。因此尽早发现并治疗小肝癌是最有效的降低HCC死亡率的方法。所以美国肝病协会、欧洲肝病协会、亚太肿瘤峰会等国际组织机构提出的HCC临床实践指南都建议对有HCC发病风险的人进行筛查以利于更早期的发现小肝癌[3-5],这些临床实践指南多以特征性的强化方式来诊断HCC,如2009年亚洲肿瘤峰会(asian oncology summit,AOS)的临床实践指南提出,肝脏的结节无论大小,只要同时出现动脉期高强化和门脉期/延迟期低强化的特征性影像学征象,即可明确诊断为HCC[4],但已有系统性研究表明CT诊断的敏感度、特异度分别为55%~80%和89%~96%,其敏感度较低[6-7]。而LI-RADS是继乳腺影像报告和数据管理系统(BI-RADS)之后的第二个标准化的器官疾病分级诊断评估系统,具有全面性和规范化的特点[8]。因此本研究拟分别以直径≤30 mm和<20 mm的具有HCC发病风险患者的肝内病变为研究对象,通过比较LI-RADS(v2013)和AOS标准对小肝癌的诊断效能的差异,以验证LI-RADS是否比以AOS为代表的以HCC典型强化特征为诊断标准的多个临床实践指南提出的影像学诊断标准更有优势。
1 材料与方法
1.1 一般资料
收集2010年1月至2012年12月在中山大学附属第一医院行上腹部CT/MRI检查的220例肝脏病变患者,均有HCC发病风险,如:①乙型肝炎病毒(hepatitis B virus,HBV)或丙型肝炎病毒(hepatitis C virus,HCV)感染;② 大于35岁的男性;③ 酗酒;④ 甲胎蛋白(alpha fetal protein,AFP)异常;⑤患有遗传性代谢病,如血色素病、a1抗胰蛋白酶缺乏症、糖原贮积症、迟发性皮肤卟啉症、遗传性高酪氨酸血症、自身免疫性肝炎等。
220例(男180,女40)患者,中位年龄为56(23~80)岁,共包括直径≤30 mm肝脏病变共289处,平均最大径约17.1(4~30)mm。其中106例(男90,女16)患者中,中位年龄54.5(23~80)岁,共包括直径<20 mm肝脏病变共129处,平均最大径约12.1(4~19)mm。
金标准:LR1、LR2级病变以临床随访结果或病理结果为金标准,LR3级主要以病理结果为金标准(但LR3级临床随访缩小或消失亦可作为金标准),LR4及LR5级以病理结果为金标准。
排除标准:①LR1及LR2级病变未经随访或病理证实;②LR3级病变无病理且随访增大,LR4至5级病变无病理结果或病理结果无法明确定性;③经过局部治疗(射频消融、碘油栓塞)而无治疗前该靶病灶影像学资料;④金标准证实为非HCC的其他恶性肿瘤(由于非HCC的其他恶性肿瘤与LR1至5级间无递进关系);⑤影像学资料伪影较大影响分析。研究工作经院伦理委员会批准,并告之患者。
1.2 仪器与方法
扫描仪器为东芝64排螺旋CT扫描仪及siemens magnetom trio/verio 3.0 T MRI扫描仪。CT行上腹部平扫及增强检查,分别于注射对比剂后30~35 s、60~65 s、180 s行动脉期、门脉期双期增强扫描或多期增强扫描。对比剂为优维显(300 mg/mL),注射剂量80~100 mL,经肘前静脉一次性注射,注射流率为3~4 mL/s。扫描管电压120 kV,管电流300 mAs,准直32 mm×1.0 mm,螺距0.906,矩阵512×512,原始数据重建层厚1.0 mm,间距0.5 mm;重建图像层厚5 mm,层距5 mm。MRI行上腹部平扫及增强检查,对比剂为钆喷酸葡胺(Gadolinium-diethylenetriamine pentaacetic acid,Gd-DTPA),注射剂量 0.1 mmoL/kg,注射流率2 mL/s。扫描序列包括:T1WI同反相位,T2WI及脂肪抑制T2WI;分别于注射对比剂后15~25 s、50~60 s、95~120 s及3 min采用VIBE序列行动脉期、门脉期、平衡期及延迟期扫描;弥散加权成像(diffusion weighted imaging,DWI)采用呼吸门控单次激发平面回波成像(single-shot echo-plannar imaging,SS-EPI)序列,b值取50、400、800 s/mm2。
1.3 诊断标准
1.3.1 LI-RADSS(v2013)的诊断依据 LR1肯定良性病变:影像学表现典型的良性病变(囊肿、血管瘤、灌注异常、脂肪浸润、肝动脉-门静脉分流等)。LR2可能是良性病变:影像学表现不典型的良性病变。LR3可疑HCC:d<20 mm时,为肿瘤样病变+动脉期高强化+无其它主要征象(门脉期/延迟期低强化、包膜、生长迅速),或肿瘤样病变+动脉期等/低强化+最多1个其它主要征象;d≥20 mm时,为肿瘤样病变+动脉期低强化+无其它主要征象,或任意大小的非肿瘤样病变但非LR1、2级,或影像学征象不典型,不能诊断为LR1、2、4、5级,或可达到LR4/LR5级标准,但影像学征象维持2年不变。LR4可能为HCC:4A(d<20 mm)时,为肿瘤样病变+动脉期高强化+1个其它主要征象,或肿瘤样病变+动脉期等/低强化+2个其它主要征象,或可能有静脉癌栓;4B(d≥20 mm)时,为肿瘤样病变+动脉期高强化+无其它主要征象,或肿瘤样病变+动脉期等/低强化+至少1个其它主要征象,或可能有静脉癌栓。LR5肯定为HCC:5A(d:10~19 mm)时,为肿瘤样病变+动脉期高强化+2个其它主要征象,或肯定有静脉癌栓;5B(d≥20 mm)时,为肿瘤样病变+动脉期高强化+至少1个其它主要征象,或肯定有静脉癌栓。
1.3.2 AOS的影像学诊断标准 同时出现动脉期高强化+门脉期/延迟期低强化为HCC,否则为非HCC。
1.4 统计学处理
分别根据LI-RADS(v2013)和AOS的影像学诊断标准对所有病变进行诊断,前者的诊断结果分为LR1至LR5级,后者的诊断结果分为HCC和非HCC,比较LI-RADS(v2013)和AOS的影像学诊断标准诊断小肝癌的敏感度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)、ROC曲线及AUC值,ROC曲线及AUC值采用SPSS 20.0计算。
2 结果
2.1 直径≤30 mm病变的比较
2.1.1 影像学征象 本组病例共有289处病灶:囊肿52处;血管瘤13处;早显灶7处,均呈楔形,动脉期强化程度明显高于周围肝实质,平扫及门脉期密度/信号均与周围肝实质相等;不典型早显灶25处,呈结节样或边界不清,随访均无增大,部分缩小或消失;局灶性脂肪沉积2处、肝岛1处;肝动脉门静脉分流3处、肝局灶性结节增生1处;同时出现动脉期高强化及门脉期/延迟期低强化者86处,其中确诊为HCC者74处;仅出现动脉期高强化、门脉期/延迟期密度/信号仍等于或稍高于周围肝实质者63处,其中确诊为HCC者43处(图1 B-D);动脉期强化程度与周围肝实质相仿或低于周围肝实质且无门脉期/延迟期低强化者32处,其中确诊为HCC者14处;动脉期强化程度与周围肝实质相仿或低于周围肝实质但出现门脉期/延迟期低强化的病变有4处,病理均为HCC(图2 D、E)。

图1 LR 4B级病变Fig.1 Lesion of score LR 4B

图2 LR3级病变Fig.2 Lesion of score LR 3
2.1.2 LI-RADS(v2013)的诊断结果 以LR1至2级为阴性,LR3至5级为阳性:LR1至2级104处,病理或随访情况均证实为良性病变,NPV为100%;LR3至5级185处,其中135处确诊为HCC,LI-RADS(v2013)的敏感度为100%,特异度为67.53%,PPV为72.97%,NPV为100%(表1),AUC值为0.843(图3)。LR3级54处(图2),27处病理确诊为HCC,PPV为50%;LR4级63处(图1),46处确诊为HCC,PPV为73%;LR5级68处,62处确诊为HCC,PPV为91%(表2)。
2.1.3 AOS临床实践指南的诊断结果 86处病变诊断为HCC,确诊为HCC者74处;203处病变诊断为非HCC,确诊为HCC者61处(图1、2);AOS的敏感度为55%,特异度为92%,PPV为86%,NPV为70%(表3),AUC值为0.735(图3)。
上述结果显示,对于直径≤30 mm的小肝癌来说,LI-RADS(v2013)的AUC值高于AOS,前者的敏感度、NPV明显高于AOS,而特异度、PPV仅稍低于AOS。

表2 LI-RADS(v2013)各级预测值(d≤30 mm)Table 2 The NPV or PPV of each grade in LI-RADS(v2013)(d≤30 mm)

图3 直径≤30 mm的肝脏病变LI-RADS和AOS标准的ROC曲线Fig.3 The comparison of ROC curve between LI-RADS and AOS criteria in liver lesions(d≤30 mm)

表3 AOS诊断结果与金标准对照Table 3 The result of AOS criteria compared with gold standard [n(%)]

表4 LI-RADS(v2013)诊断效能(d<20 mm)Table 4 The diagnostic efficiency of LI-RADS(v2013)(d<20 mm) [n(%)]
2.2 直径<20 mm的肝脏病变
2.2.1 影像学征象 本组病例共有病灶129处:囊肿32处;血管瘤5处;早显灶5处;不典型早显灶17处;局灶性脂肪沉积2处、肝岛1处;肝动脉门静脉分流2处;同时出现动脉期高强化及门脉期/延迟期低强化者24处,其中确诊为HCC 18处;仅出现动脉期高强化者23处,其中确诊为HCC者16处;动脉期强化程度与周围肝实质相仿或低于周围肝实质且无门脉期/延迟期低强化者15处,其中5处确诊为HCC;动脉期强化程度与周围肝实质相仿或低于周围肝实质但出现门脉期/延迟期低强化者3处,病理均为HCC(图2 D-E)。
2.2.2 LI-RADS(v2013)的诊断结果 LR1至2级64处,病理或随访情况均证实为良性病变;LR3至5级65处,其中确诊为HCC者42处;LI-RADS(v2013)的敏感度为100%,特异度为74%,PPV为65%,NPV为100%(表4),AUC值为0.868(图4)。LR3级30处,其中17处确诊为HCC,PPV为57%;LR4级24处,其中21处确诊为HCC,PPV为83%;LR5级11处,其中7处确诊为HCC,PPV为64%(表5)。
2.2.3 AOS临床实践指南的诊断结果 按照AOS影像学诊断标准,诊断为HCC的病变有24处,其中确诊为HCC者18处;非HCC的病变有125处,其中确诊为HCC者26处;因此,AOS的敏感度为43%,特异度为93%,PPV为75%,NPV为65%(表6),AUC值为0.680(图4)。
上述结果显示,对于直径<20 mm的小肝癌来说,LI-RADS(v2013)的AUC值高于AOS,前者敏感度、NPV明显高于AOS,而特异度、PPV稍低于AOS;但由于LR5级病例数较少,所以LI-RADS(v2013)的分级诊断结果失去了级别越高,HCC可能性越大的趋势。
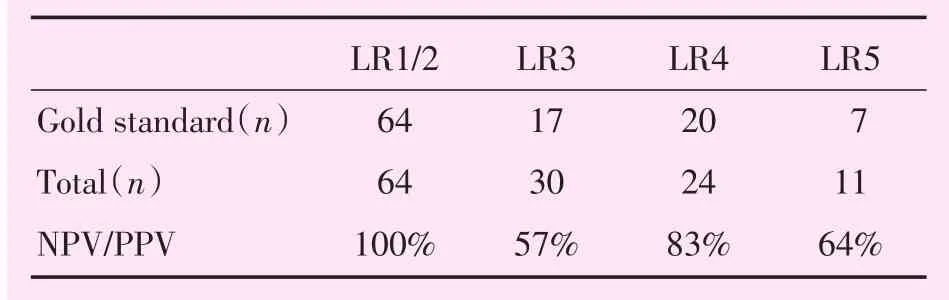
表5 LI-RADS(v2013)各级预测值(d<20 mm)Table 5 The NPV or PPV of each score in LI-RADS(v2013)(d<20mm)

图4 直径<20 mm和的肝脏病变LI-RADS和AOS标准的ROC曲线Fig.4 The comparison of ROC curve between LI-RADS and AOS criteria in liver lesions(d<20 mm)
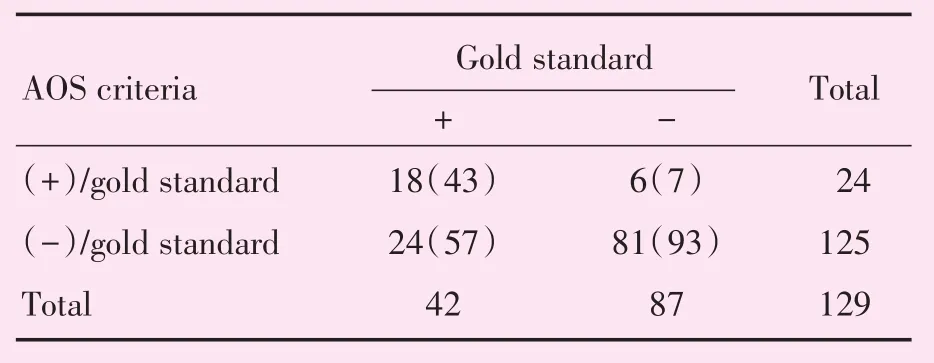
表6 AOS诊断结果与金标准对照(d<20 mm)Table 6 The result of AOS criteria compared with gold standard [n(%)]
3 讨论
3.1 小肝癌的临床研究价值
目前小肝癌的定义因地区而异:我国多沿用中国肝癌病理协作组通过的标准——即单个癌结节直径≤30 mm,或两个相邻的癌结节的直径之和≤30 mm;欧美国家对小肝癌的定义则经历了从以前的单个癌结节直径≤4.5 cm到现在应用较多的直径≤2 cm[9-10]。
在肝硬化的背景下,肿瘤的发生部位、凝血障碍、腹水、穿刺活检潜在的种植转移和腹膜出血风险常常会阻碍穿刺活检的实施或降低其诊断效能,另外,由于穿刺的样本错误造成的假阳性以及样本量过小、无法准确鉴别不典型增生结节和高分化HCC都会降低穿刺活检的准确性[11]。这些不足都迫切需要一个非侵入性的影像学诊断标准。众所周知,HCC的典型强化方式是同时出现动脉期高强化和门脉期/延迟期低强化,该强化方式促进了HCC非侵入性诊断标准的发展并被多个国际组织机构的HCC临床实践指南认可[4-5,12-13],其诊断价值在欧洲和北美得到广泛验证——特异度和阳性预测值都接近100%[14-16]。但是把这种典型强化方式严格应用在直径为10~20 mm之间的结节时,其敏感度只有60%左右,阴性预测值则低于50%[14]。综上所述,无创性诊断小肝癌是现在HCC的研究重点。
3.2 AOS临床实践指南提出的影像学标准低敏感度及阴性预测值分析
Rimola等[17]的研究结果显示典型的强化方式对直径≤20 mm的小肝癌的敏感度、特异度分别是58.3%、96.4%。本研究采用AOS临床实践指南提出的影像学诊断标准的结果显示这种典型的强化方式对直径≤30 mm和<20 mm的小肝癌诊断的敏感度、特异度分别是54.81%、92.21%,42.86%和93.10%,与以往的研究结果相似。
HCC多是从低级别不典型增生、高级别不典型增生结节逐渐演变成小肝癌(包括早期HCC、进展期HCC两种)的[18],在这个过程中,结节的门脉血供逐渐减少、动脉血供逐渐增多,这是HCC典型强化方式的根源。但是血供形式的改变是一个复杂、连续且不可拆分的过程,而不是一步一步序贯发生的,因此癌变过程中许多结节的表现可能不典型,从而不具备这种典型的强化方式,从而给诊断造成困难[2]。另外,进展期HCC边界多清晰,形态学和组织学特征都与大的HCC相似而容易诊断;但早期HCC多为高分化HCC,边界模糊不清不易观察,因其门脉血供已减少,但动脉血供增加不充分,常表现为乏血供结节[2];再者小的高分化HCC可能因为部分残留的肝细胞仍有功能、可以摄取对比剂出现肝细胞期信号等于周围肝实质[19]。这些因素都会造成早期HCC/直径较小的HCC的漏诊。
AOS临床实践指南的诊断依据“动脉期高强化和门脉期/延迟期低强化”与HCC以动脉血供为主有关,而结节癌变过程中血方式多种多样[10],据此推测,本研究中AOS临床实践指南提出的影像学诊断标准敏感度偏低可能与结节直径过小有关。因此,AOS临床实践指南等以典型强化方式为诊断标准诊断小肝癌的敏感度偏低,这样会导致影像学征象不典型的小肝癌被漏诊,不利于小肝癌的早期发现和治疗。因此,目前如何诊断影像学表现不典型的HCC是提高小肝癌诊断正确率的关键。
3.3 LI-RADS(v2013)的全面性和优越性
LI-RADS(v2013)对小肝癌的诊断不仅考虑到了强化方式,还综合了结节的大小、包膜、生长速度、弥散等多种因素;同时,针对结节是HCC的可能性大小进行分级诊断,尽可能确保表现不典型的小肝癌不被完全排除是HCC的诊断。
直径<10 mm的结节多是良性的,直径≥20 mm的结节多是恶性的,直径在10~20 mm之间的结节性质常常难以判定[2],对于直径≥20 mm的病变而言,直径<20 mm者更有可能出现假阳性[14],因此LI-RADS提出对于直径<20 mm的病变应参照更为严格的诊断标准,这也是LI-RADS比AOS、EASL、AASLD、APASL等临床实践指南提出的影像学诊断标准的优越之处[20]。
本研究显示对直径≤30 mm和<20 mm的具HCC发病风险的肝内病变,LI-RADS(v2013)的AUC值均高于AOS,且前者诊断的敏感度均为100%,明显高于AOS临床实践指南提出的影像学诊断标准,因此LI-RADS(v2013)可以较AOS临床实践指南提出的影像学诊断标准更敏感的发现小肝癌。
虽然LI-RADS(v2013)的特异度较低,对直径≤30 mm和<20 mm的肝内病变分别为67.53%、73.56%,但是LI-RADS(v2013)对LR3至5级不同级别的病变给出的临床处理方案是不一样的。对于HCC可能性较小的LR3级病变,LI-RADS(v2013)建议随访,随访间隔、随访时间依据病变大小、随访有无增大及临床状况综合考虑;对于HCC可能性较大的LR4级,LI-RADS(v2013)建议密切随访、进一步影像学检查评估病变性质或者穿刺活检和治疗;对HCC可能性最大的LR5级,LI-RADS(v2013)的建议是可以不经病理证实直接进行治疗,LI-RADS(v2013)这种决策目的在于尽可能降低HCC的误诊/漏诊率。
本研究结果显示,直径≤30 mm的病变中LR3至5级的PPV分别为50%、73.02%、91.18%,PPV逐级增大,进一步印证了LI-RADS(v2013)针对不同级别的处理方案的科学性。而直径<20 mm的结果中LR3至5级的PPV分别为56.67%、83.33%、63.64%,LR5级的PPV低于LR4级,可能与LR5级病例数较少(仅有11处)有关。
综上所述,LI-RADS(v2013)较目前广泛使用的以AOS临床实践指南为代表的多种临床实践指南提出的影像学诊断标准更为科学。

