锌离子抑制动脉粥样硬化进程中的巨噬细胞泡沫化
田 甜,周芳敏,汤勇波
(中山大学中山医学院药理学教研室,广东广州510080)
动脉粥样硬化是一种大动脉疾病,可以通过斑块破裂和血栓形成转变为急性临床事件,是导致心脏病和中风的主要原因[1]。动脉粥样硬化不仅是种退行性疾病,还与炎症有密切的关系[2],它的特征是大动脉中脂质和纤维元素的积累,早期病变包括巨噬细胞通过清道夫受体CD36、SR-A等吞噬以修饰后LDL-C为主的胆固醇并在内皮下积聚,称为“泡沫细胞化”[3]。锌是人体重要的微量元素,可以结合人体内约10%的蛋白质[4]。两个锌转运蛋白家族基因,锌转运蛋白(Zn transporters,ZnT)和Zrt-,Irt-相关蛋白(Zin-regulated,Iron-regulatedlike proteins,ZIP)基因共同调控锌在细胞内外及基质内的稳态,锌转运蛋白功能障碍可破坏细胞的锌稳态,从而引起糖尿病、心血管疾病和癌症等各种疾病的发生和发展[5]。饮食锌摄入不佳促进血管炎症和动脉粥样硬化形成,且越多研究发现锌有抗氧化和抗炎作用[6-7]。因此,本研究将从动脉粥样硬化发生最初的巨噬细胞脂质吞噬出发,研究锌离子在动脉粥样硬化中的作用并初步探究其机制。
1 材料与方法
1.1 材料和试剂
人单核细胞THP-1(中国科学院典型培养物保藏委员会细胞库)。胎牛血清(Foetal Bovine Serum,FBS,BI公司),RPMI1640、DMEM培养基(Gibco公司),丙二醇甲醚醋酸酯(Propylene glycol methyl ether acetate,PMA)、氯化锌(Zinc chloride,ZnCl2)、N,N,N′,N′-四(2-吡啶甲基)乙二胺(N,N,N,N′-tetrakis(2-pyridinylmethyl)-1,2-ethanediamine,TPEN,Sigma公司)。油红O、氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL)、1,1-二十二烷基-3,3,3′,3′-四甲基吲哚菁(DiI)标记的oxLDL(DiI-oxLDL,奕源公司)、CD36一抗体(R&D公司),SR-A一抗(Abcam公司),多克隆二抗(SantaCruz公司,博士徳公司,CST公司),小鼠β-actin一抗,ZIP7一抗(SantaCruz公司),ZIP8一抗(protein-tech公司),ZIP12一抗(Pro-sci公司),ZIP14一抗(Abcam公司)。Trizol(Invitrogen公司),引物序列(Invitrogen公司),逆转录试剂盒、SYBR荧光探针(Roche公司)。ApoE基因敲除(ApoE-/-)小鼠(c57bcl/6),SPF级,许可证号SCXK(京)2016-0011(维通利华公司)。动物饲料定制(派克公司)。本动物实验经中山大学实验动物伦理委员会批准(No.1027-156),寄养于中山大学(北校区动物实验中心),并根据中山大学动物实验中心的实验动物操作标准进行实验。
1.2 细胞培养及分组
THP-1细胞培养于含体积分数10%FBS的RMPI 1640培养基中,体积分数为5%CO2细胞培养箱内37℃培养。1×106/皿接种于30 mm培养皿中,培养基中加入分化诱导剂PMA使终浓度为0.1 mg/L,培养48 h后细胞分化为巨噬细胞。去PMA换新鲜全培养基,加入oxLDL继续培养24 h或48 h;或分化后采用不同浓度0、30和60 μmol/L的Zn2+或0.4、0.8 μmol/L的TPEN预孵育6 h后,再用oxLDL处理24 h,观察巨噬细胞脂滴沉积情况及检测细胞内相关mRNA水平和蛋白的表达情况。
将ApoE-/-小鼠随机分4组,正常饲料组(锌含量30 mg/kg,Chow group)、高脂正常锌组(锌含量30 mg/kg,HFD)、高脂缺锌组(锌含量0 mg/kg,HFD-ZnD)、高脂高锌组(锌含量150 mg/kg,HFD-ZnS)。
1.3 油红O染色
去掉培养基的细胞或新鲜分离的小鼠主动脉条,用4℃PBS洗3次,40 g/L多聚甲醛中固定10 min。再用4℃PBS洗3次,染色前用体积分数60%异丙醇润洗细胞,然后在37℃下,用质量分数0.3%油红O染色5 min,染色后用异丙醇润洗一次,再用4℃PBS漂洗3次,最后置于倒置显微镜下观察细胞内脂滴形成情况或拍照,用image J计算泡沫化面积。
1.4 巨噬细胞对DiI-oxLDL摄取能力测定
将THP-1细胞接种于共聚焦(confocal)显微镜专用皿中,0.1 mg/L PMA处理48 h使之分化成巨噬细胞。将confocal皿中的培养液吸去,换成2 mL不含血清及抗生素的培养基,加入0.4 μmol/L TPEN或 60 μmol/L Zn2+6 h后,再加入100 mg/L oxLDL培养24 h,加入20 ng/L的DiI-oxLDL,在避光条件下分别在37℃孵育4 h,之后用4℃PBS洗,40 g/L多聚甲醛固定10 min,吸去固定液,4℃PBS洗3次,加入细胞核染料DAPI染色5 min,去染色液PBS洗涤。最后用荧光显微镜观察巨噬细胞对其摄取情况。其激发波和发射波波长分别设置为520 nm和580 nm,每个皿取6个视野,运用fluorescence View软件测定每个皿6个视野内所有细胞的平均荧光强度。
1.5 Western Blotting
Western blot用于检测SR-A、CD36等蛋白的表达。将处理后的细胞用4℃PBS冲洗细胞3次,预先将蛋白酶抑制剂(cock tail)按1∶100加入细胞裂解液RIPA中混匀。加入适量裂解液(RIPA)冰上裂解细胞30 min。用细胞挂到将裂解产物刮下或组织破碎后收集于1.5 mL EP管,12 000 r/min(r=11 cm)4℃离心15 min,吸取上清液,-20℃保存。取2 μL用BCA法测定蛋白浓度,取40~80 μg蛋白在8%SDS-PAGE凝胶中进行电泳。电泳结束后,200 mA恒流电转90 min,使蛋白质转移至PVDF膜上。含蛋白样品的PVDF膜在体积分数5%牛奶的TBST缓冲液中室温封闭1~2 h。室温孵育相应抗体2 h或4℃过夜。TBST洗膜3次,5 min/次,室温孵育二抗1 h,TBST洗膜3次,10 min/次。ECL发光底物曝光显影,用ImageJ分析目的条带的光密度值。比较不同条件下各蛋白表达的变化情况。
1.6 实时荧光定量PCR
THP-1细胞接种于30 mm培养皿中,细胞经相应处理后,除去培养液,用4℃PBS洗3次,加入1 mL Trizol试剂,冰上放置30 min,收集后,每1 mL Trizol加入0.2 mL氯仿,剧烈振荡混匀,室温静置 5 min,再4℃,12 000 r/min(r=11 cm)离心15 min。小心吸取上清转移至无RNA酶的EP管中,加入等体积异丙醇,颠倒混匀,室温下静置10 min,再12 000 r/min(r=11cm)4 ℃离心10 min。吸去上清,用75%乙醇漂洗RNA沉淀,5 000 r/min(r=11 cm)4℃离心5 min。倒去乙醇,室温空气中干燥约10 min,随后加入20 μL DEPC水溶解RNA,用核酸蛋白分析仪进行核酸定量。再根据试剂盒条件取1 μg RNA进行逆转录。引物设计使用NCBI软件primer-BLAST进行设计,RT-PCR,20 μL体系,反应条件:CFX96(Bio-Rad)qPCR仪,95.0 ℃ 10 min、95.0 ℃ 15 s、60.0 ℃ 1 min,39个循环;95.0 ℃ 10 s、60.0 ℃ 15 s。运用 CFXmanager的2-△△t法进行相对表达量计算(表1)。
1.7 血脂检测
将获得的小鼠血液室温静置30 min,3 000 r/min(r=11 cm)离心10 min,小心吸取上清,收集得到血清。血清用于血脂四项,交由广州达安基因公司进行检测,采用的检测方法是酶法。
1.8 统计分析
采用GraphPad Prism5.0制作统计图。连续性资料数据用x±s描述,绘制柱状图或点图。偏态分布资料P50(P25,P75)描述,绘制箱式图。数据呈正态分布且方差齐性时,两组比较采用独立样本t检验进行统计分析;多组比较采用单因素方差分析(One-way ANOVA)进行统计分析。方差分析结果有统计学意义时,多重比较采用Bonferroni法分析组间差异。数据非正态分布或方差不齐时,多组比较采用Kruskal-Wallis H检验,H检验分析结果有统计学意义时,多重比较采用Nemenyi法,此步骤运用SPSS 19.0平均秩多重比较的功能实现。P<0.05为差异有统计学意义。
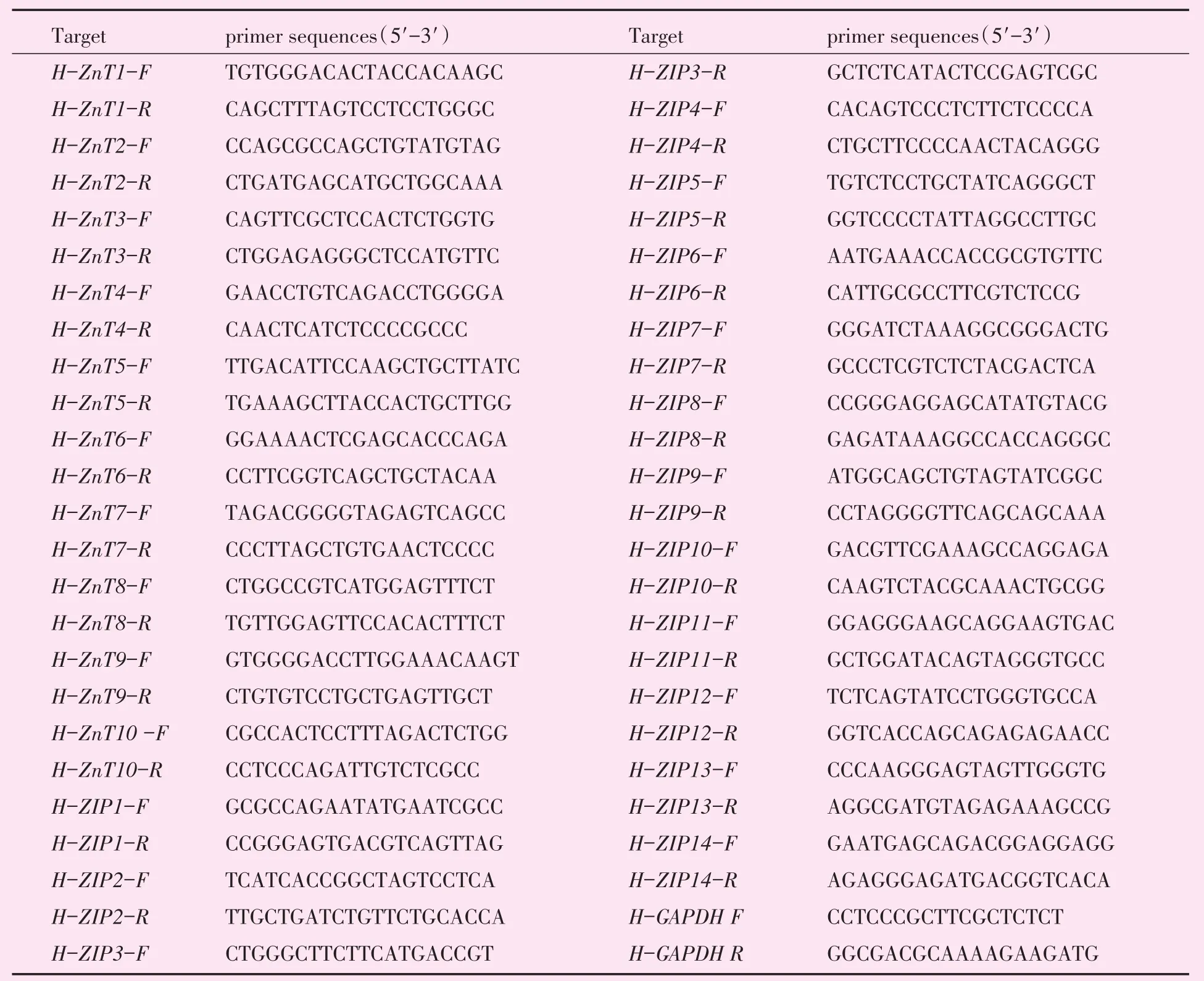
表1 引物序列Table 1 Primers
2 结果
2.1 锌离子对巨噬细胞泡沫化过程的影响
100 mg/LoxLDL处理细胞48 h使细胞发生泡沫化后,可见细胞内积聚大量脂质,预处理TPEN络合胞外锌离子后可以加重巨噬细胞脂质积聚,缺锌组油红O密度比对照组显著增加(P<0.05);而预孵育60 μmol/L的Zn2+则在此基础上有所下降(P<0.01),一定程度上减缓了脂质的堆积。100 mg/L oxLDL处理细胞48 h后使发生巨噬细胞泡沫化后,与对照组相比,缺锌组泡沫细胞对DiI-oxLDL的摄取含量无显著增加;但补充锌离子后,细胞内DiI-oxLDL的摄取量降低(P<0.01;图1,2)。
2.2 不同锌离子浓度对清道夫受体CD36、SR-A表达的影响
在正常培养条件下,巨噬细胞对SR-A蛋白表达较低。用0.4 μmol/L的TPEN预处理细胞,再用oxLDL处理细胞48 h后,泡沫细胞SR-A和CD36蛋白表达量比对照组显著增加。15 μmol/L Zn2+预处理巨噬细胞与oxLDL组比(P<0.05),SR-A蛋白和CD36蛋白表达显著下降(P<0.05;图3)。
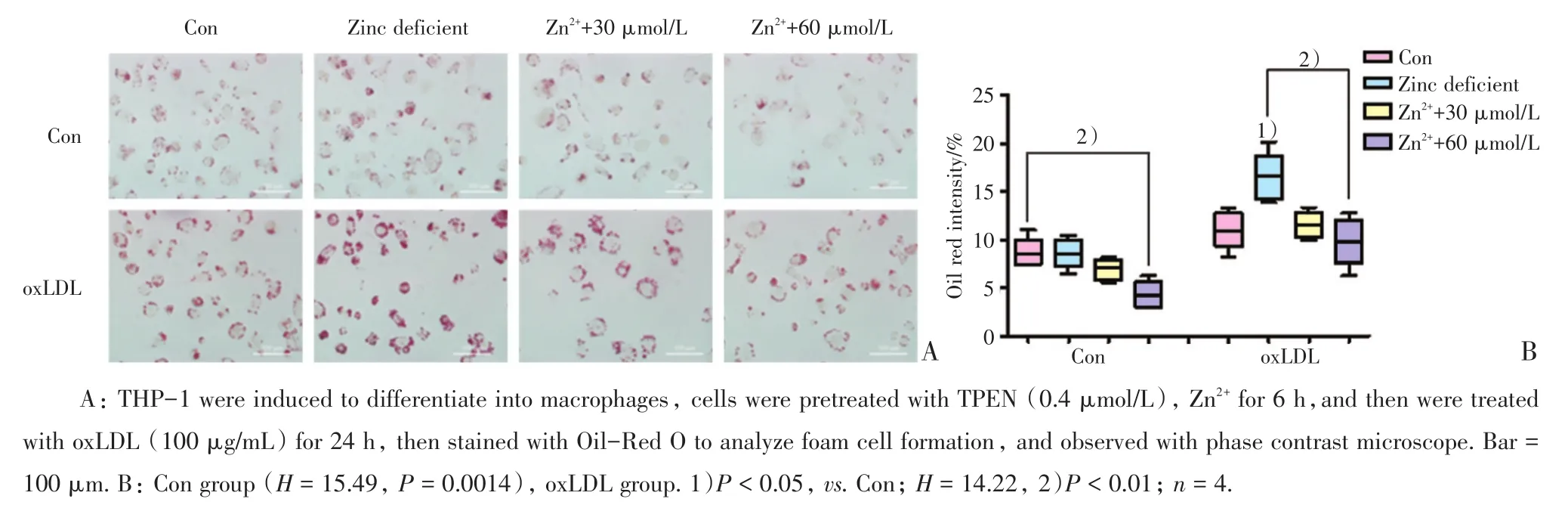
图1 缺锌增加巨噬细胞泡沫化Fig.1 Zinc deficiency upregulated the formation of foam cells
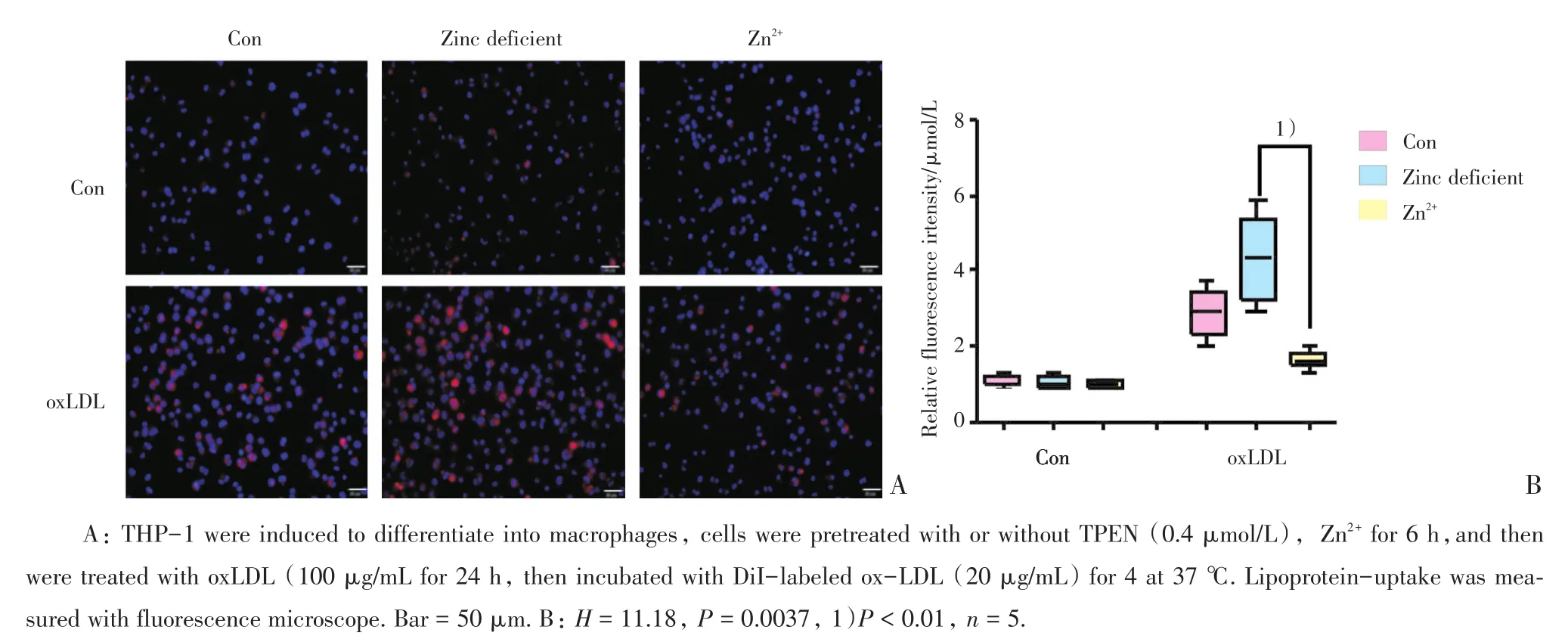
图2 缺锌增加巨噬细胞摄取DiI-oxLDLFig.2 Zinc deficiency upregulated the DiI-oxLDL uptake by macrophage
2.3 巨噬细胞泡沫化过程中ZIP、ZnT的mRNA表达变化
实时荧光定量PCR检测锌转运体基因ZIP、ZnT的mRNA表达变化。ZIP14(1.98±0.16)、ZIP12(2.50±0.40)、ZIP10(1.78±0.12)的mRNA表达量均有所升高,其中又以ZIP12和ZIP14变化最为显著(P<0.05)。ZIP4(0.33±0.09)、ZIP7(0.32±0.08)、ZIP8(0.31±0.08)的mRNA表达量均降低。而ZnT4的mRNA表达量上调(2.86±0.23),ZnT1的mRNA表达量下调(0.25±0.004;P < 0.05;图4)。
2.4 不同锌饮食对小鼠血脂的影响
用酶法检测了血脂四项,结果显示,高脂喂养13周之后,与Chow组对比,HFD和HFD-ZnD组小鼠的血脂多项指标均显著升高(P<0.05;表2),HFD-ZnS组小鼠的LDL-C含量较HFD-ZnD组小鼠的LDL-C则有明显下降(P<0.05;表2)。
2.5 不同锌饮食对小鼠动脉SR-A蛋白表达的影响
利用ApoE-/-小鼠进行高脂饮食饲养,建立动脉粥样硬化模型13周后,HFD组和HFD-ZnD组与Chow组相比,SR-A蛋白表达均有明显升高(P<0.01)。而HFD-ZnS组的蛋白表达则在HFD组基础上显著降低(P<0.01;图5)。
2.6 不同锌饮食对小鼠动脉斑块形成的影响
建立动脉粥样硬化模型13周后,油红O染色显示,与常Chow相比,HFD-ZnD组主动脉粥样斑块明显加重(P<0.01)。HFD-ZnS组则在此基础上有所减缓(P <0.01;图6)。
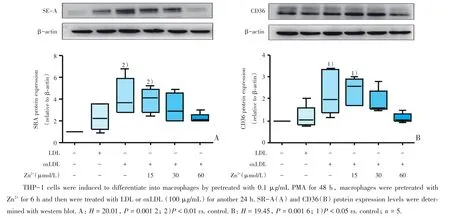
图3 不同锌离子浓度对清道夫受体SR-A、CD36蛋白表达的影响Fig.3 Effect of Zn2+on SR-A and CD36 protein expression in macrophages foam cell formation
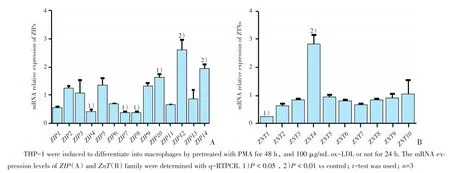
图4oxLDL影响锌转运体家族mRNA的表达Fig.4 Effect of ox-LDL on the mRNA expression of ZIP and ZnT family
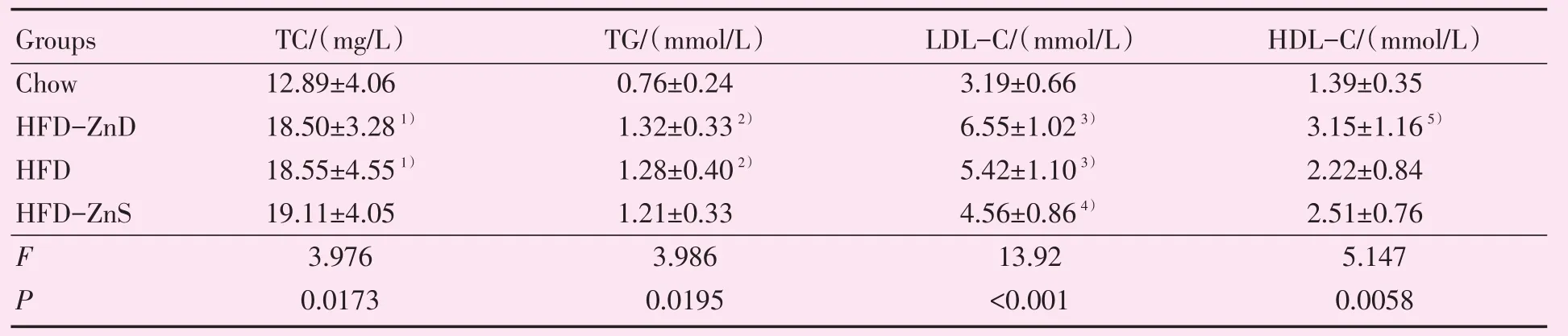
表2 小鼠血清脂质含量Table 2 Serum lipid,lipoprotein
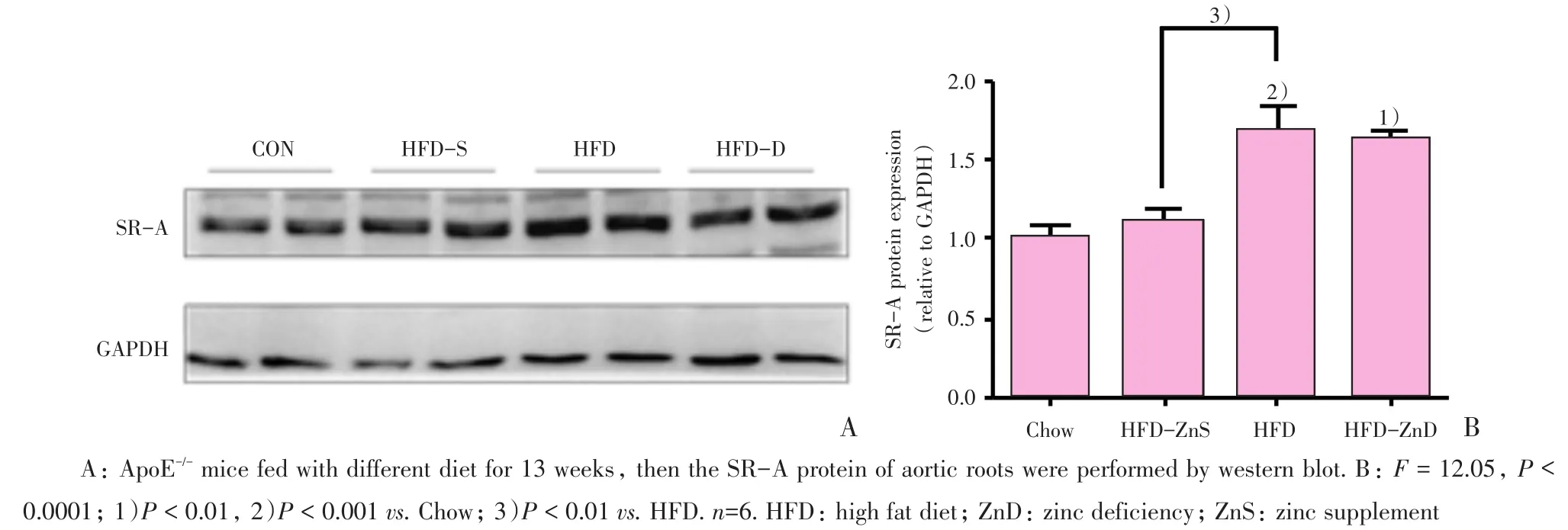
图5 不同锌饮食小鼠血管SR-A蛋白表达的影响Fig.5 Effect of different diet on SR-A protein expression in the aorta of mice
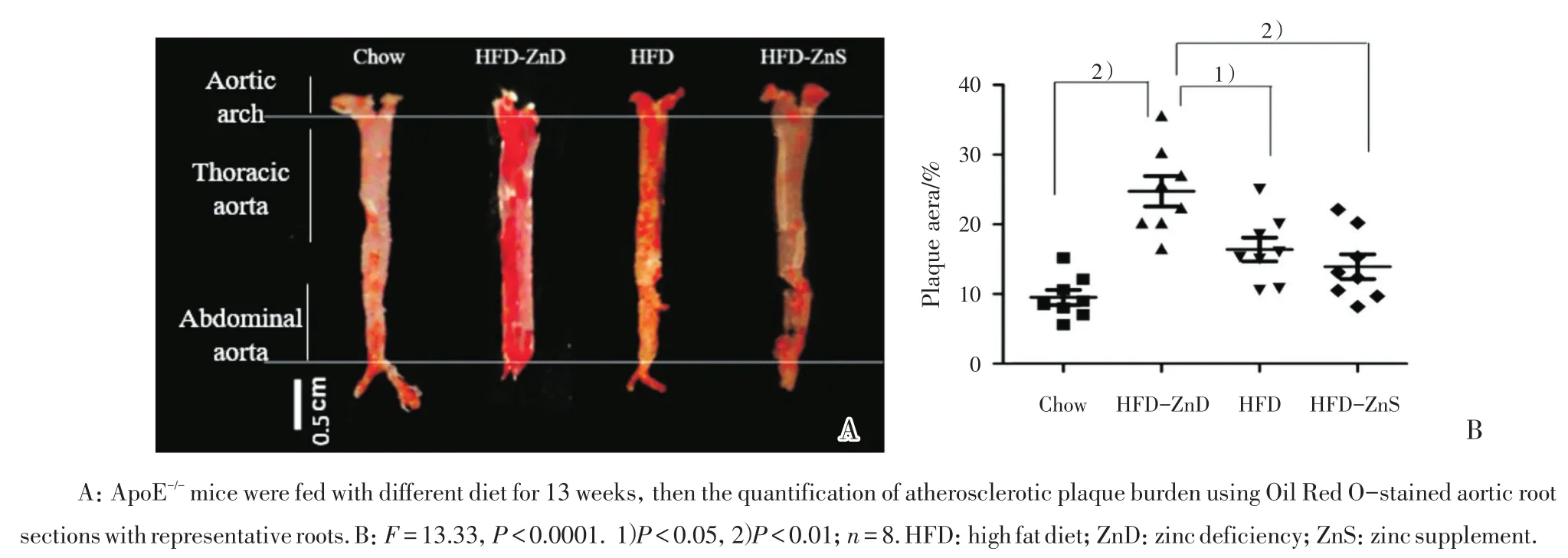
图6 不同锌饮食对小鼠主动脉斑块形成的影响Fig.6 The effect of zinc on atherosclerosis plaque formation in aorta of mice
3 讨论
本实验探讨了锌离子在动脉粥样硬化巨噬细胞泡沫化及斑块形成过程中的影响及其机制,以往关于锌与动脉粥样硬化的研究并不是特别多[8]。本实验通过体外实验结果,缺锌导致巨噬细胞内脂质沉积增加,清道夫受体SR-A和CD36增加,可推测锌离子参与细胞泡沫化过程,其参与机制可能是通过调控清道夫受体SR-A和CD36的表达,小鼠体内实验结果也证实了这一点。我们知道清道夫受体SR-A和CD36是参与动脉斑块形成的关键蛋白,降低它有抑制板块形成[9]。巨噬细胞吞噬oxLDL的过程中,锌离子转运体ZnT和ZIP家族的mRNA水平均有显著性改变,证实锌离子参与调控清道夫受体SR-A和CD36蛋白,并且可能是通过改变巨噬细胞表面的膜转运体影响细胞内外锌环境从而影响该过程。首次关注了影响胞内锌离子浓度的锌转运体,这可能为研究提供一个新的方向[10]。但在变化较为明显的锌离子转运体中,又是哪些起到了关键性的作用其分子机制又是什么,还需要进一步探讨。
为了证实缺锌及补充锌对动脉粥样硬化有无直接的影响,我们建立了小鼠动脉粥样硬化模型。通过体内实验结果发现,缺锌高脂饮食不但明显促进了ApoE-/-小鼠血清中LDL-C水平升高,还加重高脂饮食诱导的ApoE-/-小鼠动脉斑块的形成,证实缺锌会促进巨噬细胞泡沫化进而促进动脉粥样硬化的发展。锌补充饮食则抑制高脂饮食的小鼠LDL-C水平升高和轻高脂诱导的动脉斑块增加,说明对高血脂者给予适当的锌补充或许可以有效减少血脂沉积和动脉斑块的形成,锌在降低动脉粥样硬化这样的血管疾病能获益[8,11-12]。同样地,关于不同饮食会否对锌离子通道产生影响也还需要实验来说明。此外,基于锌对血管的保护作用,而它除了作用于巨噬细胞,对血管的内皮细胞和平滑肌细胞又有无仅有的积极调节作用也值得思考[13-14]。
综上所述,锌离子对动脉粥样硬化过程能起到明显的减缓作用。先前的研究,不管是通过低密度脂蛋白受体敲除(LDL-R-/-)小鼠和ApoE-/-小鼠上证实了缺锌会促进长期高饱和脂肪和高胆固饮食导致的动脉粥样硬化和斑块钙化[15],还是摄入锌可能对降低动脉粥样硬化风险有益[16],都与本实验结果有一致性。关于锌在心血管疾病中的作用,还需要了解细胞内锌信号是如何发生的以及这些锌转移信号是怎样影响细胞的状态和功能。只有了解了这些机制才能确立锌在动脉粥样硬化等心血管疾病中的预防和治疗作用[8,17]。

