Lnc-1708对体外人骨髓间充质干细胞成骨分化的抑制效应
曹峻川,孙 翔,赵建江
(南方医科大学1.口腔医学院,2.口腔医院口腔颌面外科,广东 广州 510260)
颌面部发生的外伤、肿瘤、先天畸形和牙缺失后导致的牙槽骨吸收等常引发患者颌面部骨组织缺损,造成颜面畸形,引起语言、咀嚼、呼吸等机能障碍,在患者的生理和心理上造成不良的影响。常规的自体及异体骨移植在兼具形态和功能的修复缺陷上,存在着各自的利弊和局限性。而骨组织工程的兴起为骨缺损修复开辟了新的方法[1]。骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSC)是骨组织工程的重要种子细胞,有稳定的自我更新和增殖的能力,同时具有多种分化潜能,能够诱导分为成骨、成软骨、脂肪细胞等细胞谱系[2-3]。因此研究hBMSC成骨分化作用的机制,对探索颌面部骨缺损修复方法有着十分重要的意义。Long non-coding RNA(lncRNA)是目前被认知较多的一种非编码RNA,目前人类基因组计划(版本20,GRCH38)已经识别了24 489个lncRNA以及14 470个lncRNA基因转录本[4]。虽然越来越多的研究证实lncRNA参与了干细胞增殖分化的调控,但目前仅有少数已知的lncRNA,如lncRNA-NONHSAT009968,lncRNA-H19,lncRNA HoxA-AS3等[5-7],被证实有调控hBMSC成骨分化的作用。本课题组前期通过高通量测序技术发现了未知lncRNA-1708,并发现其在hBMSC成骨分化前后具有表达差异性。因此,本研究用PCR检测lncRNA-1708在hBMSC成骨诱导分化前后的表达量,探讨其与hBMSC成骨分化的关系,同时通过构建慢病毒载体及干扰质粒调控lncRNA-1708在hBMSC中的表达,探讨lncRNA-1708对hBMSC成骨分化的影响。
1 材料与方法
1.1 主要材料及试剂
原代人骨髓间充质干细胞(sciencell-7500,美国),成骨分化培养基(sciencell-7531,美国);lncRNA-1708过表达慢病毒,慢病毒空载体阴性对照(空载体,pBABE pure),lncRNA-1708干扰质粒(sh-lncRNA-1708),lncRNA-1708干扰质粒的阴性对照[sh-lncRNA-1708 negative control(PLKO.1)](苏州金唯智生物科技,中国);293FT细胞(invitrogen,美国);cDNA反转录试剂盒-RR047A(TAKARA-RR047A,日本);荧光定量PCR试剂盒(TAKARA-FP215,日本);碱性磷酸酶染色试剂盒(sigma-85L1-1KT,美国)。
1.2 细胞的复苏及传代培养
将冻存的原代hBMSC迅速放入37℃水浴中至完全融化,按5×103/cm2接种密度将原代hBMSC接种于多聚赖氨酸包被的T-75培养瓶中,置37℃、体积分数为5%的CO2培养箱中培养。次日更换培养基以去除残留的DMSO和未贴壁细胞。此后每3 d更换一次培养基,待细胞达到90%融合时应用适量0.25%胰酶/0.02%EDTA消化,按1∶3传代扩增,进传代培养至P3代。
1.3 荧光定量PCR(RT-PCR)验证lncRNA-1708的表达情况
根据本实验前期的测序实验结果,取3组来源于不同个体hBMSC(货号均为sciencell-7500),按成骨分化前后分别设置实验组与对照组(P1-N1,P2-N2,P3-N3)。具体步骤:按每孔2×104/cm2个细胞的密度将P3代的hBMSC接种于6孔板上,待细胞生长融合超过70%时,更换为间充质干细胞成骨分化培养基,每3 d用新鲜成骨分化培养基完全替换培养基,成骨诱导分化7 d后收集细胞。按照Trizol试剂盒操作说明书步骤提取细胞总RNA。引物序列,forward:5′-CGTCACCTCTACCTCCTTAATAC-3′,reverse:5′-CAGGTTTTACTGCATATGTAGATAGTG-3′。
1.4 慢病毒包装
lncRNA-1708慢病毒载体和lncRNA-1708沉默质粒(sh-lnc-1708)均购买自苏州金唯智生物科技。在6孔板中接种120万细胞/孔(6孔板中),16 h后,将构建好的载体按Lipofectamine 2000(Promega,美国)转染试剂盒步骤转进293FT细胞中,8 h换液,48 h后收集上清液,在4°C下保存。pBABE pure载体的酶切位点见图1。lncRNA-1708测序结果序列(904 bp):GTTCTAGTACTACTAACACGACTACCAGAAAAATTACCTGGCCACTCTAAG CCTTGGTTTATTGAGCTATAATATTAAAATACTAT CTACACTGCTGTCCTTTACATGGTTGCCAAGAAAAAAGCTGATATATAACTGTGCCATATAAACTCTAAAATTGTACAAATATTCCCATTACTAAAATATGACAAAATAATTTTGTATGGGCTCTGAAAATGATTAACCTACTTTTCCACTGAATTCTAAGACAAAAAATCAAGATTAACACAGTAATTATTGAAAATATGTCCCTTCAATCATTACAAAAACCTGTTGATAAAACCTTCCCAAAAGATTTAATCATACAAGTATCTGACATTACCATCATTATTGAGTAGTCACCATAATCCAGACACTGCTAAAACATTTTCTAATTTAATCTTCACATTAACTATATAAGATAGGTAATATCATTATTCCCTATTACATATGAATAAATTGGGCTCTGAGAGGCCAGAAAATGTCTCCACAATTATGAAGCTAATTAGTGGAAATGCCAACATTCTAATCCCAAGTAGACTGACTCCAAAGTCTAGTCCTTTAACAATAACACTATGTCACCTCTACCTCCTTAATACAGATATTGTAATACTTTTAGATGCCTAACAGTTCCACCCCTACCATCGGTCTAAATAGAATGACAACACTATCTACATATGCAGTAAAACCTGCCAATCATTTTTTAAAACTTAATTTCAACTCTGGGATCTTAGCCTCAGAAAGACAGAAGCTTTCTGTCATTTTTTCTCTTTCTGAATAAACATAAGATGGAAAAGAAGTGGTAAAAGCATGACATGAAGGGGAAGGGAGAAGGGCACTCTAAAAGCATAATTTTCTCCTAGTATCTTTGATTCTGCTGTTTCAG。
图1 pBABE pure载体的酶切位Fig.1 Enzyme cleavage sites of pBABE vector
1.5 人骨髓间充质干细胞转染lncRNA-1708慢病毒载体、干扰质粒及阴性对照
将收集到的病毒上清液0.3 mL与hBMSC培养液混匀,比例为0.3 mL病毒上清液加入0.7 mL细胞培养液和 1.0 μL polybrene(终浓度 8 ng/mL)。然后将混好的病毒感染液加入到hBMSC培养皿中,此时细胞密度不宜超过60%,过夜培养后更换新的hBMSC培养液,获得转染lncRNA-1708过表达载体、shlncRNA-1708干扰质粒及转染相应阴性对照的骨髓间充质干细胞。2 d后收集细胞抽提RNA,RT-PCR检测lnc-1708的表达。
1.6 RT-PCR检测成骨相关因子的表达
P3代hBMSC以2×104个/cm2孔接种于96孔板中,以每竖列的3孔为一组,分别转染lncRNA-1708过表达慢病毒载体、sh-lncRNA-1708干扰质粒及其相对应的阴性对照、转染后成骨诱导分化培养14 d,14 d后收集细胞,RT-PCR检测相关成骨基因RUNX2和ALP mRNA的表达量。引物设计,RUNX2 forward:5′-TTCACCTTGACCATAACCGTC-3′,reverse:5′-GGCGGTCAGAGAACAAACTAG-3′;ALP forward:5′-AGAATCTGGTGCAGGAATGG-3′,reverse:5′-TCGTATTTCATGTCTCCAGGC-3′;Sh-lncRNA-1708 forward:CCGGGTCACCTCTACCTCCTTAATACTCGAGTATTAAGGAGGTAGAGGTGACTTTTTG,reverse:AATTCAAAAAGTCACCTCTACCTCCTTAATACTCGAGTATTAAGGAGGTAGAGGTGAC。
1.7 碱性磷酸酶染色
将转染lncRNA-1708过表达慢病毒或sh-lncRNA-1708或相关阴性对照的间充质骨髓干细胞以每孔2×104个细胞接种于6孔板内,成骨诱导培养14 d后,按碱性磷酸酶染色试剂盒说明书进行ALP染色。实验组及相关阴性对照细胞吸去培养基,用PBS洗一遍,加入40 g/L多聚甲醛溶液,室温固定3 min,固定好的细胞中加入适量配好的染液,避光静置15~30 min,15 min之后每隔5 min观察一次,待染色效果良好时,再用PBS洗一遍,即可观察染色结果。
1.8 构建lncRNA-1708的CNC共表达网络
对本次实验前期的测序结果,我们采用了生物信息学软件Cytoscape对差异表达lncRNA和mRNA数据进行相关性分析,并根据结果构建了lncRNA-1708与目标靶基因的CNC共表达网络。设置lncRNA和mRNA之间Pearson相关系数≥0.9,以进一步讨论lncRNA-1708的机制研究。
1.9 数据处理
采用GraphPad Prism 7制作统计学图,采用SPSS 22.0软件进行统计分析,计量资料以x±s表示,lncRNA-1708、ALP、RUNX2表达量采用2-ΔΔCT方法计算,用Shapiro-wilk方法进行正态性检验,并进行方差齐性检验。各组与对照组表达量的比较使用两独立样本t检验。检验水准α=0.05,P<0.05表示组间差异有统计学意义。
2 结果
2.1 LncRNA-1708在3组人骨髓间充质干细胞成骨分化前后的差异性表达
将3组来自不同个体hBMSC的实验组(P group)P3代细胞经成骨诱导分化培养7 d后测定lncRNA-1708表达量,与各组成骨诱导分化前(N group)相比较(N1-P1,N2-P2,N3-P3),3组中的lncRNA-1708表达量均较成骨诱导分化前降低。各组成骨诱导分化前后的lncRNA-1708表达量差异具有统计学意义(P<0.001;图2)。
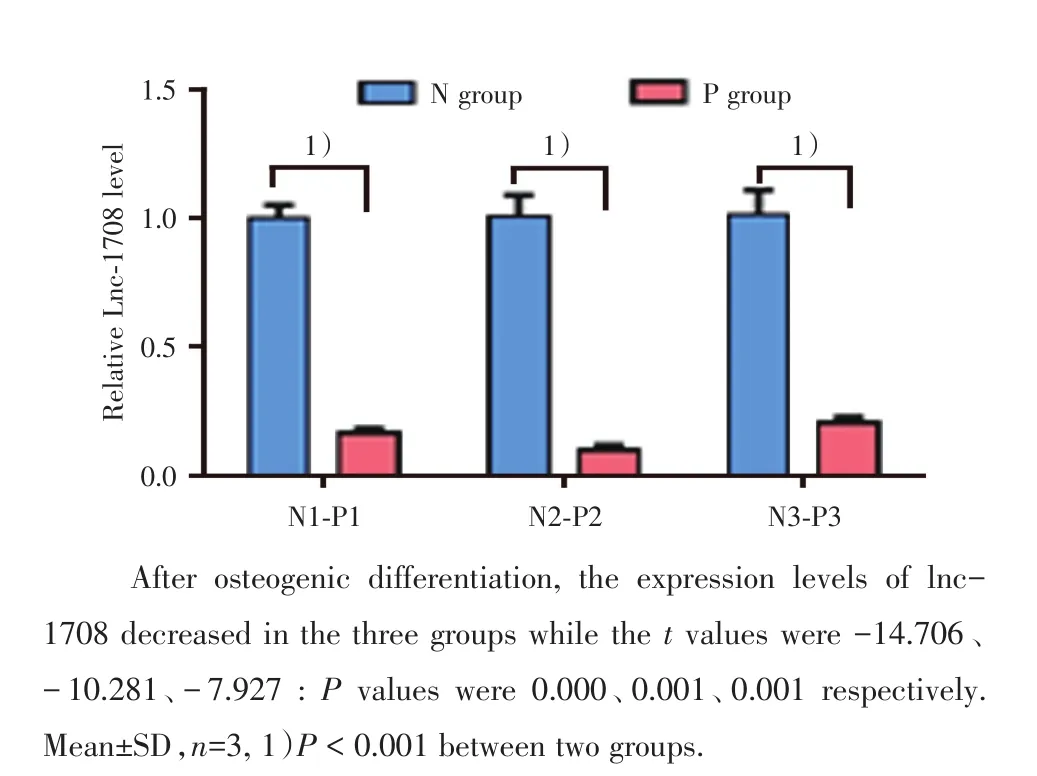
图2 hBMSC成骨诱导分化前与成骨分化后的lncRNA-1708表达量比较Fig.2 Comparison of relative expression of lncRNA-1708 after osteogenic differentiation of hBMSC
2.2 lncRNA-1708功能验证实验
2.2.1 LncRNA-1708过表达慢病毒及sh-lncRNA-1708的转染效率的检测 hBMSC分别转染lncRNA-1708过表达慢病毒、sh-lncRNA-1708及其相对应的阴性对照,2 d后qRT-PCR检测lncRNA-1708的表达量。在hBMSC转染lncRNA-1708过表达慢病毒后,较转染pBABE pure对照的细胞,lncRNA-1708表达量明显升高(P<0.05)。在转染sh-lncRNA-1708的hBMSC后,较转染PLKO.1载体对照的细胞,lncRNA-1708的表达量明显下降(P < 0.01;表1)。
2.2.2 上调或下调lncRNA-1708对成骨相关因子的影响 成骨诱导分化培养转染后的hBMSC,14 d后RT-PCR检测成骨标志因子RUNX2、ALP的mRNA表达量。在上调lncRNA-1708的hBMSC中,RUNX2及ALP的平均表达量分别是0.46±0.03、0.15±0.07(P < 0.01,n=3);在对照组转染pBABE pure的hBMSC中RUNX2及ALP的平均表达量分别是1.00±0.02、1.02±0.28。差异有统计学意义(P<0.01,n=3;图3A)。而在转染shlnc-1708的hBMSC中,RUNX2及ALP的平均表达量分别是1.62±0.18、1.58±0.11(P < 0.01,n=3),在转染对照组PLKO.1空白载的hBMSC中RUNX2及ALP的平均表达量分别是1.00±0.04、1.01±0.18。差异有统计学意义(P <0.01,n=3;图3B)。
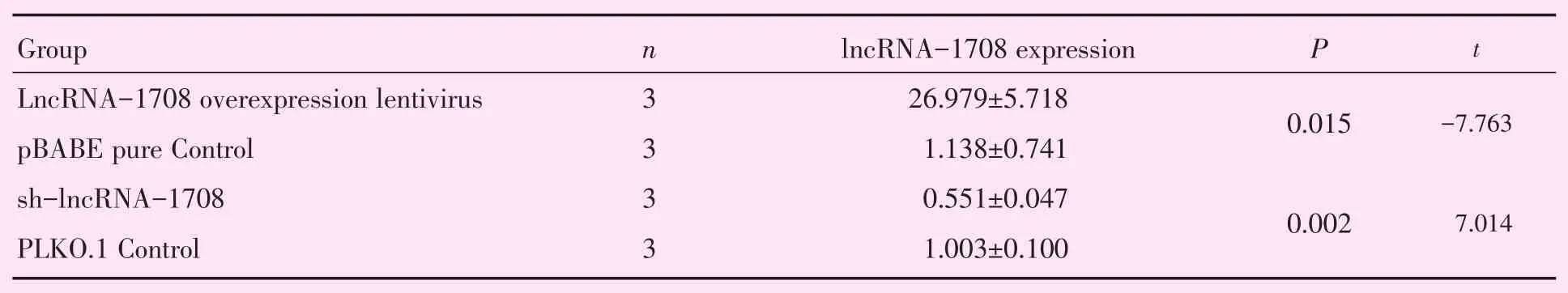
表1 hBMSC中Lnc-1708转染效率检测Table 1 Expression of lnc1708 in hBMSC after transfection
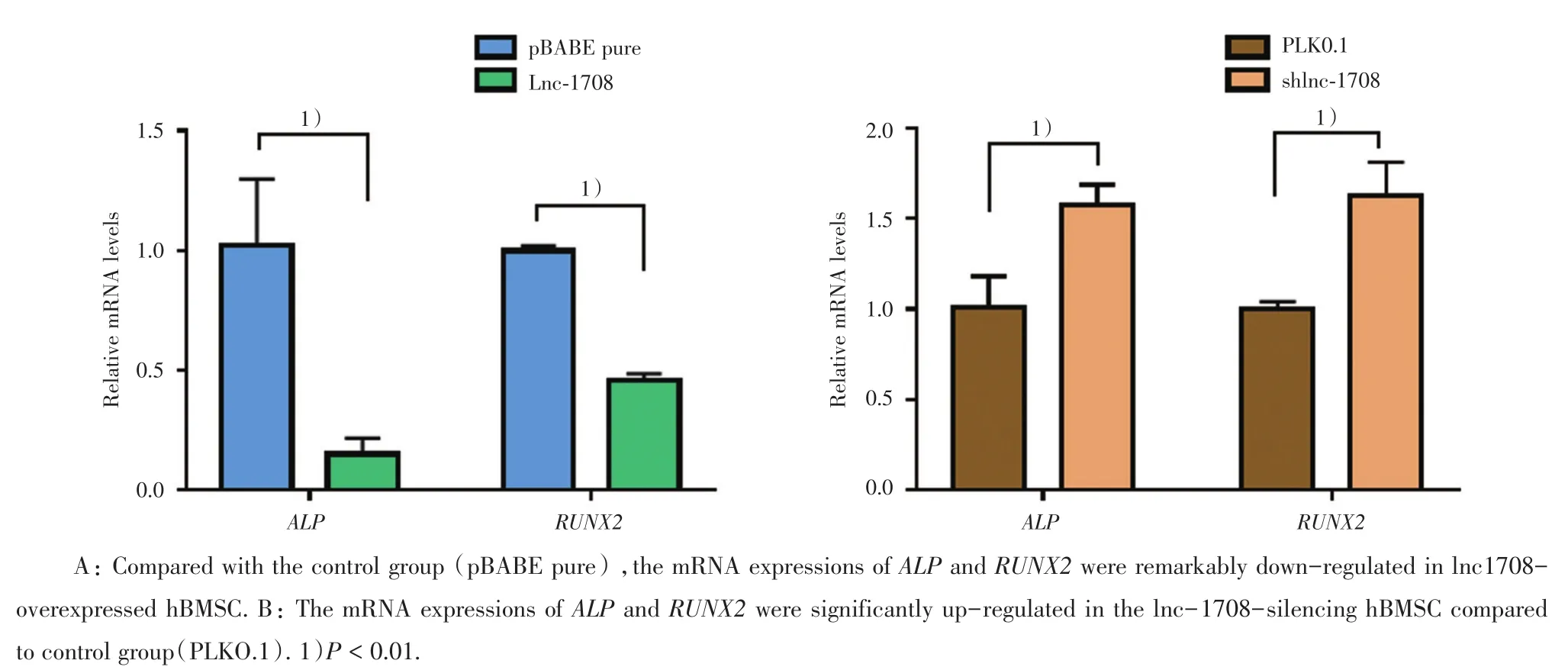
图3 差异表达lnc-1708的hBMSC中相关mRNA的表达量Fig.3 The expression of mRNA in hBMSC of differential expression in cRNA-1708
2.3 过表达或沉默lncRNA-1708对人骨髓间充质干细胞成骨分化的碱性磷酸酶染色结果
在成骨分化的过程中,碱性磷酸酶实验能够直观地判断成骨分化后的效果,它可反映出成骨细胞的活性状况。ALP染色细胞质呈红色,提示ALP染色阳性。成骨诱导分化14 d后光镜下观察如图4,ALP染色直观图如图5。
2.4 lnRNAc-1708和mRNA共表达分析结果
我们采用生物信息学软件Cytoscape对差异表达mRNA进行相关性分析,其中pearson相关系数(皮尔逊相关系数)≥0.9的共有13条mRNA(如图6)。
3 讨论
骨髓间充质干细胞是骨髓组织中的非造血干细胞,其具有多向分化潜能和高度的自我更新及增殖能力。在一定条件下骨髓间充质干细胞可以分化为成骨细胞、软骨细胞、脂肪细胞等多种细胞,是人体组织修复的重要细胞来源,是目前骨组织工程研究领域的理想细胞谱系[8]。对其机制的探究有助于骨组织工程的临床运用。
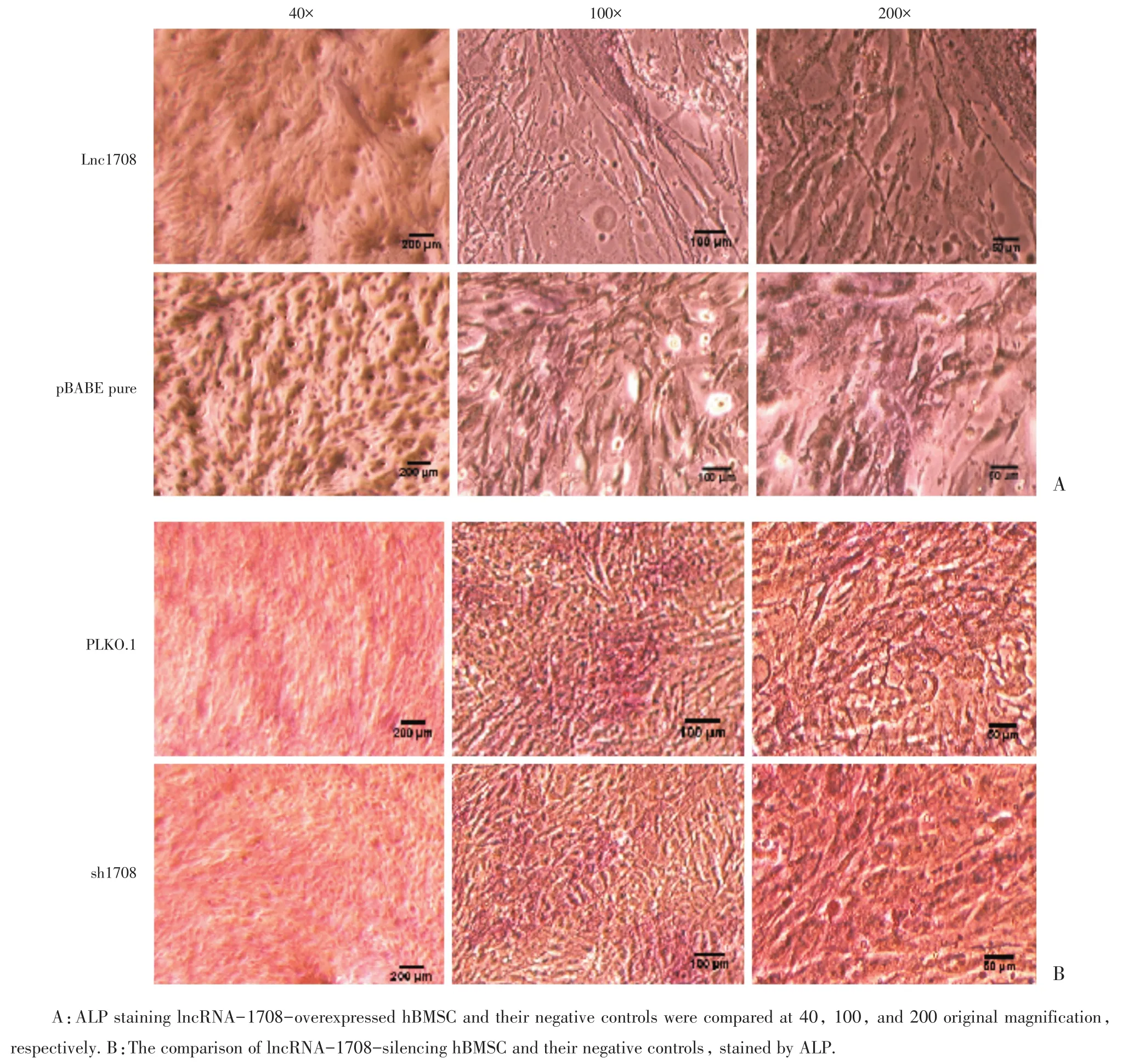
图4 成骨诱导分化14 d后碱性磷酸酶染色结果Fig.4 Alkaline phosphatase staining results 14 d after induction
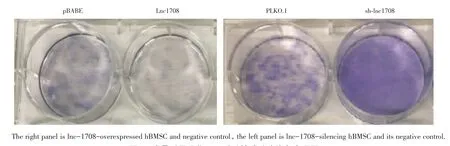
图5 成骨诱导分化14 d后碱性磷酸酶染色直观图Fig.5 Alkaline phosphatase staining under naked eyes 14 d after induction
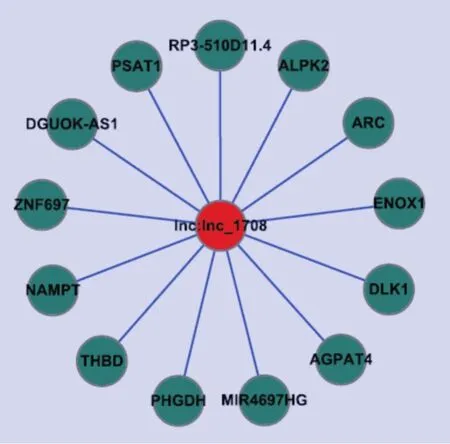
图6.LnRNAc-1708的CNC共表达网络图Fig.6 The coding-non-coding gene co-expression network of lncRNA-1708
LncRNA是一种长度超过200 nt的非编码RNA,占ncRNAs总量的80%以上[9]。许多功能性的lncRNA具有稳定的二级结构、独特的亚细胞定位以及组织特异性表达模式。越来越多的研究表明虽然lncRNA不直接参与蛋白质的编码,但却能够通过参与DNA甲基化,参与调节基因的激活或沉默以及作为miRNA海绵及小分子RNA前体等多种方式来调节细胞的增殖和分化过程[10]。近年来,越来越多的研究发现lncRNA参与调节BMSC成骨分化。如Cao等[11]报道高糖环境通过抑制lncRNA AK028326和CXCL13的表达来抑制鼠类BMSC的成骨分化。Liang等[12]研究发现,H19可以作为miR-141和miR-22的海绵,通过经典的Wnt/β-catenin通路途径来调节hBMSC的表达。Shang等[13]发现 TCONS_00041960通过作为miR-204-5p和miR-125a-3p内源性竞争RNA来调节大鼠的BMSC成骨分化。Wang等[14]研究发现在绝经后骨质疏松病人中,lncRNA MEG3通过增强miR-133a-3p的表达抑制了BMSC的成骨分化,加速骨质疏松症的发生。
LncRNA-1708是我们在hBMSC成骨分化过程中利用高通量测序技术筛选出的差异表达倍数较大的全新长链非编码RNA,目前尚未有关于其与成骨分化的相关研究报道。为探讨LncRNA-1708在hBMSC成骨分化中的功能意义,本研究对LncRNA-1708进行了RT-PCR验证。验证的样本来自3各不同个体的骨髓间充质干细胞,成骨诱导分化7 d后,3组样本中的LncRNA-1708表达量均明显降低,证实了我们之前的测序结果。同时,也提示LncRNA-1708可能作为抑制成骨分化的lncRNA参与hBMSC生理活动。
ALP、RUNX2是成骨分化过程中重要的转录因子,是成骨细胞分化的标志基因,在骨形成及骨代谢的信号通路中发挥着重要作用[15-16]。本次研究通过构建lncRNA-1708过表达慢病毒及干扰质粒转染hBMSC的方法,发现lncRNA-1708的表达量与RUNX2、ALP的表达量呈现负相关,这进一步提示lncRNA-1708在hBMSC成骨分化中起着负向调节作用。
有文献报道称DLK1通过激活经典的NF-kB途径介导增加炎性细胞因子Cxcl2、Ccl3的产生,以及上调免疫应答相关基因Tnfa、Il7来促进破骨细胞的生成和抑制成骨细胞的分化与活性[17-18]。而在lncRNA-1708的CNC共表达网络中,我们发现lncRNA-1708和DLK1呈现高度相关,而且在之前的测序结果中lncRNA-1708和DLK1均表达下调。因此,我们提出设想,lncRNA-1708可能通过调控蛋白编码基因DLK1的表达来抑制hBMSC的成骨分化。
综上所述,本研究探究了在hBMSC体外成骨分化中LncRNA-1708的负向调控作用,但目前我们尚未对LncRNA-1708在hBMSC成骨分化中的具体作用机制进行研究,后续将探讨LncRNA-1708与其高度相关的DLK1等基因的关系,探究LncRNA-1708是否可以作为一条新的调节路径来调节成骨分化,以期为骨组织工程的临床应用提供帮助。

