ER stress及PUMA对5-FU诱导的肝脏细胞损伤与凋亡的影响
刘 珊,李啸峰,谭嗣伟,刘慧玲,吴 斌
(中山大学1.附属第五医院消化内科,广东 珠海,519000;2.附属第三医院消化内科,广东 广州 510630)
5-氟尿嘧啶(5-Fluorouracil,5-FU)是肠癌标准化疗的基础药物,主要通过抑制胸腺嘧啶核苷酸合成酶进而抑制DNA的合成发挥抗肿瘤作用[1],然而在治疗同时5-FU及其代谢产物会对肝脏产生毒性作用,诱导肝脏细胞的损伤及凋亡[2]。Bcl-2家族包括一系列对细胞凋亡的进程起到调控作用的蛋白,p53上调凋亡调控因子(p53 upregulated modulator of apoptosis,PUMA)属于其BH3-only亚家族,是促进细胞凋亡的关键分子。PUMA能将凋亡信号传递至线粒体并刺激Bax和Bak蛋白易位,进而引起细胞色素c的释放导致Caspase家族蛋白活化,最终引起细胞凋亡[3]。内质网是细胞内调节蛋白质合成及折叠场所,具有调节细胞应激反应的功能。多种生理及病理状态会引起内质网内未折叠或错误折叠的蛋白质的大量堆积,损伤内质网正常功能,称为内质网应激[4]。此时细胞转录和翻译过程发生改变,加速未折叠或错误折叠蛋白的降解,维持细胞的正常功能,此种适应性反应称为未折叠蛋白反应(unfolded protein response,UPR),热休克蛋白GRP78表达升高是其激活的标志[5]。UPR可以促进内质网内未折叠或错误折叠蛋白的降解,维持内质网的正常生理功能,当过度的损伤超过了UPR的代偿能力,细胞内环境的稳定将无法维持,此时内质网应激会激活线粒体凋亡通路,诱导损伤细胞凋亡[6]。本课题组前期研究证实:门脉高压性胃病通过激活内质网应激上调PUMA的表达,进而促进了胃粘膜上皮细胞的损伤和凋亡[7]。然而,PUMA和内质网应激(ER stress,ERS)是否参与5-FU诱导的肝脏细胞的损伤与凋亡,以及两者的关系尚未明确,本研究旨在探讨5-FU是否通过激活ER stress-PUMA通路进而诱导的肝脏细胞的损伤与凋亡。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)C57/BL6 PUMA+/+(Wild-Type)小鼠 40只,PUMA-/-(Knockout)小鼠 20 只,雌雄各半,6~8周龄,体质量(20±2)g,由 C57/BL6 PUMA-/+小鼠(购自美国杰克森实验室)繁育所得。所有小鼠饲养于中山大学附属第三医院实验动物中心[2017(粤)-0083],保持室温25℃,光暗周期12 h/12 h,饲养期间小鼠自由进食饮水。实验工作经院伦理委员会批准。
1.2 实验试剂及仪器
1.2.1 主要试剂及抗体 5-氟尿嘧啶(5-FU,Sigma,US),4-苯基丁酸(4-Phenylbutyric acid,4-PBA,Sigma,US),苏木素-伊红染料(中杉金桥,北京),TUNEL试剂盒(Roche,Switzerland),ALT试剂盒(Cusabio,武汉),AST试剂盒(Cusabio,武汉),Cleaved caspase-3抗体(Cell Signaling Technology,US),GRP78抗体(Abcam,US),PUMA抗体(Abcam,US),β-actin抗体(Abcam,US),DAB显色液(DAKO,Denmark),Trizol(Thermo Scientific,US),逆转录试剂盒(TOYOBO,上海)
1.2.2 主要仪器 荧光倒置显微镜(Leica,Germany),低温高速冷冻离心机(Eppendorf,Germany),酶标仪(Labnet,US),垂直电泳槽(BIO-RAD,US),转膜仪(BIO-RAD,US),PCR 仪(Labnet,US),微量紫外分光光度计(Thermo Scientific,US),RTPCR仪(BIO-RAD,US)等。
1.3 实验方法
1.3.1 建立5-FU诱导的小鼠肝脏损伤模型 将PUMA+/+小鼠随机分为4组,PUMA-/-小鼠随机分为2组,每组10只,共6组:WT正常对照组,WT 4-PBA处理组(WT 4-PBA组),WT 5-FU处理组(WT 5-FU组),WT 5-FU及4-PBA处理组(WT 5-FU+4-PBA组),KO正常对照组,KO 5-FU处理组(KO 5-FU组)。模型组小鼠给予腹腔注射5-FU 75 mg/kg(正常对照组腹腔注射等量的生理盐水)[8],抑制剂组小鼠同时给予腹腔注射4-PBA 150 mg/kg[9],连续给药7 d。
1.3.2 标本采集和处理 在第7天给药8 h后予以小鼠腹腔内注射氯胺酮及甲苯噻嗪混合麻醉[10],麻醉后眼球内眦静脉丛采血,再行开腹手术,迅速分离并采取肝组织,部分放入40 g/L多聚甲醛中固定用于制作石蜡标本,部分保存于液氮中,待提取RNA和蛋白质。血浆于室温下静置1 h后,以1 000 r/min(r=10 cm)的速度离心3 min,结束后吸取上层血清保存于-80℃冰箱。
1.3.3 苏木素-伊红染色(H&E staining) 将制备好的蜡块预冷后进行切片,经过脱蜡和梯度水化之后,滴加苏木素液染核2 min,蒸馏水冲洗,于PBST中返蓝,之后用伊红染色30 s左右,蒸馏水冲洗后在显微镜下观察染色效果,后用中性树胶封片。
1.3.4 免疫组化染色(immunohistochemical staining,IHC staining) 将制备好的蜡块预冷后进行切片,经过脱蜡和梯度水化之后,室温下置于3%H2O2中作用10 min,以消除内源性过氧化物酶;在高温高压条件下,将玻片放入pH为6.0的柠檬酸钠缓冲液中热修复抗原2 min;待温度降至室温后取出玻片,于室温下血清封闭10 min;分别滴加一抗:抗-GRP78(1∶200),抗-PUMA(1∶200),抗-Cleaved caspase-3(1∶100),4℃孵育过夜;PBST冲洗5 min后滴加二抗(1∶300),37℃孵育2 h;PBST冲洗后滴加DAB显色,于蒸馏水中终止反应;苏木素液染核并用中性树胶封片。显微镜下进行观察拍照及结果分析:随机选取20个视野,采用Image J图像分析软件进行结果分析。
1.3.5 TUNEL检测及凋亡指数计算 根据Roche公司的TUNEL产品说明书进行操作,检测凋亡细胞,DAB显色后细胞核呈棕褐色为阳性反应。每张切片随机选取20个视野,计算阳性细胞数和肝细胞总数,凋亡指数=阳性细胞数/肝细胞总数×100%。
1.3.6 肝脏组织RNA的提取和实时荧光定量PCR 根据Trizol试剂说明书按步骤提取肝脏组织总RNA,于分光光度计下测定所提取RNA浓度及纯度,应用TOYOBO逆转录试剂盒将RNA逆转录合成cDNA;应用SYBR Green法对目的基因GRP78、PUMA及内参基因β-actin进行Real-time PCR扩增。
1.3.7 肝脏组织总蛋白提取及蛋白电泳 根据总蛋白提取裂解液说明书按步骤操作,提取肝组织总蛋白并进行定量,保存于-80℃冰箱待用。取适量蛋白样本进行电泳,应用转膜仪将蛋白印迹转至硝酸纤维素膜上,用5%牛奶封闭1 h,分别滴加一抗:抗-GRP78(1∶2 000),抗-PUMA(1∶2 000),抗-Cleaved caspase-3(1∶1 500),抗-β-actin(1∶3 000),4℃孵育过夜;TBST洗涤10 min,滴加二抗(1∶2 000)孵育2 h,TBST洗涤10 min,于暗房中曝光。应用扫描仪将胶片条带扫描并转换成灰度模式,应用Image J图像分析软件进行灰度分析。
1.4 观察指标等
HE及TUNEL染色评估肝脏病理损伤程度;ELISA法检测血清中ALT及AST表达水平;免疫组化染色、RT-PCR、蛋白免疫印迹法检测肝脏组织中PUMA及GRP78表达水平;观察上述指标在不同处理组小鼠的变化。
1.5 统计学方法
本研究计量资料以中位数(下四分位数~上四分位数)表示。两组独立样本间的比较,符合正态分布及方差齐性的数据采用独立样本t检验,若以上条件不满足则采用非参数Mann-Whitney U检验。多组独立样本组间比较采用Kruskal-Wallis H检验,当组间比较有统计学差异时,进一步采用Bonferroni法进行多重比较。所有分析均为双侧检验,P<0.05认为差异具有统计学意义。SPSS 24.0软件进行统计学分析。
2 结果
2.1 5-FU诱导肝脏损伤和凋亡情况
对WT小鼠肝组织进行H&E染色显示,对照组肝小叶结构清晰,肝细胞以中央静脉为中心呈放射性索状排列,汇管区未见异常;5-FU组肝脏点状局灶性坏死,坏死区伴随出血以及炎症细胞浸润,中央静脉扩张充血(图1A)。以上结果提示,在造模剂量下,5-FU诱导了小鼠肝脏组织的损伤。测定WT小鼠对照组及5-FU组血清中ALT的含量,结果显示:5-FU组[160(152~188)]U/L明显高于对照组[25(19~28)]U/L,两组间的差异具有统计学意义(Z=3.78,P <0.001;图1B)。测定AST的含量,结果与ALT的变化情况一致:5-FU组[178(166~198)]U/L明显高于对照组[30(27~38)]U/L,两组间的差异具有统计学意义(Z=3.78,P < 0.001;图1C)。此结果进一步印证了小鼠肝脏组织的损伤情况。
对WT小鼠肝组织进行TUNEL染色显示,对照组肝脏组织内仅可见个别凋亡信号,5-FU组阳性信号明显多于正常对照组(图1A)。对TUNEL染色结果进行统计分析,5-FU组凋亡指数[25(20~28)]%明显高于对照组[2.2(1.7~3.7)]%,两组间差异具有统计学意义(Z=3.78,P <0.001;图1E)。同时提取肝脏组织行蛋白免疫印迹检测以及灰度分析,结果显示Cleaved Caspase-3变化趋势与TUNEL染色结果相一致(图1D),两组的灰度比值分别为 0.027(0.022~0.030)及 0.088(0.079~0.103),两组间的差异具有统计学意义(Z=3.58,P < 0.001;图1F)。
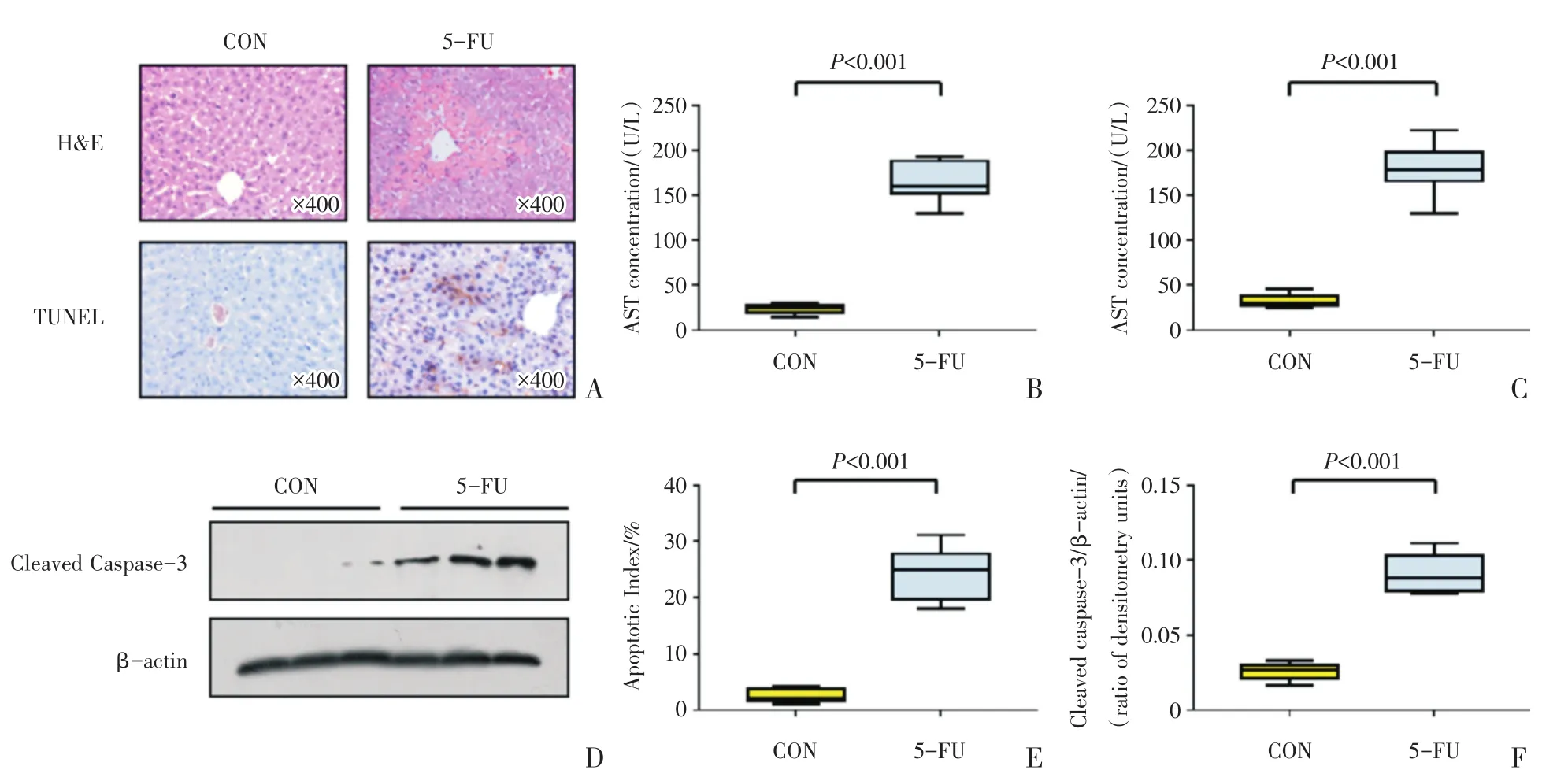
图1 5-FU诱导肝脏细胞损伤和凋亡情况Fig.1 Liver cells injury and apoptosis induced by 5-FU
2.2 内质网应激及PUMA参与5-FU诱导的肝脏损伤和凋亡
对WT小鼠肝脏组织行GRP78以及PUMA免疫组织化学染色及TUNEL染色显示,5-FU组的阳性信号均明显多于正常对照组(图2A)。对每组中的10个组织样本进行染色的随机计数(计数900个细胞),经统计分析后得出:对照组和5-FU组中GRP78阳性信号的比率分别为[3.8(3.0~4.4)]%及[35(29~42)]%,且两组间的差异具有统计学意义(Z=3.78,P < 0.001;图2D);对照组和5-FU组中PUMA阳性信号的比率分别为[4.0,(3.1~5.8)]%及[32(27~37)]%,且两组间的差异具有统计学意义(Z=3.78,P < 0.001;图2E);对照组和5-FU组中TUNEL阳性信号的比率(即凋亡指数)分别为[2.3(1.8~3.5)]%及[21(19~27)]%,且两组间的差异具有统计学意义(Z=3.78,P<0.001;图2F)。
提取WT小鼠肝脏组织的RNA,行Real time-PCR检测并进行分析,结果显示5-FU组中GRP78和PUMA的mRNA相对水平(分别为4.5±0.8及4.7±0.5)较正常对照组(分别为1.0±0.5及1.0±0.4)明显增加,组间的差异均具有统计学意义(tGRP78=11.7320,PGRP78<0.001;tPUMA=18.2730,PPUMA<0.001)(图2B,C)。
以上证据表明在5-FU诱导肝脏损伤过程中,内质网应激的启动分子GRP78以及PUMA表达量均升高,提示其参与了肝脏细胞的损伤与凋亡过程。
2.3 抑制内质网应激减轻了5-FU诱导的肝脏损伤和凋亡
为进一步确定GRP78及PUMA与小鼠肝脏损伤及凋亡的关系,在使用内质网应激抑制剂4-PBA后,对WT小鼠肝脏组织行GRP78以及PUMA免疫组织化学染色及TUNEL染色可见,这三种指标的变化趋势具有一致性,正常对照组及4-PBA组小鼠的肝脏组织内几乎无阳性信号,而5-FU组肝脏组织内阳性信号明显增多,5-FU+4-PBA组可见散在阳性信号(图3A)。对每组中的10个组织样本进行TUNEL染色的随机计数(计数900个细胞),经统计分析后得出:正常对照组、4-PBA组、5-FU组及5-FU+4-PBA组的凋亡指数分别为[2.6(1.5~2.7)]%、[2.6(1.4~3.3)]%、[25(23~30)]%及[12(11~13)]%,5-FU组及5-FU+4-PBA组间凋亡指数的差异具有统计学意义(χ2=32.99,Z=3.78,P < 0.001,图3C)。
提取小鼠肝脏组织蛋白,进行蛋白免疫印迹检测,结果显示正常对照组及4-PBA组小鼠的肝脏组织PUMA及Cleaved caspase-3蛋白的表达较低,而5-FU组这两种蛋白的表达量明显增加,5-FU+4-PBA组表达量较5-FU组明显下降(图3B)。对上述条带进行灰度分析可得,正常对照组、4-PBA组、5-FU组及5-FU+4-PBA组小鼠肝脏组织PUMA的灰度比值分别为0.093(0.064~0.106)、0.073(0.048~0.108)、0.99(0.76~1.24)及0.40(0.33~0.48),5-FU组及5-FU+4-PBA组间的差异具有统计学意义(χ2=29.74,Z=3.58,P <0.001;图3D);上述四组小鼠肝脏组织Cleaved caspase-3的灰度比值分别为0.120(0.108~0.130)、0.110(0.096~0.121)、0.597(0.545~0.704)及 0.230(0.171~0.279),5-FU组及5-FU+4-PBA 组间的差异具有统计学意义(χ2=32.87,Z=3.78,P <0.001;图3E)。
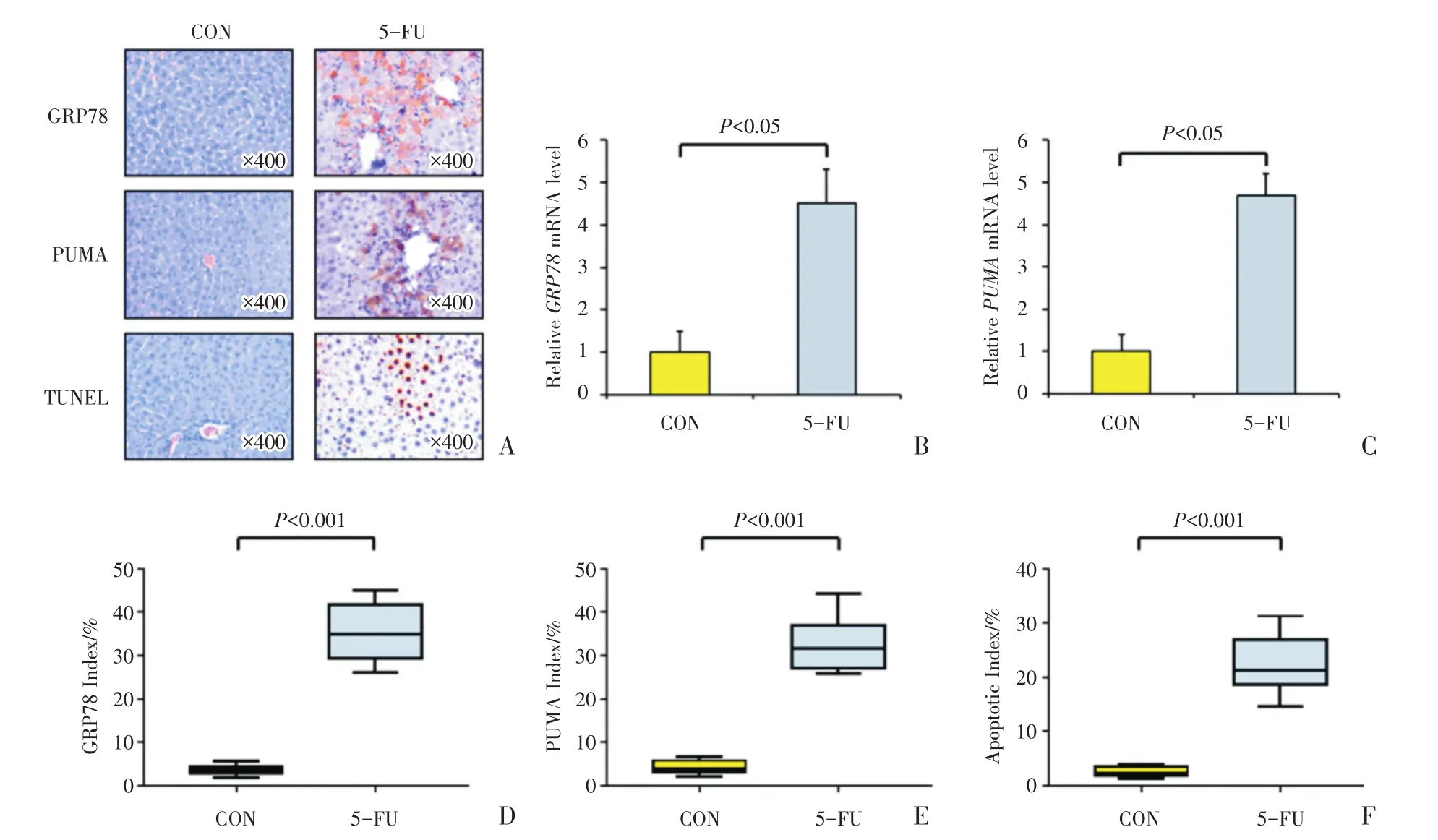
图2 小鼠肝脏组织中GRP78及PUMA的表达情况Fig.2 Expression of GRP78 and PUMA in mouse liver tissues
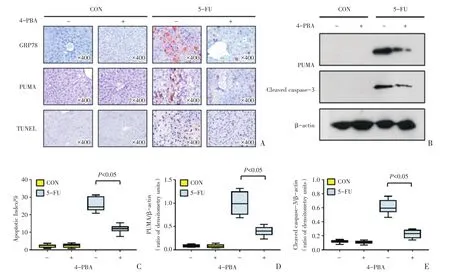
图3 应用ER stress抑制剂后小鼠肝脏组织凋亡情况及GRP78和PUMA的表达情况Fig.3 Liver cells apoptosis and expression of GRP78 and PUMA in mice treated with ER stress inhibitor
以上病理及组织学证据均表明,在应用ER Stress抑制剂4-PBA后,模型组GRP78的表达下调,PUMA的表达随之下调,肝脏细胞凋亡减少,提示GRP78及PUMA在5-FU诱导的肝脏损伤和凋亡中发挥作用,且该通路中PUMA可能位于内质网应激通路的下游。
2.4 特异性敲除PUMA基因减轻了5-FU诱导的肝脏损伤和凋亡
为了进一步确定PUMA是否参与5-FU诱导的小鼠肝脏细胞损伤和凋亡以及与GRP78作用的关系,采用PUMA基因敲除小鼠进行验证。对肝脏组织行HE染色可见,WT及KO正常对照组小鼠的肝脏组织病理结构未见异常,WT 5-FU组小鼠肝脏组织损伤明显,KO 5-FU组的损伤情况较WT 5-FU组改善(图4A)。GRP78免疫组织化学染色可见,WT及KO正常对照组小鼠的肝脏组织内几乎无阳性信号,WT 5-FU组及KO 5-FU组小鼠肝脏组织阳性信号均增多(图4A)。Cleaved caspase-3免疫组织化学染色可见,WT及KO正常对照组小鼠的肝脏组织内几乎无阳性信号,WT 5-FU组小鼠肝脏组织阳性信号明显增多,KO 5-FU组可见散在阳性信号(图4A),对每组中的10个组织样本进行染色的随机计数(计数900个细胞),经统计分析后得出:WT正常对照组,KO正常对照组,WT 5-FU组及KO 5-FU组阳性信号的比率(即凋亡指数)分别为[2.4(1.6~2.7)]%、[3.3(2.6~3.7)]%、[27(23~28)]%及[12(8.9~14)]%,WT 5-FU组及KO 5-FU组间的差异具有统计学意义(χ2=33.99,Z=3.78,P < 0.001;图4C)。
提取小鼠肝脏组织蛋白,进行蛋白免疫印迹检测,结果显示WT及KO正常对照组小鼠的肝脏组织内GRP78表达较低,WT 5-FU组及KO 5-FU组表达量明显增多(图4B)且灰度分析显示这两组间的差异不具有统计学意义(图4D);同时可见,PUMA和Cleaved caspase-3在WT及KO正常对照组小鼠的肝脏组织内表达极低,在WT 5-FU组明显升高,然而KO 5-FU组中的表达量较WT 5-FU组明显下降(图4B),灰度分析的结果与观察结果一致(图4E、F)。
以上证据提示:在相同剂量造模情况下,PUMA敲除会减轻肝脏细胞的损伤和凋亡,PUMA参与了5-FU诱导的肝细胞损伤和凋亡过程;同时得出PUMA的敲除不会影响GRP78的表达,即不会影响ER stress的激活。
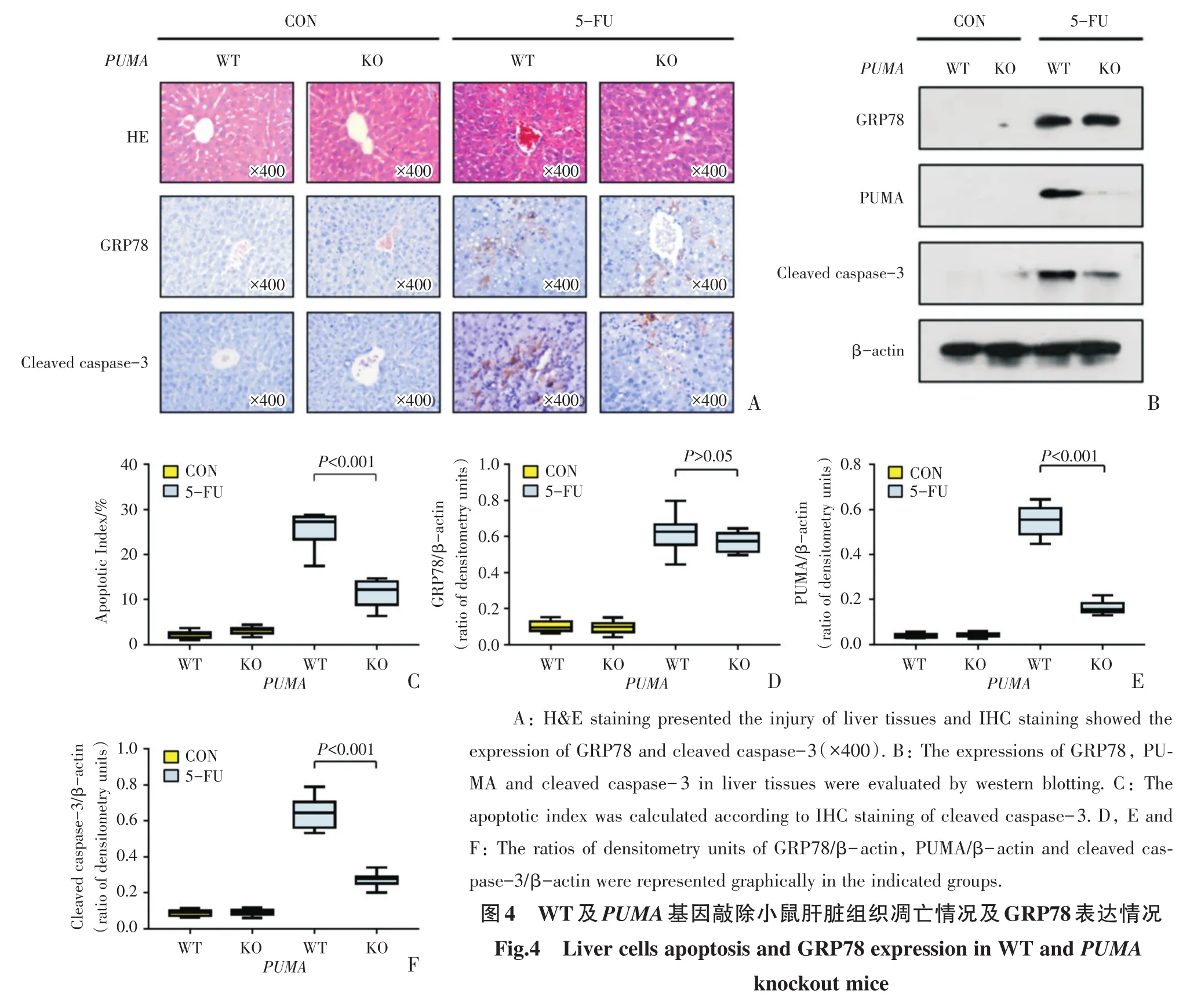
图4 WT及PUMA基因敲除小鼠肝脏组织凋亡情况及GRP78表达情况Fig.4 Liver cells apoptosis and GRP78 expression in WT and PUMA knockout mice
3 讨论
本研究中,我们建立了5-FU诱导的小鼠肝脏损伤模型,检测发现血清中ALT及AST表达明显升高,提示小鼠肝脏功能的损伤,TUNEL染色凋亡信号明显增加且Cleaved caspase-3表达升高进一步表明5-FU诱导了小鼠肝脏细胞的损伤及凋亡。本课题组及其他大量研究结果证实,在其他系统组织损伤的病理过程中,ER stress可以通过上调PUMA的表达激活线粒体凋亡途径,进而促进组织细胞的损伤与凋亡[11-13],但尚不明确这一过程是否参与了5-FU诱导小鼠肝脏细胞的损伤及凋亡。
PUMA是Bcl-2家族中BH3-only亚家族成员,能够将凋亡信号传递至线粒体触发细胞凋亡,本实验免疫组化染色以及Real time-PCR检测均显示5-FU组小鼠PUMA表达明显升高,证实PUMA参与了5-FU诱导肝脏细胞损伤和凋亡。同时有研究表明内质网应激会激活线粒体凋亡通路,诱导损伤细胞凋亡,在本实验中5-FU组小鼠肝脏组织免疫组化染色以及Real time-PCR检测显示伴侣分子GRP78表达明显升高,提示ER stress也参与了这一损伤及凋亡过程。
为进一步探索PUMA及ER stress参与5-FU诱导的小鼠肝脏细胞损伤及凋亡的途径,给予小鼠注射ER stress抑制剂4-PBA,结果显示同等剂量的5-FU刺激下,4-PBA组小鼠肝脏组织GRP78及PUMA表达低于5-FU组,同时肝脏细胞凋亡明显减少[14],证实了PUMA及ER stress参与了5-FU诱导肝脏细胞损伤和凋亡;上述过程中抑制ER stress引起了PUMA的下调,提示PUMA的表达可能受ER stress的调控。为验证以上假说,引入了PUMA基因敲除小鼠,结果证实等剂量的5-FU诱导时,PUMA基因敲除小鼠的肝脏细胞损伤与凋亡程度较WT小鼠明显减轻,进一步证实PUMA促进了5-FU诱导的小鼠肝脏细胞损伤及凋亡;同时发现PUMA的敲除不会影响GRP78的表达,说明PUMA并不参与ER stress的激活过程,结合上述4-PBA的使用导致5-FU诱导的小鼠肝脏组织中GRP78及PUMA的表达均下调的结果,我们有理由认为5-FU诱导的小鼠肝脏损伤过程中,ER stress的激活诱导了PUMA高表达,最终引起了肝脏细胞的损伤及凋亡。
综上所述,5-FU通过激活内质网应激上调PUMA的表达,进而促进了肝脏细胞的损伤以及凋亡,提示在PUMA及ER stress是化疗性肝损伤的潜在性治疗靶点,有希望通过抑制内质网应激的激活以及PUMA的表达来减轻以5-FU为代表的化疗药物对肝脏的毒副作用。

