载药微球栓塞联合甲磺酸阿帕替尼治疗中晚期原发性肝癌的近期疗效
万 源,陈 斌,李 楠,林 润,唐可禺,戴海涛,温春勇,黄勇慧
(中山大学附属第一医院放射介入科,广东 广州 510080)
原发性肝癌(hepatocellular carcinoma,HCC)是我国的常见病,起病隐匿,早期诊断困难,患者经临床确诊或出现症状时多处于无手术指征的进展期[1-2]。经导管动脉化疗栓塞术(trans-arterial chemoembolization,TACE)是进展期肝癌的一线治疗方案,可有效地延长患者生存期[3]。近年来研究表明,相对于传统的使用碘油的动脉化疗栓塞(C-TACE),载药微球动脉化疗栓塞(DEB-TACE)具有更高的安全性、更高接受度和效价比[4]。然而,TACE术后缺血缺氧导致的血管内皮生长因子(vascular endothelial growth factor receptor,VEGF)表达升高以及肿瘤新生血管形成,是肿瘤复发并造成TACE失效的重要因素[5]。甲磺酸阿帕替尼是一种小分子的抗血管生成药物,其主要通过与生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)高度选择性结合,来竞争性抑制VEGF与VEGFR-2结合,并抑制VEGFR-2磷酸化,从而发挥强有力的抗肿瘤作用[6]。本研究通过观察载药栓塞微球(HepaSphere 50~100 μm,Merit Medical)负载阿霉素联合甲磺酸阿帕替尼治疗中晚期原发性肝癌的安全性和近期治疗反应,为探索更有效的联合治疗肝细胞癌方法提供初步的经验。
1 材料与方法
1.1 一般资料
1.1.1 患者资料 筛选2016年1月至2018年6月在本中心收治的经临床确诊为原发性肝癌的患者,筛选过程如图1所示,最后筛选出11位患者,均为接受1次HepaSphere载药微球栓塞及甲磺酸阿帕替尼联合治疗的原发性肝癌患者,中位年龄为50岁(表1)。本研究经医院伦理委员会审批,所有患者均签署知情同意书。
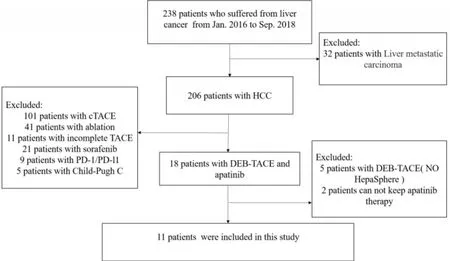
图1 筛选流程Fig.1 Trial profile
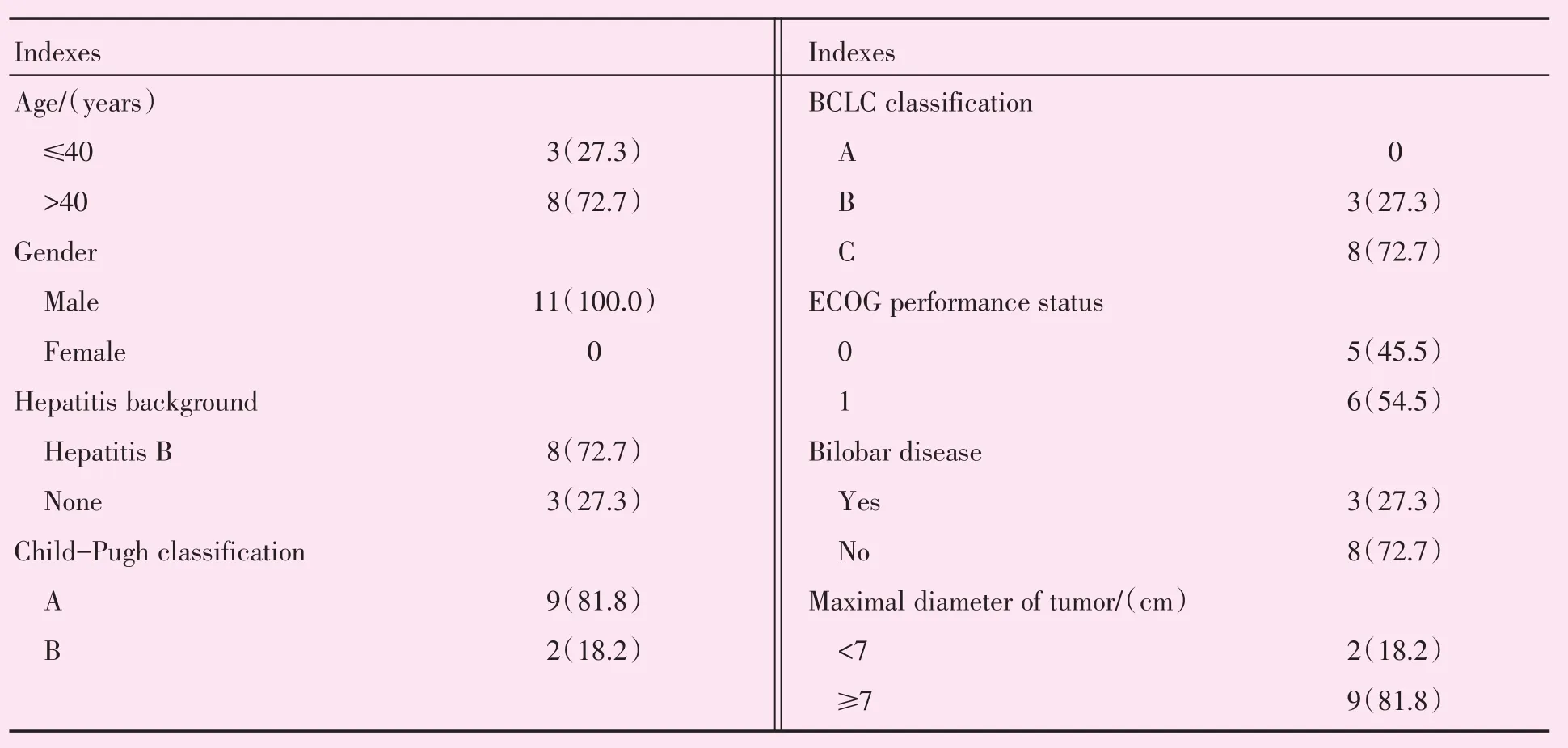
表1 肝癌患者术前的临床病理资料Table 1 The preoperative clinicopathologic data of patients with primary liver cancer [n(%)]
1.1.2 排除标准 ①排除经临床或病理确诊为转移性肝癌;②排除未接受载药栓塞微球(Hepa-Sphere 50~100 μm ,Merit Medical)负载阿霉素联合甲磺酸阿帕替尼治疗;③排除肝功能Child分级C级或者D级;④排除累计服药天数小于随访期50%的病例,且暴露剂量小于每天250 mg的病例;⑤排除DEB-TACE过程中栓塞不完全不理想(肿瘤太大/无法超选等)病例;⑥排除随访时间内接受了手术,消融,系统化疗,其他靶向药物治疗,PD-1/PDL-1等免疫治疗,以及其他对治疗结果可能产生影响治疗的病例。
1.2 治疗方法
1.2.1 术前HepaSphere加载阿霉素及用量选择使用标准4倍法加载阿霉素,每个患者均使用1瓶载药微球和50 mg阿霉素。
1.2.2 载药微球进行栓塞 ①血管造影:于股动脉行Seldinger穿刺,导入造影导管,根据术前CT/CTA提供的肿瘤供血血管信息,对肠系膜上动脉、腹腔干动脉、膈动脉等血管进行选择性插管造影,明确需DEB-TACE治疗肿瘤的所有供血动脉。②对肿瘤供血动脉行超选择栓塞:对于需要超选择的肿瘤,使用2.7 F RenegadeHI-FLOTM微导管(Boston Scientific,Ireland)超选择栓塞,栓塞时微导管末端位置应尽可能回避正常肝脏供血血管,同时防止微导管嵌顿,保证微球能顺动脉血流到达肿瘤区域。必要时可对正常肝段或胆囊供血动脉进行保护性栓塞。完成超选择后,缓慢注入混有对比剂的HepaSphere微球(1 mL/min),注射过程中旋转注射器或者用三通混悬以避免微球的沉淀。对造影所见每条肿瘤供血动脉均进行超选择栓塞。③栓塞终点:当2~5个心跳周期后造影剂被廓清时,此时,无论是否有剩余微球,均需停止栓塞。若1瓶载药HepaSphere微球使用完毕后,肿瘤仍未栓塞完全,则逐级使用不同直径Embosphere(50~100 μm&100~300 μm,Merit Medicald)微球栓塞肿瘤,直至达到栓塞终点。
1.2.3 药物治疗 患者在术后3~5 d内开始服用甲磺酸阿帕替尼治疗。患者建议的起始服药剂量为500 mg/d,达到充分药物暴露剂(服药时间不小于随访期50%,且暴露剂量不小于250 mg/d),且未在随访时间内服用其他靶向药物或者免疫治疗药物的病例才被纳入本项研究。
1.2.4 术后对症治疗和随访 ①介入术后给予患者右下肢24 h制动,给与相应护肝等对症治疗;复查肝功能、血常规等检查。②建议患者在术后(6±2)周回本中心复查相关实验室检查项目,如肝功能、血常规及甲胎蛋白(alpha fetoprotein,AFP)检查及CT或MRI等。并对影像学结果进行评价,评价标准为实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),改良实体瘤疗效评价标准(modifiedresponse evaluation criteria in solid tumors,mRECIST)及欧洲肝脏研究协会标准(european association for the study of the liver,EASL)。③对比患者每次治疗前与治疗后2 d、治疗后短期内肝功能变化,并且对比治疗前和治疗后肿瘤指标AFP的变化。
1.3 统计学处理
本研究使用SPSS 20.0统计学软件进行分析。患者术前术后肝功能指标采用进行统计描述,计数资料以例数及百分数来描述,治疗前后的肝功能指标采用配对样本t检验,以P<0.05为差异有统计学意义。
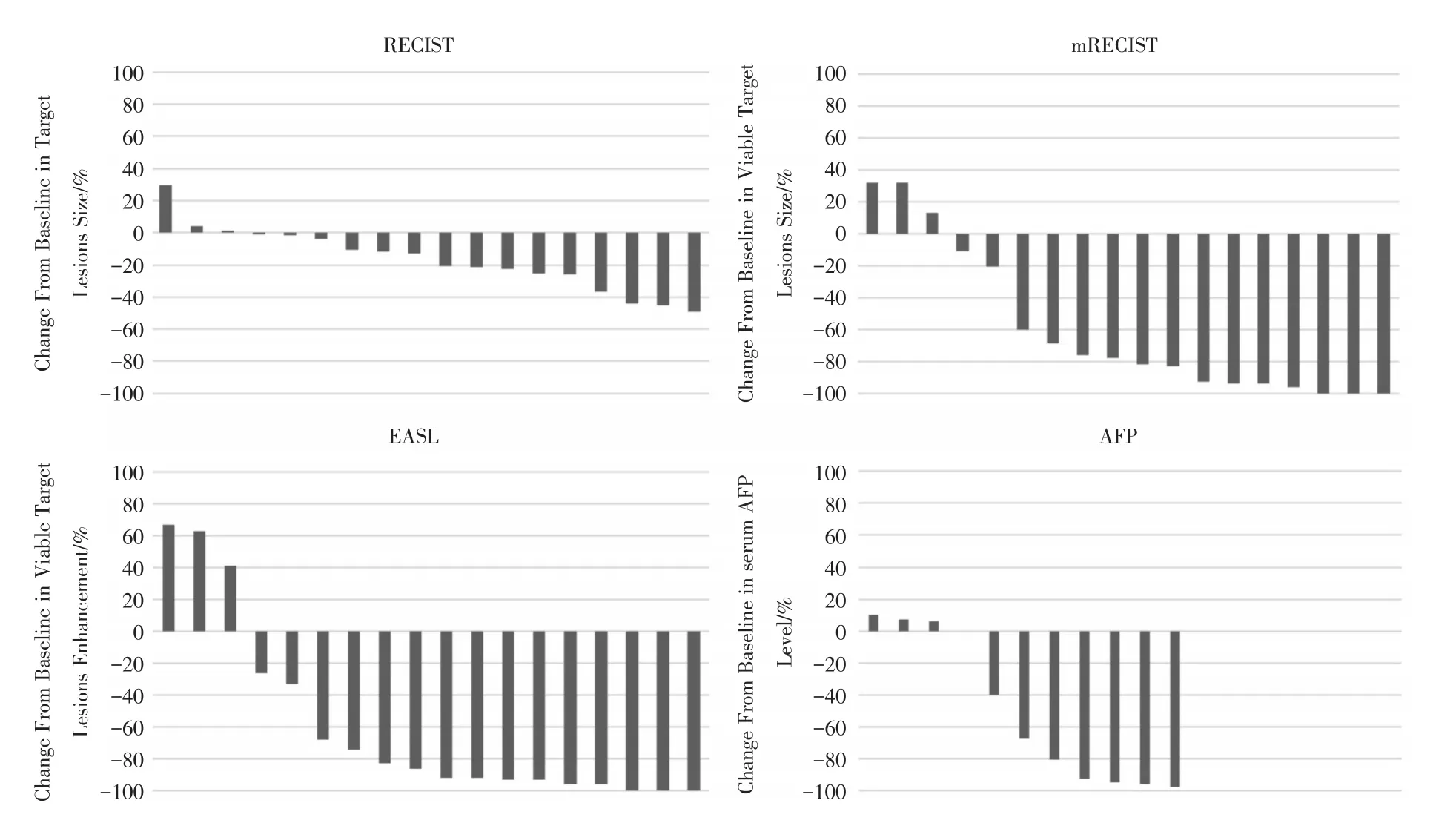
图2 联合治疗后患者靶病灶及AFP的改变Fig.2 The change of target lesions and AFP of patients after the combined therapy
2 结果
2.1 复查及服药情况
筛选所得11例患者均按照建议时间进行了第1次DEB-TACE治疗后的复查,其中术前CT/MRI与第1次复查间隔时间为4.2~8.0周,平均为6.2周。所有患者均按建议使用了甲磺酸阿帕替尼治疗,平均服药时长为1.3个月,服药剂量为(386.3±130.6)mg/d,随访时间内未服用其他靶向药物或者免疫治疗药物。有1例患者在服药期间出现手足综合征(Ⅲ级),总服药时长为1.1个月,另外1例服药期间出现骨髓抑制(Ⅲ级),总服药时长为1.1个月,其余维持用药至随访时间。
2.2 疗效评价
所有患者均使用HepaSphere载药微球进行栓塞,手术技术成功率为100%,所有患者均联合使用甲磺酸阿帕替尼联合治疗。分析11例患者AFP并对治疗反应进行影像学评价,评价中总共选取的18个可评价病灶作为靶病灶(图2、3)。根据RECIST,mRECIST及EASL标准,客观缓解率(the objective response rate,ORR)分别为36.4%、63.6%、72.7%,疾病控制率(the disease control rate,DCR)分别为90.7%、72.7%、81.8%(表2)。
2.3 安全性评价
根据NCI制定的CTCAE 4.0标准,患者服用甲磺酸阿帕替尼后出现的主要不良反应有腹泻(72.7%)、高血压(81.8%)、手足综合征(54.5%)、乏力(63.6%)等,均未出现IV级不良反应(表3)。TACE术后2 d肝功能变化主要表现为谷草转氨酶(alanine transaminase,ALT)、谷丙转氨酶(aspartate aminotransferase,AST)以及总胆红素(total bilirubin,TBIL)轻度升高,升高值具有统计学意义(t=-2.479、t=-4.010、t=-2.432,P=0.033、P=0.002、P=0.035),白蛋白变化不明显(t=-0.975,P=0.352),且ALT、AST、TBIL在术后1月复查恢复正常(t=1.953、t=1.402、t=1.440,P=0.079、P=0.191、P=0.180)。TACE术后5例患者出现中等程度发热,最高温度为38.8℃,平均持续时间为3d,有7例患者出现轻度恶心、呕吐,有9例患者出现腹痛、腹胀,其中1人术后第2天突发腹痛及腹胀,根据VAS评分可达5分,给予对症治疗之后均恢复良好,11例患者术后平均住院时间为5 d。
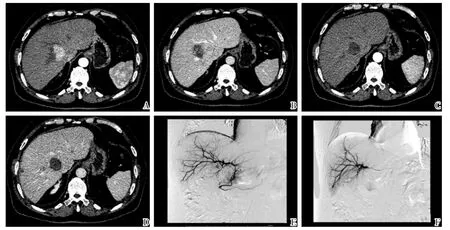
图3 联合治疗前后的影像学表现Fig.3 CT images of pre-and post-combined therapy
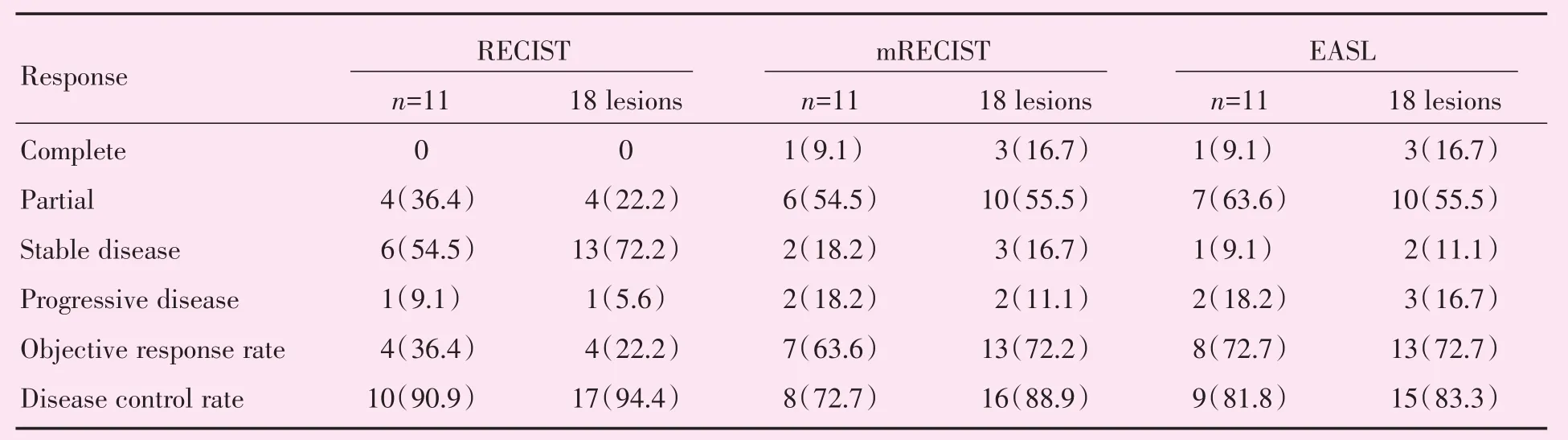
表2 联合治疗疗效评估Table 2 Efficacy of combined therapy based on tumor response [n(%)]
3 讨论
TACE作为中晚期肝癌患者一线治疗方法。对于无法手术切除的中晚期肝癌患者,TACE可有效延长患者生存时间[3]。C-TACE是传统的栓塞方法,它常用碘油加顺铂、阿霉素或其他的化疗药物进行混合,然后经导管将混合后形成的乳剂与明胶海绵灌入肿瘤供血动脉,以达到栓塞并使肿瘤坏死的目的。DEB-TACE是C-TACE的改进,使用不同直径的栓塞微球负载化疗药物来替代碘油混合化疗药物进行栓塞的治疗模式,目前国内比较常用的HepaSphere和DCB两种载药微球[7-8]。近年来使用DEB-TACE比C-TACE具有具有更高安全性、更高的可重复性度和效价比[4,9]。在治疗评价方面,由于C-TACE治疗后,病灶内碘油沉积,残留病灶容易被掩盖,导致对肿瘤治疗疗效评价不准确,尤其是使用mRESICT标准[10]。但是DEB-TACE依然无法克服TACE后VEGF上导致的残余肿瘤复发问题。并且研究表明VEGF水平的增高是肝癌患者预后差及复发的预判指标之一[5]。因此,对于部分病人,DEB-TACE仍有联合抗血管生成靶向药物的必要。
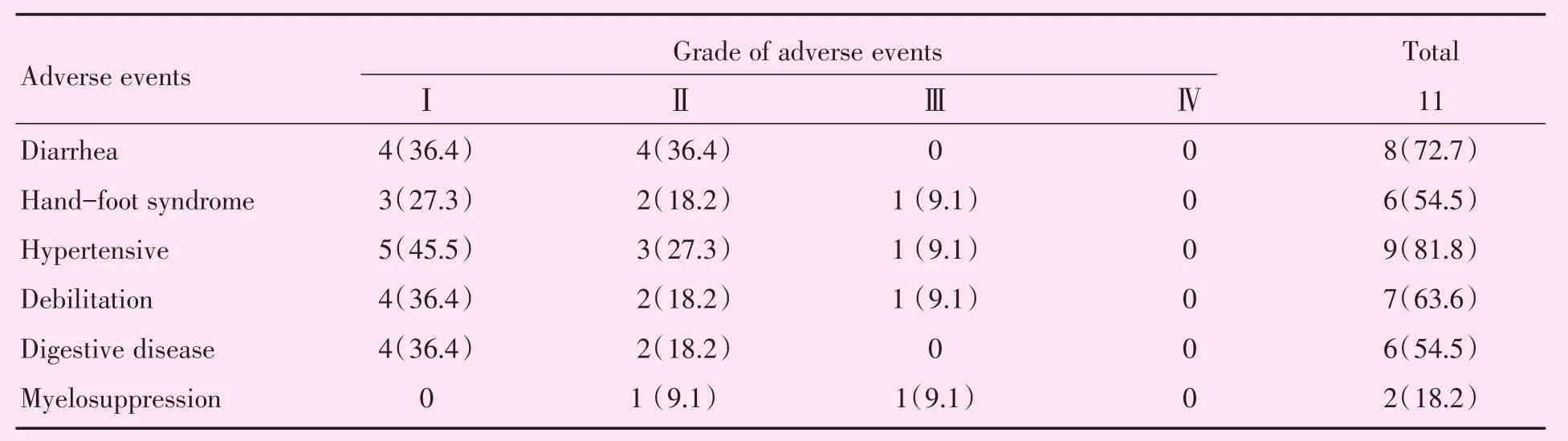
表3 联合治疗治疗后的不良反应Table 3 Adverse events after apatinib treatment [n(%)]
索拉非尼(sorafenib)是治疗中晚期肝癌的一线用药。最近的几个Ⅰ期和Ⅱ期临床试验[11-12]已经证实C-TACE或者DEB-TACE联合sorafenib治疗是安全可行的。然而,也有研究[13]结果显示DEB-TACE联合索拉非尼治疗相对于单用DEBTACE治疗,并没有改善患者的肿瘤进展时间(time to tumor progression,TTP)及其总体生存期(overall survival time,OS)。在该项研究[13]中,亚洲国家患者的TTP以及OS要明显优于非亚洲国家患者,为了解释这一现象,研究者观察到亚洲国家患者持续服用索拉非尼的时间要长于非亚洲国家患者(持续服药时长中位数分别为30周和17周)。因此,提示TACE术后持续服用sorafenib的时长和疗效相关,持续服用sorafenib的时间越久,疗效越好。另一项研究[14]中,韩国患者比日本患者sorafenib治疗持续时间更长,联合治疗后的TTP较单用TACE治疗明显改善,日本患者服药持续时间明显缩短,TTP未见差异。以上研究表明sorafenib与TACE联用虽有益于中晚期肝癌患者,但前提是sorafenib需要持续服用较长的时间,疗效才会有明显的改善。其原因可能与使用sorafenib后肿瘤治疗反应需要较长时间才表现出来有关[15]。本课题组的前期研究[16]显示越早的联合使用抗血管生成药物肿瘤治疗效果越佳。
Sorafenib是一种具有抗血管生成和抗增殖活性的多激酶抑制剂[14]。而甲磺酸甲磺酸阿帕替尼(apatinib)是一种选择性最高的新型VEGFR-2抑制剂,与sorafenib相比,具有10倍的VEGFR-2酪氨酸激酶结合亲和力[17]。由于apatinib相对于sorafenib具有更高的靶向结合率,早期使用apatinib,有利于使体内VEGF水平在TACE术后更快地得到控制,因此有可能带来更佳地联合治疗效果。另一方面,DEB-TACE的一大优势就是化疗效果的更加持久性,而apatinib可逆转多药化疗耐药,提高传统化疗药物的疗效,该优势可能在联合DEB-TACE中得到更好的发挥[18]。
根据本次研究结果,RECIST,mRECIST及EASL标准,ORR分别为36.4%、63.6%、72.7%;DCR分别为90.7%、72.7%、81.8%,取得了比较满意的近期疗效。我们发现通过这3种标准评价的结果是略有不同的。其中,尤其是RECIST和其他两种标准差别较大。虽然,RECIST标准的治疗反应率最高,但是它与mRECIST或者EASL以及AFP变化的趋势明显不一致。这可能与未将残存肿瘤的生物学活性纳入考虑有关,这一现象既往已有研究进行分析[19]。无论是在原发性肝癌的TACE治疗还是抗血管靶向药物治疗方面,短期治疗反应与生存获益存在相关性,其中以mRECIST或者EASL标准评价更为准确,应用该标准评价,取得CR的患者的总体生存期明显要好于PD或者SD的患者,且对于评价SD患者与总生存期的相关性也比RECIST标准更加敏感[19-20]。C-TACE术后由于碘油沉积的影响,某些存活肿瘤可能会被掩盖,过高评估治疗反应的可能[19]。本组病例均采用了DEB-TACE治疗替代C-TACE,去除了病灶内即没有碘油的沉积对存活肿瘤评价的干扰,所以能够更加清晰地显示肿瘤残留病变的情况,因此对于仍具有生物活性的肿瘤评价也更加准确。在本组病例中,有2例患者经首次联合治疗后,经mRECIST和EASL标准评价,被界定为客观反应率仍然不佳,其中1例若采用RECIST1.1标准则为稳定。可见将存活肿瘤评价的理念和DEB-TACE治疗技术结合,有利于更早点筛选治疗无效病例,为及时转换治疗方案提供非常重要的依据。在既往研究[21]中,同样采用mRECIST标准评价,其治疗后1和3月的ORR分别为66.7%和45.8%。我们的首次治疗后4~8周ORR为72.7%。即使不考虑在C-TACE中,mRECIST标准高估治疗反应率的因素,我们的结果已初步显示出DEB-TACE替换C-TACE的在治疗效果上的优势。在安全性方面,11例患者中均未出现Ⅳ级不良反应,只有4例患者出现Ⅲ级不良反应,分别是手足综合征、高血压、乏力以及骨髓抑制。但均可通过减量或者对症治疗等方法来减轻不良反应。在最近的C-TACE联合apatinib的研究中[21-22],也均未发现Ⅳ级药物相关不良反应,但TACE相关不良反应也相似。本研究的肝功能随访数据还提示,DEB-TACE后患者肝功能均能在4~8周内完全恢复到术前水平。本研究仅有两例病例因为不良反应,适当减少了总暴露剂量,说明联合治疗的可接受度也是较理想的。
本研究是对原发性肝癌短期治疗反应的回顾性研究,经过严格筛选,取得了符合要求11例病例完整相关数据。且所有病例均严格按照专家建议进行操作,减少了既往技术性因素导致疗效的偏差[9],提高了结果的的可评价性和可信度。近期关于apatinib联合TACE的类似研究报道中,例数较多的病例组也仅为27例和19病例,其研究结果与本研究基本一致[22-23]。两篇报道中病例数虽稍多,但均为采用C-TACE作为TACE的治疗技术。权威专家建议指出:DEB-TACE可重复可评价性更高的TACE治疗技术,更加适合在中晚期病例选用[9]。但目前尚未有关于DEB-TACE联合apatinib的临床研究报道。本研究局限于随访时间,无法提供患者最终生存状况的结果。但在肝癌治疗方面,对肿瘤客观反映率与生存状况的联系上,肿瘤治疗反应指标,尤其是根据mRECIST或者EASL标准评价的治疗反应与最终生存状况有明确的相关性[19]。因此。本研究取得的治疗反应结果对进一步前瞻对照研究的设计有一定参考价值。

