鼻内翻性乳头状瘤局部炎症浸润特征分析
曹 宸,余思菲,郭雪雪,周宇涛,李春炜,陈合新
(中山大学1.附属第一医院耳鼻咽喉医院;2.中山医学院免疫学教研室,广东 广州 510080)
鼻乳头状瘤是鼻腔鼻窦最常见的上皮组织性良性肿瘤,其中,鼻内翻性乳头状瘤(nasal inverted papilloma,NIP)约占乳头状瘤的70%,约占全部鼻腔鼻窦肿瘤的0.5%~4.0%[1];人群中,鼻内翻性乳头状瘤的患病率为0.2/105至0.6/105,男女比例约为3∶1~5∶1[2]。内翻性乳头肿瘤(inverted papilloma,IP)多发于鼻腔外侧壁和鼻中隔,主要侵犯上颌窦和筛窦,症状表现为鼻塞,流黏脓涕时带血,伴有头痛和嗅觉异常;其主要的临床特征为:复发倾向(20%~47%)[3],破坏周围解剖结构,与恶变相关(恶变率约为6%~13%)[1-4]。目前,NIP的具体致病机制及主要影响因素暂不明确,有学者提出肿瘤组织的慢性炎症在该病发生发展过程中参与重要作用,局部上皮改变与肿瘤复发有关[5]。因此,本研究拟通过对肿瘤组织局部炎症细胞浸润类型及程度进行分析,探讨NIP的临床病理学特征与局部炎症细胞表达相关性,为NIP发病机制中的慢性炎症假说提供新的理论依据。
1 材料与方法
1.1 临床资料
本实验收集2016年6月至2018年6月在中山大学附属第一医院耳鼻咽喉头颈外科住院的接受肿瘤切除术的50例NIP患者肿瘤组织;并收集接受单纯鼻中隔偏曲矫正手术的20例患者鼻腔鼻窦粘膜作为正常对照组。NIP患者均接受鼻窦CT与鼻内镜检查,并根据检查结果进行Krouse分级。其余临床指标评价标准包括:①吸烟:患者术前一年内仍有吸烟行为,每日吸烟20根烟及以上;②复发:患者入院前接受鼻部肿物切除手术,术后病理诊断为内翻性乳头状瘤;③伴发息肉:肿物切除术后病理诊断存在息肉样变。④Krouse分级:Ⅰ级:肿物局限于鼻腔内;Ⅱ级:肿瘤局限于筛窦、上颌窦内侧壁和中鼻道;Ⅲ级:肿瘤侵犯范围至上颌窦外侧壁和下壁并侵犯蝶窦、额窦;Ⅳ级:包括鼻腔鼻窦外侵犯或肿瘤恶变。 本研究已通过院伦理委员会批准,病例组与正常对照组均已签署知情同意书。
1.2 主要试剂与实验仪器
中性树脂(懿洋,上海)、组织固定液(鼎国昌盛,北京)、柠檬酸抗原修复液(鼎国昌盛,北京)、苏木素伊红染色试剂盒(索莱宝,北京)、苏木素染色液(索莱宝,北京)、Anti-Neutrophil Elastase antibody(Abcam,美国)、Anti-CD68 antibody(Abcam,美国)、Anti-CD4 antibody(Abcam,美国)、CD8α(C8/144B)(CST,美国)、APC/Cy7 anti-human CD3(biolegend,美国)、PerCP/Cy5.5 anti-human CD4(biolegend,美国)、FITC anti-human CD8(biolegend,美国)、APC anti-human IFN-γ(biolegend,美国)、过氧化物酶/DAB 兔/小鼠(DAKO,丹麦)、胶原酶Ⅰ(Sigma-Aldrich,美国)、DNA酶Ⅰ(Takara,日本)、淋巴细胞分离液(浩阳生物,天津)、细胞破膜固定试剂盒(BD,美国)、流式刺激剂与阻断剂(Gibco,美国)、光学显微镜(Leica-SFL4000,德国)流式分析仪(Beckman Coulter-CytoFLEX,美国)、液相芯片分析系统(Luminex magpix,RD,美国)、多因子检测试剂盒(Human luminex screening assay,RD,美国)。
1.3 实验方法
HE染色:嗜酸性粒细胞观察与计数采用HE染色法。染色方法:取肿瘤或钩突粘膜组织于多聚甲醛中固定24 h后,脱水蜡块包埋后连续切片,片厚5 μm。65°C烘片30 min;二甲苯脱蜡10 min;100%、95%、85%、75%乙醇各浸洗1 min;HE染色3 min;盐酸乙醇分化30 s;2%稀氨水返蓝30 s;伊红染色3 min;阶梯浓度乙醇浸洗脱水1 min;二甲苯10 min;中性树脂封片。在400倍视野下观察组织切片中嗜酸性粒细胞呈圆形,胞质内有均匀分布的嗜酸性颗粒,细胞核主要表现为双叶核或多个圆核,随机选取5个不同视野,计算阳性细胞平均数。
免疫组化染色:嗜中性粒细胞、巨噬细胞、CD4+T淋巴细胞、CD8+T淋巴细胞均通过免疫组化染色进行细胞计数与观察。染色方法:取肿瘤或钩突粘膜组织于多聚甲醛中固定24 h后,脱水蜡块包埋后连续切片,片厚5 μm。第1天,65°C烘片30 min;二甲苯脱蜡10 min;100%、95%、85%、75%乙醇各浸洗1 min;柠檬酸钠高压热修复15 min;100 mL/L羊血清封闭抗原0.5 h;一抗过夜;第2天,二抗孵育0.5 h后,DAB显色5 min;苏木素复染30 s;阶梯浓度乙醇脱水1 min、二甲苯脱水10 min;中性树脂封片后镜下观察。在400倍镜视野下,随机选取5个不同视野,计算阳性细胞平均数。
组织单核细胞分离:剪碎新鲜肿瘤或钩突粘膜组织至1~2 mm,于胶原酶Ⅰ、DNA酶Ⅰ中37°C孵育40 min;消化组织混合液过100 μm滤网得细胞混合液;往淋巴细胞分离液上层缓慢加入细胞混合液,500×g,5 min离心,取中间单核细胞层;PBS清洗离心,得到组织分离单核细胞。
流式细胞染色:细胞表面染色:取组织单核细胞PBS重悬,4°C避光孵育流式表面抗体30 min;PBS清洗离心,调整细胞数至106/mL,上机检测。胞内因子染色:取组织单核细胞PBS重悬,加入流式细胞刺激剂与阻断剂37°C,体积分数为5%CO2条件下孵育6 h;PBS清洗离心重悬后进行细胞表面染色;PBS清洗离心后进行细胞破膜固定;4°C避光孵育流式胞内因子抗体30 min;PBS清洗离心,调整细胞数至106/mL,上机检测。
IFN-γ蛋白表达水平:新鲜肿瘤组织与正常对照组织4°C匀浆,离心后收取上清液。按多因子蛋白检测试剂盒Human luminex screening assay(RD,USA)说明进行分步骤加样;上机,利用液相芯片分析系统(Luminex magpix,RD,美国)检测匀浆液中IFN-γ表达水平变化。
1.4 统计学分析
所有数据均使用SPSS 18.0软件进行分析处理。病例组与对照组两组之间炎症细胞及IFN-γ表达差异用曼-惠特尼U检验分析;NIP病例组内Krouse分级与肿瘤复发特性相关性分析用卡方检验分析;不同程度临床病理特征之间炎症细胞浸润数差异性分析用曼-惠特尼U检验。双侧检验,取α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 患者临床表征情况
基线资料:通过耳鼻喉住院部收集NIP患者50例、正常对照组20例。NIP患者中,男41例,女9例;平均年龄 52(95%CI,41-60.5)岁;吸烟患者∶不吸烟患者=23∶27;初发患者31例,复发2次及以内患者13例,复发2次以上患者6例。正常对照组中,男15例,女5例;平均年龄30.5(95%CI,26-39)岁,吸烟患者:不吸烟患者=17∶3;所有对照组均为初次入院。
鼻内镜检查50例NIP患者中,45例表现为单侧肿块,5例表现为双侧,肿物表面均呈现粗糙不光滑样改变;40例鼻腔粘膜可见水肿与大量粘液脓性分泌物,5例有粘液血性分泌物,余病例未见明显鼻腔鼻窦分泌物。根据Koruse评分,术前鼻窦CT检查提示,30例患者主要表现为KrouseⅡ级(筛窦、上颌窦内侧壁和中鼻道受累);14例患者主要表现为KrouseⅢ级(上颌窦外侧壁和下壁并侵犯蝶窦、额窦);仅少数病例表现为KrouseⅠ级或KrouseⅣ级。术后病理检查提示,16例患者伴同侧息肉,1例患者伴发对侧息肉生;所有NIP患者均伴有同侧或双侧慢性鼻窦炎。
2.2 肿瘤局部炎症细胞染色情况
对50例NIP病例组与20例正常对照组组织切片进行HE染色与免疫组化染色与分析,可见NIP肿瘤组织局部可见明显炎症细胞浸润。HE染色提示:NIP患者表现为上皮组织高度增生伴不同程度鳞状化生,上皮下间质结构紧密,存在不同程度炎症表现。
运用曼-惠特尼U检验分析每高倍视野下(400倍)炎症细胞浸润数提示:相对于正常粘膜对照组,NIP组嗜酸性粒细胞(P<0.001)、嗜中性粒细胞(P <0.001)、巨噬细胞(CD68+;P <0.001)、TH细胞(CD4+T淋巴细胞;P=0.005)数量均明显增多,差异有统计学意义,TC细胞(CD8+T淋巴细胞;P=0.990)未见明显差异性表现。NIP中,嗜中性粒细胞、嗜酸性粒细胞与巨噬细胞主要聚集于增厚上皮内与上皮下间质近基底膜处;TH细胞与TC细胞主要浸润于远离上皮间质区域,呈大面积散在分布或不规则团块状聚集(图1),主要炎症细胞浸润数据见表1。
2.3 肿瘤内淋巴细胞表达情况
50例NIP组织与20例正常对照组织进行局部淋巴细胞流式细胞学分析提示,相对于正常对照组,NIP组表现为CD4+T淋巴细胞比例升高,CD8+T淋巴细胞比例下降,CD4+T细胞/CD8+T细胞比值1.81,明显高于正常对照组CD4+T细胞/CD8+T细胞比值0.63(图2)。
运用曼-惠特尼U检验比较NIP病例组与正常对照组内CD4+IFN-γ+T淋巴细胞(TH1细胞)与CD8+IFN-γ+T淋巴细胞(TC1细胞)表达情况,发现TH1细胞相对于正常对照组存在高表达,差异有统计学意义;TC1细胞相对于正常对照组未见明显表达差异(图3),流式细胞检测局部T淋巴细胞数据见表2。
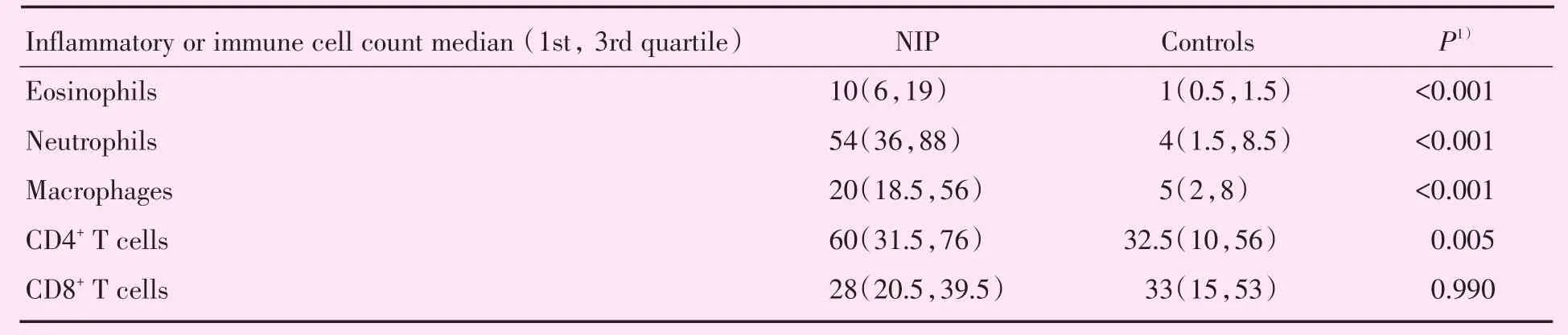
表1 NIP与正常对照组组织局部炎症细胞浸润程度组化分析Table 1 The Analysis of Immunohistochemical Cell Intensity in NIP and Controls
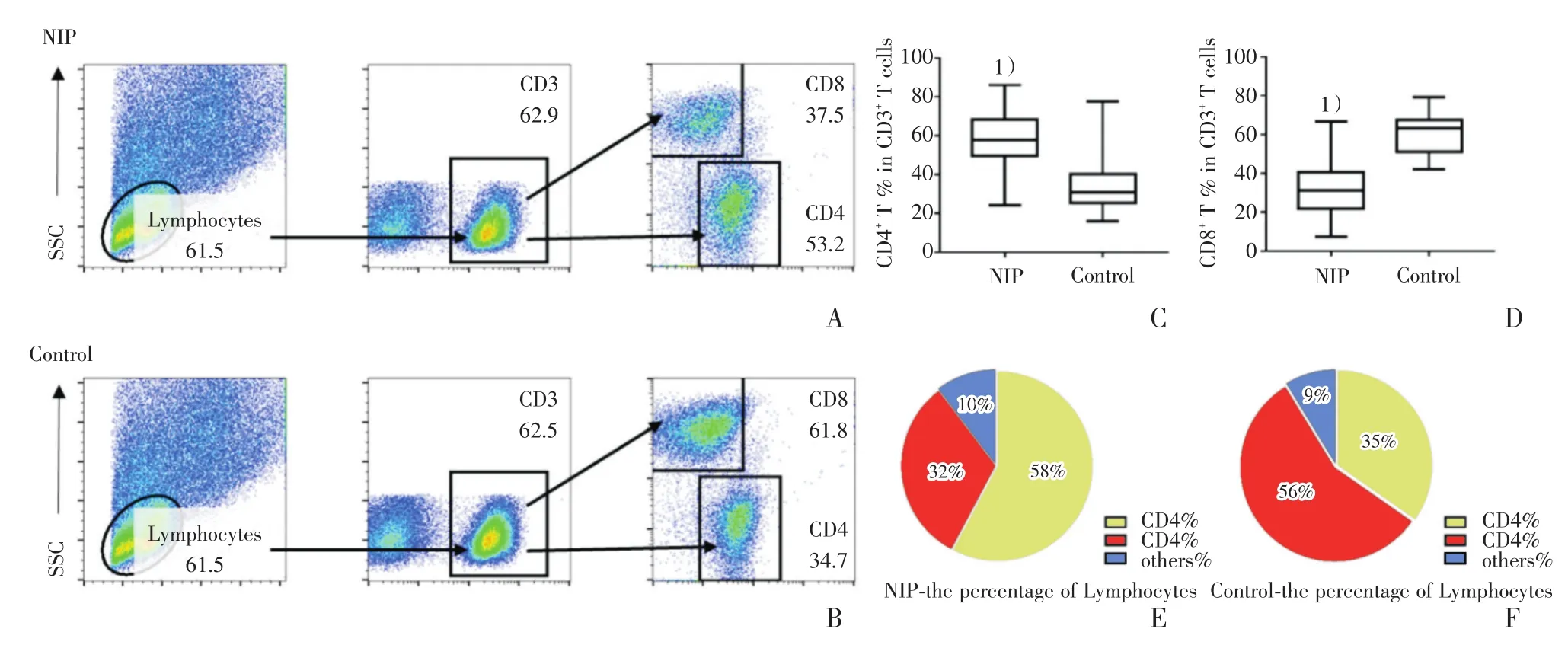
图2 NIP组与正常对照组织中T淋巴细胞表达情况及所占比例流式结果分析Fig.2 Expression and percentages of different T cells in nip and control samples by flow cytometry
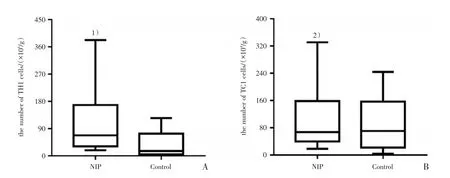
图3 NIP组与正常对照组中胞内因子IFN-γ表达情况流式结果分析Fig.3 The cellular source of IFN-γ in NIP and control samples by flow cytometry
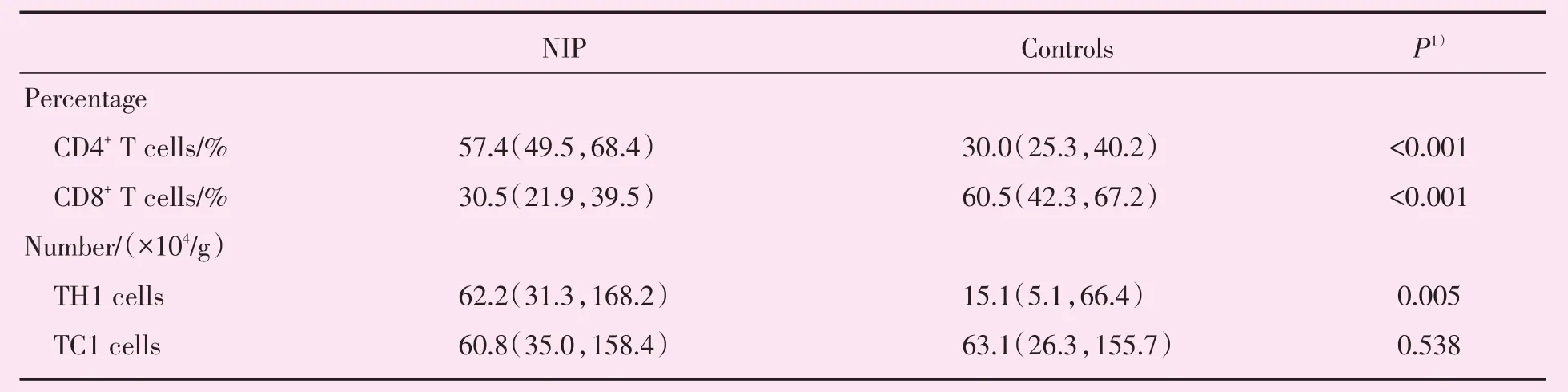
表2 NIP与正常对照组组织局部T淋巴细胞浸润程度分析Table 2 The analysis of T cells in NIP and controls
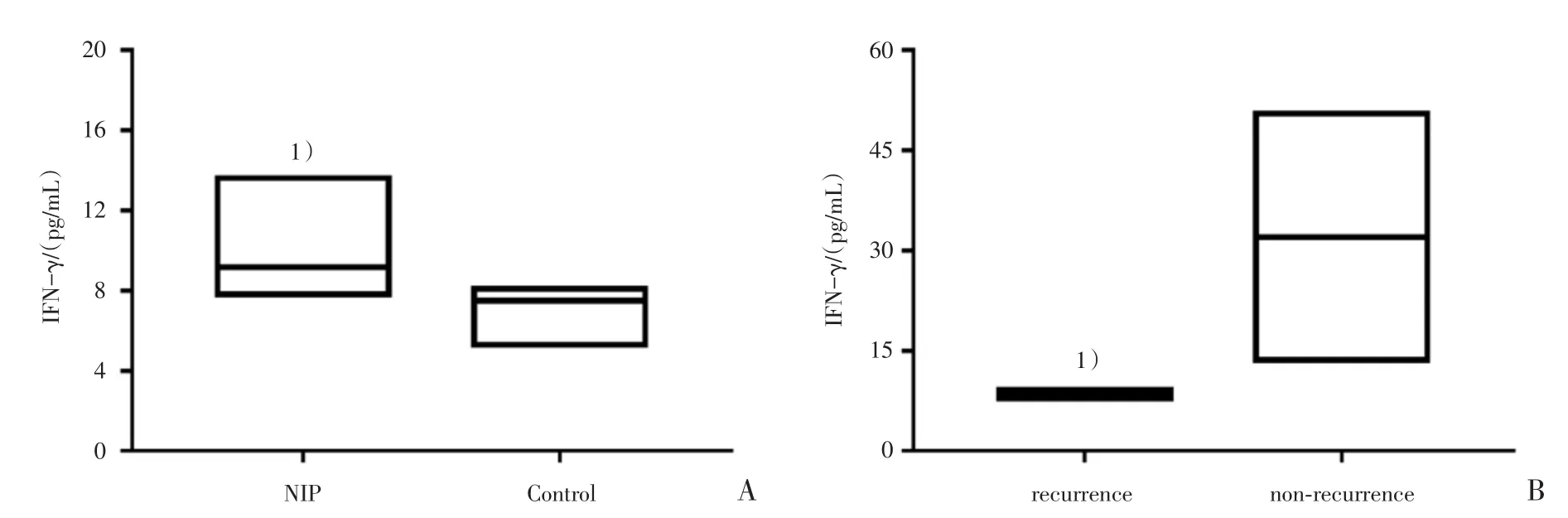
图4 NIP组与正常对照组组织中IFN-γ蛋白水平表达情况及NIP组内复发组与非复发组中IFN-γ蛋白水平表达情况Fig.4 Expression of IFN-γ protein level in NIP and control samples,recurrence and non-recurrence in NIP
2.4 肿瘤局部炎症细胞表达与临床病理特征相关性分析
取30例NIP组与16例正常对照组组织匀浆液,用luminex magpix检测匀浆液内IFN-γ表达水平提示,NIP组相对于正常对照组,IFN-γ呈现明显高表达;且NIP组内初发组相对于复发组,IFN-γ表达呈现明显高表达,差异有统计学意义(图4)。
在不同程度NIP临床病理特征(吸烟、伴发息肉、Krouse分级等)间比较肿瘤组织局部炎症细胞(嗜中性粒细胞、嗜酸性粒细胞、巨噬细胞、TH1细胞、TC1细胞)浸润程度,未发现明显差异性。
NIP组内Krouse分级与肿瘤复发特性相关性分析,未见明显相关性(χ2=1.438,P=0.230)。
3 讨论
NIP属于良性上皮来源性肿瘤,被覆为分化良好的柱状上皮或纤毛呼吸上皮,并伴有鳞状上皮化生;上皮不同程度向肿瘤基质层内翻性生长,同时保持基底膜完整[6]。NIP的发生发展过程受到诸多因素影响,主要包括:人乳头状瘤病毒感染、EB病毒感染、慢性炎症、吸烟饮酒等不良饮食习惯、环境污染等,目前该病主要致病原因及其发生发展机制暂不明确[7]。
国外学者通过对NIP与鼻窦局部炎症关系研究认为慢性炎症是NIP发生发展的重要影响因素[8-9]。国内外学者Suh、房高丽等学者发现NIP一般起源部位为鼻腔鼻窦慢性炎症常见发生部位,且鼻息肉与NIP常发生于相同部位,较少起源于鼻中隔或下鼻甲,普通鼻窦CT往往难以明确区分炎性鼻息肉与瘤体组织[9-11]。Yoon等[12]学者通过对96例NIP患者术后病理分析发现,21.9%肿瘤伴有同侧鼻息肉,且均伴有慢性鼻窦炎。在该病上皮与上皮下微结构研究中,Zhao[5]、Roh等[13]学者发现肿瘤局部有大量炎症细胞浸润,主要浸润细胞类型为中性粒细胞,且相对于鼻外翻型乳头状瘤与鼻嗜酸性乳头状瘤,NIP炎症细胞浸润更为明显,局部慢性炎症浸润也为后续HPV病毒感染创造了有利局部微环境。有学者在研究内翻性乳头状瘤复发相关因素中发现90%NIP附着处骨质存在不同程度的骨炎与病理性骨重塑,鼻腔鼻窦慢性炎症有助于肿瘤附近骨质破坏,从而加速肿瘤对周围组织结构的入侵[14]。
本研究通过对NIP组织进行染色分析,发现相对于正常对照组,嗜中性粒细胞、嗜酸性粒细胞、巨噬细胞及淋巴细胞均有明显高表达。该研究结果与之前Zhao等[5]学者在NIP中观察结论一致。然而,本研究对炎症细胞在肿瘤组织局部分布特征进行分析时发现,肿瘤组织不同区域主要浸润细胞类型不一致:上皮及上皮下近基底膜基质区域(远肿瘤根部区域)主要表现为嗜中性粒细胞浸润;远基底膜基质区域(近肿瘤根部区域)主要表现为淋巴细胞团块状浸润。该现象产生原因暂时不明,但提示NIP在不同发生发展阶段主要参与炎症反应类型不同。
本研究对NIP肿瘤组织内单核细胞进行流式染色分析,发现主要浸润淋巴细胞类型为CD4+T淋巴细胞(TH细胞)及CD8+T淋巴细胞(TC细胞)。在肿瘤组织中,最主要淋巴细胞类型为TH细胞,而在正常对照组中,最主要淋巴细胞类型为TC细胞。进一步对组织局部淋巴细胞分泌因子分析,发现TH细胞与TC细胞均可分泌γ-干扰素(IFN-γ),在NIP中,TH细胞为最主要IFN-γ因子细胞来源,且相对于正常对照组,TH1细胞(CD4+IFN-γ+T淋巴细胞)呈现明显高表达,而TC1细胞(CD8+IFN-γ+T淋巴细胞)未见明显变化。TH1淋巴细胞数目增多或功能亢进可导致局部炎症的慢性迁移及病理性损伤;IFN-γ高表达可活化巨噬细胞增强其吞噬病原体功能,同时可促进初始CD4+T细胞向TH1细胞分化,从而导致慢性炎症的持续进行[15]。TC1细胞主要作用在于清除细胞内病原体,TC1细胞通过释放颗粒酶、穿孔素等细胞毒性分子进入免疫突触,通过分泌IFN-γ、TNF-α等细胞因子杀死携带靶抗原的的细胞,从而加速对胞内病原体的先天性与适应性免疫反应[16]。肿瘤组织内TC1细胞相对于正常对照组未存在显著高表达,提示NIP组织局部以细胞毒性T细胞介导的粘膜炎症不是主要的炎症反应。
针对慢性炎症在NIP发生发展过程中参与的作用,目前主要有“炎症微环境”与“肿瘤占位”两类假说[9]。在“炎症微环境”理论中,慢性炎症微环境为组织内病毒感染与复制或微生物的入侵创造了有利的生存条件,病毒或微生物致癌基因的表达与炎症因子的分泌可参与异常肿瘤形成过程;“肿瘤占位”理论中,单侧的肿瘤占位性阻塞可导致鼻腔鼻窦引流不畅引起同侧粘膜炎症,产生的炎症介质同时作用于双侧鼻腔鼻窦,从而引起双侧慢性鼻窦炎的发生,该现象与本研究中单侧NIP患者往往伴有双侧鼻腔鼻窦炎症现象一致。
本研究也对NIP患者临床特征与组织病理学变化之间关系进行了分析探讨。NIP具有明显复发特性,以往研究报道复发率可达29.2%~62%[17-18]。本研究中,复发患者占38%,初发患者占62%。后期对局部组织匀浆上清液中IFN-γ蛋白表达水平进行检测发现,NIP组相对于正常对照组呈现明显高表达,NIP组内初发组相对于复发组呈现明显高表达,提示NIP的发生机制可能与局部IFN-γ表达有关,IFN-γ低表达可能与肿瘤复发特性有关。然而,其他临床病理特征(吸烟、饮酒、伴发息肉、Krouse分级等)与鼻内翻性乳头状瘤局部炎症细胞浸润程度无明显相关性,且肿瘤占位性阻塞程度特征(Krouse分级)与肿瘤复发特性未见明显相关性,该研究结果与之前新加坡学者Zhao等[5]研究结果相一致。鉴于本研究未收集复发患者初发标本,复发与初发组织均来源于不同个体,因此不能完全排除局部慢性炎症对该病其余临床病理特性的影响。Krouse分级系统是一种常见额CT分期系统,主要为临床医生在手术路径的选择与预后治疗提供相应指导。本研究暂未发现局部炎症细胞浸润程度与Koruse分级之间有明显相关性。
NIP致病原因及发生发展的具体机制仍不明确,本研究通过对肿瘤局部炎症细胞浸润程度与分布特征进行分析,为NIP致病原因中慢性炎症假说提供了一定的理论依据。然而,炎症细胞及因子在NIP发生发展过程中参与的具体调控机制仍需扩大样本量进行深入研究与探讨。

