染色体微阵列分析在持续性左上腔静脉胎儿中的临床应用
杜 柳,何 苗,王 晔,林少宾,林美芳,谢红宁
(中山大学附属第一医院1.超声医学科,2.妇产科,广东广州510080)
持续性左上腔静脉是最常见的体循环静脉系统异常,产前超声检出率约0.5%~1.1%[1]。研究显示持续性左上腔静脉与染色体异常相关性高,约13%合并染色体异常,最常见的是18-三体综合征及21-三体综合征[2]。我们的前期研究结果表明持续性左上腔静脉在染色体异常胎儿中的检出率是染色体正常胎儿的27.5倍[1]。近年来的研究认为持续性左上腔静脉胎儿合并的其他心内外畸形与染色体异常的相关性更高[2-3]。因此,建议当持续性左上腔静脉伴有其他心内外畸形时行侵入性产前诊断。传统的染色体G显带核型分析技术可以在产前检测胎儿染色体数目异常和大片段结构异常,但其分辨率较低,无法判断染色体上微小片段的缺失及重复异常,另外此技术需要培养细胞且结果分析依赖于检验人员的水平。染色体微阵列分析技术(chromosomal microarray analysis,CMA)能够在全基因组水平上进行扫描,可检测染色体不平衡畸变,包括染色体非整倍体、染色体微缺失或微重复,以及亚端粒或其他不平衡的染色体重排,具有更高的分辨率(达0.05 Mb),可检测到常规染色体核型分析无法检测的拷贝数变异(copy number variations,CNV),并且能够精确定位复杂易位及来源[4]。目前已应用于先天畸形的产前诊断以及胚胎发育的机制研究,相关研究表明在产前超声诊断先天性心脏病而染色体核型正常的胎儿中,应用CMA进行分子遗传学分析可进一步检出7%具有临床意义的微缺失或微重复综合征[5-6],但关于持续性左上腔静脉胎儿的相关研究尚未见报道。因此,本研究探讨CMA在持续性左上腔静脉胎儿、特别是染色体核型正常病例中的临床应用价值,并对CNV涉及的基因进行分析,为产前诊断及遗传学咨询提供重要的依据。
1 材料与方法
1.1 研究对象
2014年1月至2016年12月于中山大学附属第一医院行胎儿系统性超声筛查提示持续性左上腔静脉且在我院产前诊断中心进一步行常规染色体核型分析和CMA检测的病例纳入本研究。所有行侵入性产前诊断的病例均接受检测前的遗传咨询并签署知情同意书。本研究经医院伦理委员会审批。
1.2 超声检查仪器及方法
1.2.1 检查仪器 采用Voluson E6及Voluson E8(GE,Kretztechnik,Austria)三维彩色多普勒超声诊断仪,经腹部三维超声容积探头(4~8 MHz)。
1.2.2 检查方法 常规系统扫查胎儿全身及附属结构,根据胎儿双顶径、头围、腹围、股骨长度等生物测量指标结合停经史及早孕期超声检查结果判断孕周。观察胎儿头颅、胸腔、腹腔脏器及四肢结构,记录胎儿全身结构声像特征。对可疑胎儿心脏血管异常病例由2名具有5年以上产前超声诊断经验的专家针对胎儿心脏进行专项检查并做出诊断。胎儿心脏超声检查依据国际妇产科超声学会颁布的胎儿超声心动图操作指南进行专项检查[7]。
1.2.3 胎儿持续性左上腔静脉的超声诊断标准间接征象:四腔心切面显示左心房外侧壁近房室交界处可见一圆形无回声区,探头稍向心底侧偏转则可显示扩张的冠状静脉窦。直接征象:三血管-气管切面显示动脉导管的左侧可见一圆形的血管横切面。以此血管为中心旋转探头90°显示其长轴切面,通过冠状静脉窦引流入右心房。
1.3 侵入性产前诊断
1.3.1 标本的采集 依据孕周大小,在超声引导下行羊膜腔穿刺术(孕16~24周)抽取羊水30 mL或脐静脉穿刺术(孕>24周)抽取脐血3 mL。
1.3.2 染色体核型分析 对胎儿的标本进行常规细胞培养、制片、G显带,按照人类细胞遗传学国际命名体制(ISCN2009)标准进行G显带染色体核型分析诊断,显微镜下检查20个核型,分析3个核型,若出现嵌合体则检查50个或100个核型。
1.3.3 CMA检测 采用美国Affymetric公司提供的高分辨率全基因组CytoScan HD芯片。实验操作严格按照Affymetric公司提供的操作流程。该芯片不仅能检测基因组缺失、重复,还能检测杂合性缺失和单亲二倍体。
1.3.4 CNV的判断和评价 参照本实验室内部数据库及在线公开数据库,如DGV数据库、DEFCIPHER数据库、OMIM数据库等。拷贝数变异分为3种类型:致病性、良性和临床意义不明(variants of unknown significance,VOUS)[8]。
1.4 分组方法
根据是否合并其他超声软指标及结构异常,分为单纯组及合并异常组。合并的心内异常包括除外持续性左上腔静脉的其他心脏畸形、血管变异,心外异常包括各系统脏器的结构畸形及超声软指标异常。超声软指标包括枕后皮层增厚、鼻骨缺损或发育不良、侧脑室增宽、后颅窝池增宽、脉络膜丛囊肿、肠管回声增强、肾盂积液、单脐动脉、长骨短、髂骨翼角增宽等。
1.5 随访
所有病例根据孕妇及家属意愿选择继续妊娠、终止妊娠或选择性减胎。出生病例追踪其手术或其他影像学检查情况,存活者持续随访;引产病例追踪大体结构及病理结果。
1.6 统计学方法
应用SPSS 19.0软件包进行数据处理,符合正态分布的计量资料以均数±标准差表示,非正态分布的资料以中位数(P25~P75)表示,计数资料用频率及百分率表示。核型分析与CMA检测染色体异常的检出率差异、单纯组与合并异常组染色体异常的检出率差异、染色体正常组与异常组合并的各类心内外异常率的差异比较采用χ2检验或Fisher精确概率检验进行统计学分析,检验水准α=0.05,P<0.05差异有统计学意义。
2 结果
2.1 一般资料
2014年1月至2016年12月于中山大学附属第一医院行胎儿系统性超声筛查提示持续性左上腔静脉胎儿201例,其中81例行进一步侵入性产前诊断(常规染色体核型分析和CMA检测)的病例纳入研究。孕妇的中位年龄为29(27~35)岁,年龄最小值、最大值分别为20岁、43岁;产前诊断的中位孕周为24(21~27)周,孕周最小值、最大值分别为17、33周。
2.2 核型分析与CMA检测结果的比较
常规核型分析检出15例(18.5%,15/81)染色体核型异常,包括5例21-三体综合征,1例18-三体综合征,1例13-三体综合征,1例45X[34]/47XXX[16],7例其他染色体异常。66例(81.5%,66/81)染色体核型正常。核型异常胎儿的超声特征见表1。
在15例核型异常病例中,CMA检测结果与核型分析结果一致,并精确定位了染色体缺失/重复的位点。而在66例核型正常病例中,CMA额外检出4例(6.1%,4/66)含致病性CNV,4例(6.1%,4/66)含VOUS。CNV的片段大小从155 kb到9.09 Mb不等(表2)。CMA共检出19例(23.5%,19/81)含致病性CNV,两种检测方法染色体异常的检出率比较,差异无统计学意义(18.5%vs.23.5%,P=0.44)。
2.3 单纯组和合并异常组病例染色体核型和CMA研究
81例胎儿中,12例(14.8%,12/81)为单纯组病例,69例(85.2%,69/81)为合并异常组病例,其中8例(9.9%,8/81)合并其他心脏异常,29例(35.8%,29/81)合并心外异常,32例(39.5%,32/81)合并其他心脏及心外异常。
单纯组中仅1例染色体异常(47,XX,del(18)(p11.2),+mar),检出率为8.3%(1/12);合并异常组中染色体异常的检出率为26.1%(18/69),其中14例核型分析及CMA检测结果均异常,4例(7.5%,4/53)仅CMA检出致病性CNV。两组间染色体异常的检出率差异无统计学意义(26.1%vs.8.3%,P=0.277)。
合并异常组中,心内异常以室间隔缺损为主,心外异常以超声软指标异常为主。房室间隔缺损、颜面部畸形和多发超声软指标异常在染色体异常胎儿中的检出率显著高于染色体正常胎儿(P=0.030,P=0.012,P=0.014,表3)。
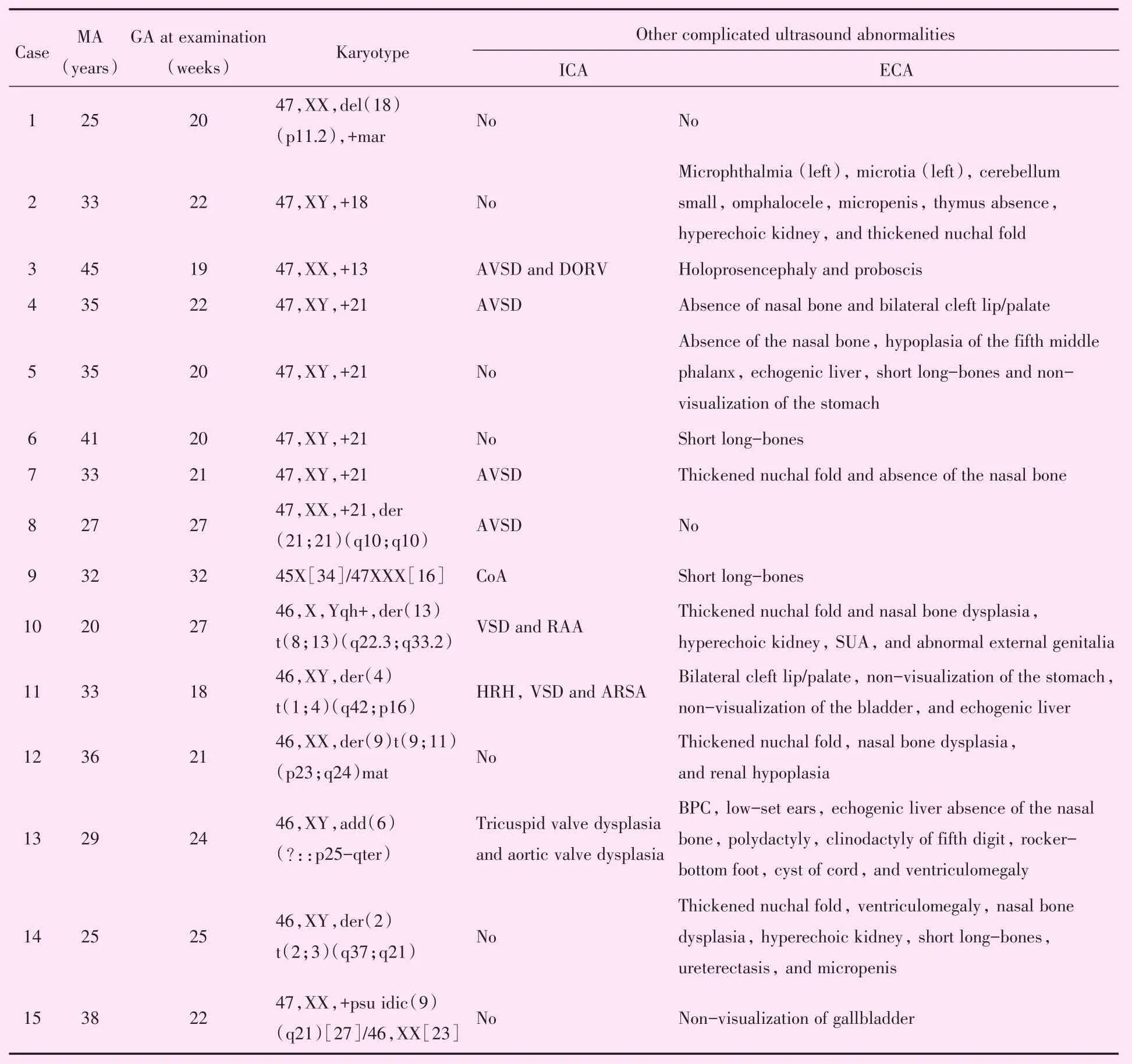
表1 15例染色体核型异常胎儿合并心内心外异常的超声表现Table 1 Characteristics of 15 PLSVC fetuses with abnormal karyotypes
2.4 妊娠结局及随访情况
81例胎儿中,4例失访(4.9%,4/81);2例(2.4%,2/81)胎死宫内;34例(42.0%,34/81)终止妊娠,其中染色体异常者18例,合并结构畸形16例;41例(50.6%,41/81)出生,其中2例婴幼儿因合并畸形死亡,余均存活至今未见明显不良预后。
3 讨论
3.1 持续性左上腔静脉胎儿与染色体核型异常
持续性左上腔静脉与染色体异常有相关性,约13%的持续性左上腔静脉胎儿合并染色体核型异常[2-3]。本研究染色体核型异常的检出率为18.5%,最常见的是21-三体综合征。较之前报道的检出率高,其主要原因可能是本中心在前期研究的基础上,常规推荐超声检出合并其他结构畸形或血清学筛查高风险的高危人群行进一步侵入性产前诊断,导致本研究的单纯组病例以及低危人群所占比例较低。然而,传统的染色体核型分析仅可检出染色体非整倍体异常及大片的的染色体结果异常。染色体微阵列分析技术能够在全基因组水平上进行扫描,具有更高的分辨率(达0.05Mb),可检测到常规染色体核型分析无法检测的拷贝数变异,提高临床相关微缺失或微重复综合征的检出率,有助于揭示部分先天性畸形的遗传性病因[4]。
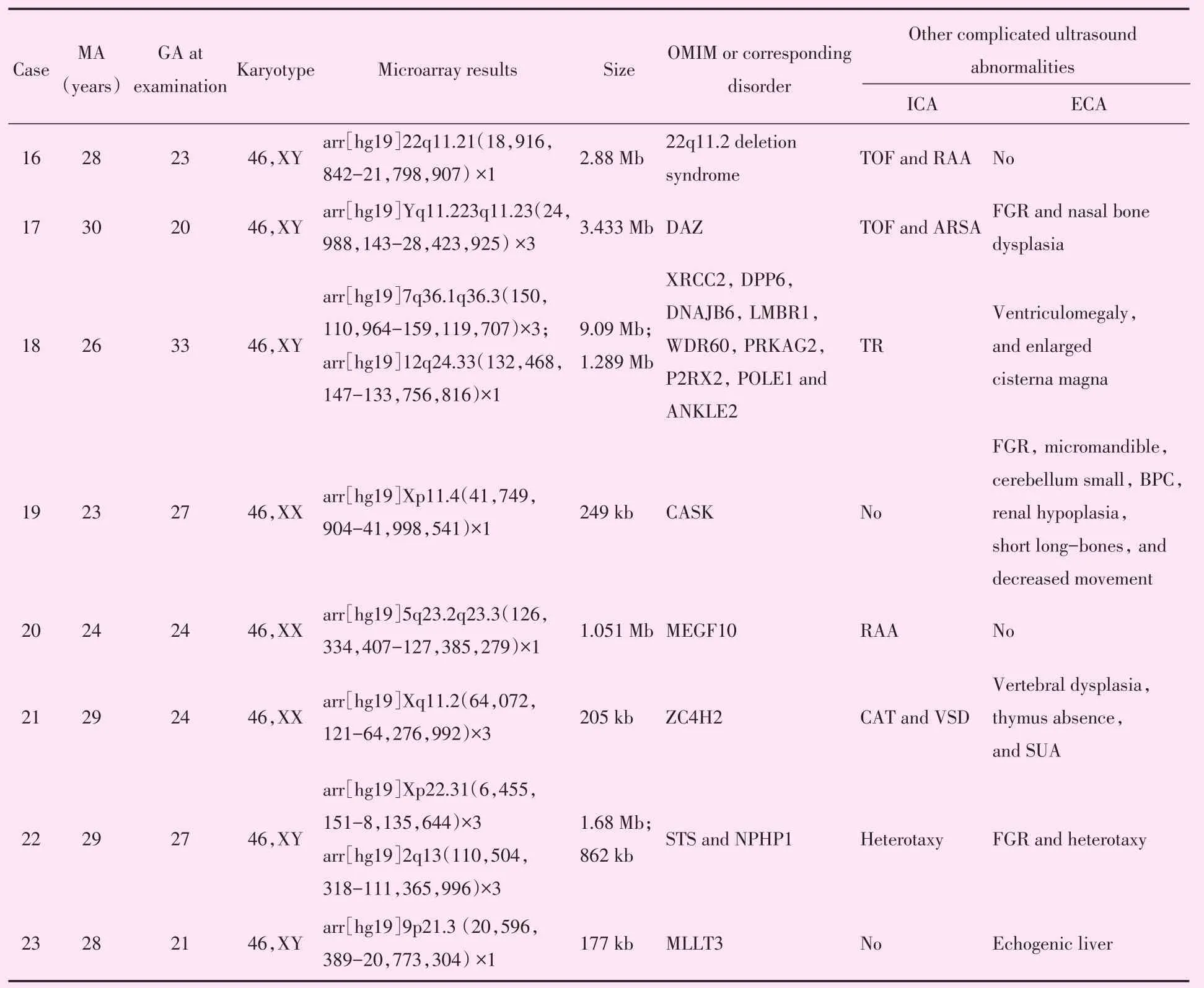
表2 含致病性CNV(例16-19)及VOUS(例20-23)胎儿CMA结果及超声特征Table 2 Characteristics of PLSVC fetuses with pathogenic CNV(cases 16-19)or VOUS(cases 20-23)detected by CMA among the 52 fetuses with normal karyotypes
3.2 持续性左上腔静脉胎儿与拷贝数变异
近年来CMA逐渐应用于先天畸形的产前诊断,研究显示在超声检出结构畸形且染色体核型正常的胎儿中,CMA可进一步检出6-16%具有临床意义的染色体微缺失或微重复综合征[4,6]。Donnelly等[9]对产前超声诊断结构畸形的胎儿进行分类研究,同样证实CMA较传统核型分析显著增加了染色体异常的检出率,且先天畸形的种类以心脏畸形为主(15.6%)。美国妇产科医师指南(ACOG)指出,当超声发现胎儿一个或多个结构异常时,建议产前诊断行CMA检测,以替代常规染色体核型分析[10]。一项系统综述显示CMA在核型正常的先心病胎儿中额外检出染色体异常率为7.0%,在单纯组病例中额外检出率为3.4%[5]。然而,目前仅有一篇病例报道一例持续性左上腔静脉并双侧多囊肾发育不良的胎儿行传统核型分析未见异常,CMA进一步检测出17q12区域的1.93 Mb缺失,可能由于该区域涉及HNF1B基因通过与CREBBP相互作用而影响心脏结构的表型异常[11]。本研究首次探讨CMA在持续性左上腔静脉胎儿中的临床应用,并分析了持续性左上腔静脉胎儿中致病性CNV与产前超声表现的关系。
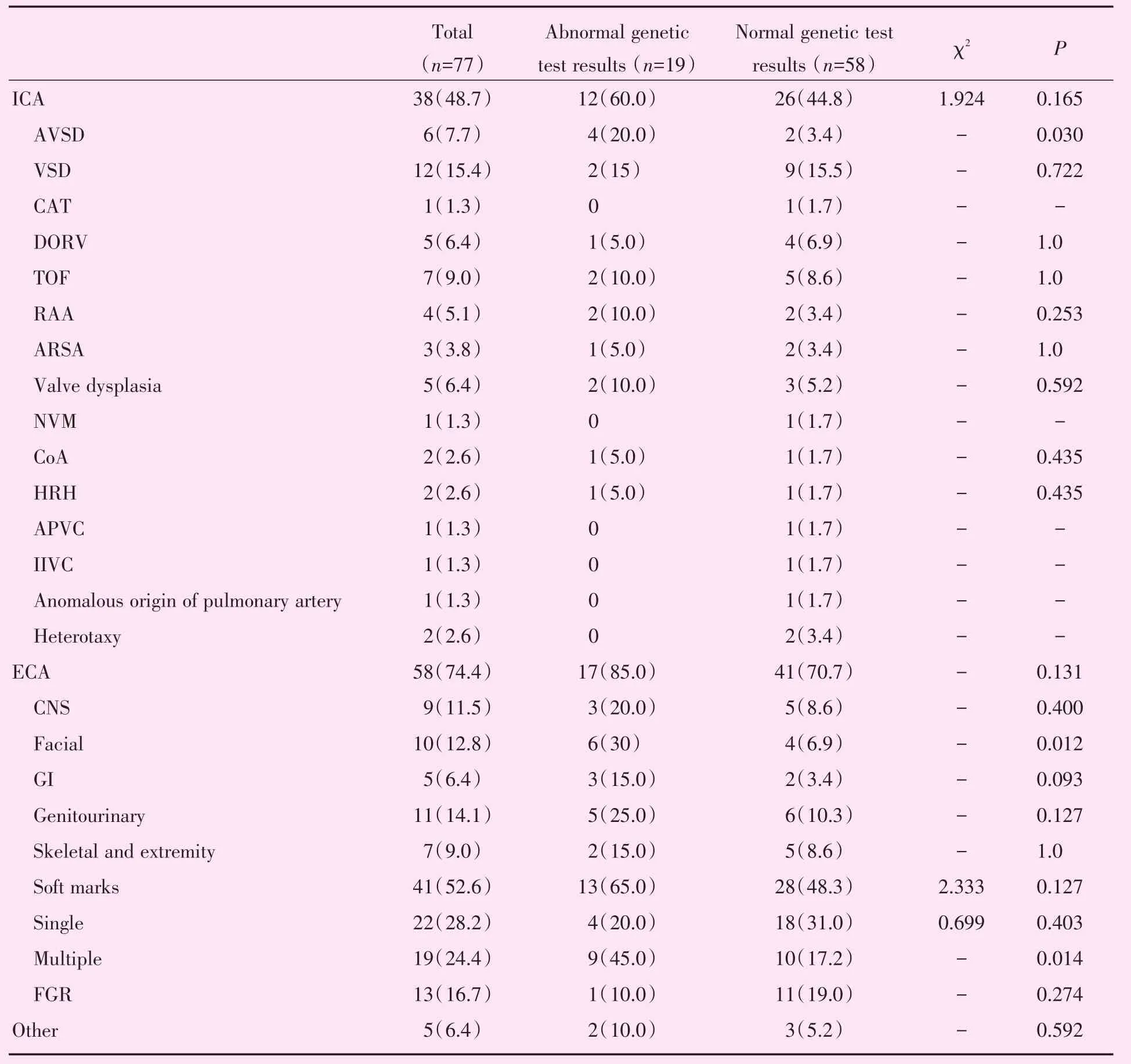
表3 染色体异常(核型异常及含致病性CNV)与染色体正常胎儿合并心内外异常的情况Table 3 The numbers and types of intracardiac and extracardiac sonographic anomalies among PLSVC fetuses with abnormal genetic test results(abnormal karyotypes or normal karyotypes with pathogenic CNV)and normal genetic test results [n(%)]
本研究显示CMA在核型正常的持续性左上腔静脉胎儿中可进一步检出4例(6.1%)致病性CNV,将染色体异常的总体检出率提高至23.5%。1例22q11.2微缺失综合征(例16),其中法洛四联症及右位主动脉弓与22q11.2缺失综合征的相关性已有报道,但持续性左上腔静脉与22q11.2缺失综合征的相关性尚未见报道[12-13]。1例(例17)在Yq11.223q11.23区域检出3.433 MB重复,该区域涉及DAZ基因。DEFCIPHER数据库中有该重复区域的病例报道。这些病例表现出多种表型,包括特殊面容、智力低下和上呼吸道异常,但未见与先天性心脏病相关的文献报道。1例(例18)检出2个致病性CNV:7q361q33.3区域检出9.09Mb重复,12q24.33区域检出1.289 Mb缺失。该微重复与微缺失与已知的综合征无关,但包含许多基因,如 XRCC2、DPP6、DNAJB6、LMBR1、WDR60、PRKAG2、P2RX2、POLE1和 ANKLE2。由于涉及的染色体片段较大,不能排除染色体疾病的一般临床表现,包括先天性畸形、智力低下和生长迟缓。1例(例19)Xp11.4区域检出249 kb缺失,该区域涉及CASK基因。CASK基因功能缺失突变或缺失/重复的表型类似,包括中至重度精神运动发育不良、低血压、言语及行动缺乏[14]。另外还有一些特征性的结构畸形,包括严重的小头畸形伴有脑桥和小脑发育不良,宽鼻桥,大耳朵,长人中,小下颌,眼距过宽[14]。该病例的产前超声表型与相关报道的临床表型较一致,但持续性左上腔静脉与该基因的关系尚未见报道。
3.3 合并异常组与染色体异常的关系
此外,染色体核型的相关研究发现单纯性持续性左上腔静脉胎儿中核型异常的检出率较低,大多数染色体核型异常病例常合并其他心脏和/或心外畸形[3]。但此研究结果并不表明不建议单纯组病例行侵入性产前诊断,特别是随着微阵列分析技术的快速发展。目前仅有个例报道表明在持续性左上腔静脉胎儿合并其他结构畸形时CMA可进一步检出染色体异常,单纯组病例中CMA是否有临床应用价值尚无相关报道[2]。本研究将病例分为两组,进一步比较单纯组与合并异常组中染色体异常的检出率差异。研究结果显示合并异常组与单纯组染色体异常的检出率差异无明显统计学意义,但CMA仅在合并异常组中发现核型分析未检出的致病性CNV。另外,在合并异常组中,心内异常以室间隔缺损为主,心外异常以超声软指标异常为主。房室间隔缺损、颜面部畸形和多发超声软指标异常在染色体异常胎儿中的检出率显著高于染色体正常胎儿。
综上所述,CMA在持续性左上腔静脉胎儿中具有一定临床应用价值,特别是产前超声检出合并其他结构异常时,CMA可检测出常规核型分析难以检出的微缺失和微重复综合征,提高染色体异常的检出率,并可在染色体上进行精确定位,为产前遗传学咨询提供重要依据。但由于基因的不完全外显性、印迹基因或修饰剂的作用、隐性基因突变和位置效应等复杂机制,仍难以明确部分CNV或候选基因与临床表型的相关性。

