LI-RADS v2018 MR 辅助征象对肝细胞癌的诊断价值研究
任阿红, 杨大为, 徐辉, 王振常, 杨正汉
材料与方法
1.一般资料
回顾性分析2009年1月-2018年12月期间在北京友谊医院放射科接受肝脏增强MRI扫描、具有肝癌高危因素并怀疑肝脏病变患者的临床、影像学、病理和随访资料。入组标准:①具有肝细胞癌高危因素;②采用细胞外对比剂行腹部增强MRI检查且有肝内局灶性病变;③经肝脏穿刺活检、局部切除或肝移植手术获得肝内病灶的病理诊断;④未获得肝内病灶病理结果者,随访时间至少2年。 排除标准:①MRI检查不满足LI-RADS流程的技术要求;②肝内病灶数目>3个。本研究中对肝内病灶未取得病理学诊断的患者,肝细胞癌的诊断标准为对患者的影像随访证实病变有实质性增长,同时伴有动脉期高强化和廓清或包膜强化[8]。对分类为LR-1、LR-2和LR-3的肝内病灶,其诊断标准依靠典型的影像学表现或在随访期间病变未进展为 LR-4类及以上分类而确定[3]。
2.肝脏MRI检查方法
所有病例在1.5T(GE Signa HDxt)或3.0T(GE Discovery 750W、Simens Prisma和Philips Ingenia)MR 扫描仪上完成,采用8通道或16通道体部相控阵线圈。检查前病人空腹4小时以上,采用仰卧位、头先进。常规扫描序列包括定位相、横轴面和冠状面T2WI、同反相位横轴面T1WI及屏气动态增强T1WI。增强扫描采用马根维显注射液经手背静脉由高压注射器推注,剂量0.1 mmol/kg,注射流率2.0 mL/s。在预扫描后,采用LAVA、VIBE或e-THRIVE序列行肝脏动态增强扫描,分别在注射对比剂后25~35 s、60~70 s、3~5 min及6~8 min时分别进行动脉双期、门静脉期、平衡期和延迟期成像。
3.MR图像判读
所有MR图像由3位分别具有10年、9年及5年腹部影像诊断经验、熟悉 LI-RADS v2018的医师根据2018版LI-RADS CT/MRI标准共同阅片并获得一致意见。主要征象包括病灶大小、动脉期非边缘高强化、非周边廓清、包膜强化和超阈值生长。辅助征象包括倾向HCC(ancillary features favoring HCC in particular,AFHCC)、倾向恶性的非HCC特异性征象(ancillary features favoring malignancy but not HCC specific,AFMNH)和倾向良性的征象三类[7]。首先,仅采用主要征象对病变进行LR分类(A法);然后,间隔一个月后采用主要征象联合辅助征象对病变再次进行LR分类(B法)。当LR分类不确定时,可以采用破局原则给出最后的LR分类。破局原则是当不能确定是否有静脉内肿瘤,视作阴性;当LR类别较低时,分类就高不就低;LR类别较高时,分类就低不就高;当LR-3与LR-M不确定时,分到LR-3;当LR-4/5与LR-M不确定,分到LR-M。对于之前有CT或MRI检查的患者,参考之前的检查来判断病变有无超阈值生长或次阈值生长。本研究中,对超声平扫上明确可见与MRI对应的结节这一辅助征象未做评价,因部分患者未在我院行肝脏超声检查。采用主要征象联合辅助征象进行判读时,辅助征象可用于LR分类的调整:当病变出现≥1个倾向恶性或HCC的辅助征象时,LR分类可上调1类,最高不超过LR-4;当病变出现≥1个倾向良性的辅助征象时,LR分类可下调1类;而当倾向良性和恶性/HCC 的辅助征象同时出现时,LR分类不做调整[3]。
4.统计分析
所有的统计分析均在SPSS 23.0统计软件中完成。所有的计量资料都以均数±标准差表示,计数资料以计数和百分比表示。分别计算和比较仅采用主要征象或主要征象联合辅助征象对肝内异常发现的诊断敏感度、特异度、符合率、阳性预测值(PPV)、阴性预测值(NPV)、阳性似然比(positive likelihood ratio,PLR)和约登指数,对肝细胞癌的诊断标准分别以LR-5类或 LR-4+LR-5类为阳性。采用 McNemar检验分析A、B两种判读方法对肝细胞癌的诊断效能有无统计学差异。采用Fisher精确概率法计算各辅助征象的诊断比值比(diagnostic odds ratios,DOR),比较各个辅助征象与HCC的相关性。

表1 基于LR-5或LR-4+LR-5 HCC诊断标准两者判读方法对肝内病变的诊断效能指标值
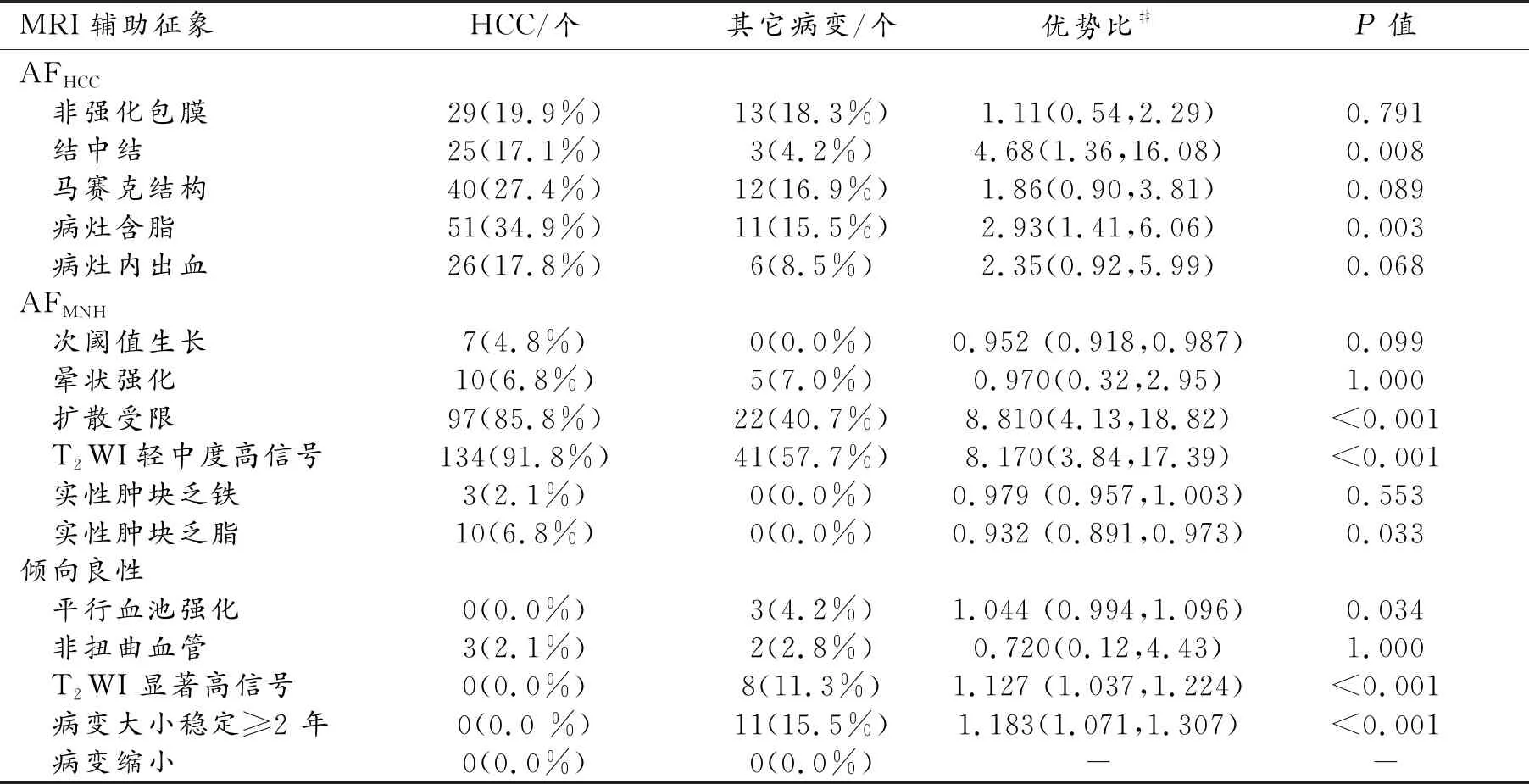
表2 MRI辅助征象在肝内病变中的出现情况及组间比较
结 果
1.病例特征
超高层综合体项目用水点多、系统复杂,且各功能的计量核算及日后管理都需考虑到位。如何在满足规范要求的情况下简洁、合理地设计此类项目的给水、热水系统,具有十分重要的现实意义。
本研究中最终纳入181例患者共217个肝内病灶,其中HCC 146个、非HCC的其它恶性肿瘤16个(包括肝内胆管细胞癌13个、肝细胞-胆管细胞混合癌3个)和良性病变55个(包括不典型增生结节25个、血管瘤8个、局灶性灌注异常6个、肝硬化结节10个和囊肿6个)。150例为单发病灶,26例患者有2个肝内病灶,5例患者有3个肝内病灶。71.9%(105/146)的HCC病灶经肝脏穿刺活检、局部切除或肝移植手术后病理证实,其它肝癌病灶经影像学随访证实;16个其它恶性肿瘤经肝穿刺活检或手术切除后病理证实;良性病变中,7个(28%)不典型增生结节(dysplasia nodule,DN)经肝穿刺活检证实,其余病变经典型影像表现和随访影像证实。
2.LR分类和诊断效能
采用A、B两种判读方法对肝内病变的诊断效能指标值见表1。当以LR-5为标准诊断HCC时,McNemar配对卡方检验结果显示采用主要征象联合辅助征象对HCC的诊断效能与仅采用主要征象时无明显差异(χ2=0.500,P=0.500>0.05)。而当以LR-4+LR-5为标准诊断HCC时,采用主要征象联合辅助征象对HCC的诊断敏感度、特异度、阳性预测值、阴性预测值和符合率均高于仅采用主要征象,约登指数从0.62提高至0.71,McNemar配对卡方检验结果显示两种方法对HCC的诊断效能的差异有统计学意义(χ2=5.882,P=0.013)。
3.辅助征象与 HCC 的相关性
LI-RADS中辅助征象在肝内病变中的显示情况及组间(HCC组与非HCC组)比较结果见表2。在HCC病例中,有33 例缺乏DWI序列;而非HCC的其它病变中,有17例缺乏DWI序列。本研究结果显示:在倾向HCC的辅助征象中,结中结和病灶内含脂征象在HCC中更常见;其中结中结与HCC的相关性更强(DOR 4.68;95% CI:1.36~16.08),而病灶含脂与HCC的相关性次之(DOR 2.93;95% CI:1.41~6.06)。在倾向恶性而非HCC特异的辅助征象中,扩散受限、T2WI轻中度高信号在HCC中更常见;其中扩散受限与HCC的相关性最强(DOR 8.81;95% CI:4.13~18.82),而T2WI轻中度高信号与HCC的相关性次之(DOR 8.17;95% CI:3.84~17.39)。应用辅助征象后,仅有 6% (13/217)的病灶出现 LR 分类调整(表3),全部为仅采用主要征象时分类为LR-3的病灶,其中6个病灶的分类降为LR-2,7个病灶的分类升为 LR-4(图 1)。

图1 患者,女,77岁,丙型肝炎型肝硬化,应用辅助征象后,病变分类从LR-3 类上调到LR-4类。 a) 动脉晚期增强图像显示肝S8内可见显著强化的结节(箭),最大径为10mm; b) 门脉期增强图像显示结节(箭)未见廓清表现或包膜强化,仅依据主要征象病变为LR-3类; c) 在b=800mm2/s DWI上可见病变扩散受限(箭); d) 同相位图像上病变呈等信号; e) 反相位图像上病变信号明显减低(箭),提示含脂质; f) T2WI上病灶呈轻度~中度高信号(箭)。结合辅助征象,病变分类上调到LR-4类,术后病理证实为中~低分化 HCC。

表3 LR 分类调整病例的征象分析
讨 论
本组研究结果显示,当以LR-4+LR-5分类标准作为HCC的诊断标准时,采用主要征象联合辅助征象对HCC的诊断敏感度、特异度、阳性预测值、阴性预测值及符合率较仅采用主要征象时均有所提高;而当以LR-5分类标准作为的诊断标准时,采用主要征象联合辅助征象对HCC的诊断效能与仅采用主要征象时的差异无统计学意义(P>0.05)。在倾向于HCC的辅助征象中,结中结和病灶含脂与HCC的相关性最强;在倾向于恶性而非HCC特异的辅助征象中,DWI上扩散受限和T2WI上轻~中度高信号这两个征象与HCC的相关性最强。
LI-RADS采用主要征象对肝内病变进行分类以反映病变为HCC的可能性。与其它影像报告及数据系统不同的是,辅助征象的提出为 LI-RADS所独有。MRI上可见的辅助征象共分为三大类21个,分别是HCC特异的辅助征象、倾向于恶性但非HCC特异的辅助征象以及倾向于良性的辅助征象[3]。为降低LI-RADS的复杂性,是否采用辅助征象可由影像医师根据自身的经验来决定,仅用于调整LR-1、LR-2、LR-3、LR-4 或LR-5类病变,一方面可以增加对病变的诊断信心,另一方面也可以提高对病变的检出[9-10]。辅助征象不能用于调整病变的LR-M或LR-TIV分类,但如果出现与之矛盾的辅助征象时,可质疑LR-M或LR-TIV分类的准确性,此时需要对病变重新进行评估[9]。然而,关于单一辅助征象或多个辅助征象联合对HCC的诊断价值或将辅助征象与主要征象联合对LR分类的影响及其对病变检出的影响尚有待深入研究[6]。
Gaetano等[11]应用主要征象联合辅助征象鉴别≤2cm的HCC与DN,其研究结果表明,虽然辅助征象联合主要征象对小HCC的无创性诊断价值有限,但应用辅助征象仍可使25.6%的病变分类进行了调整,主要以LR-3类升到LR-4类为主,将低、高级别DN分类到LR-4类,从而可能改变这些患者的处理策略。Cerny等[12]报道应用LI-RADS v2014中的辅助征象使得15.3%的病变分类进行了调整,增加了诊断HCC的敏感度且保留了高特异度,该研究结果与我们的结果基本一致。Joo等[13]报道应用辅助征象使18.1%的病变分类进行了调整,均为LR-3类上升到LR-4类。文献报道,应用辅助征象使得20.5%~97.1%的LR-3类肝内病变的分类上调至LR-4类,本研究中22.5%(7/31)的LR-3类肝内病变的分类上调至LR-4类。
在MRI上可见的诸多辅助征象中,各个辅助征象对诊断HCC的权重和价值尚未知。Kang等[14]报道在 HCC特异性的辅助征象中,非强化包膜、结中结和马赛克结构仅在HCC病例中出现,其中马赛克结构与HCC的相关性最强;在倾向于恶性非HCC特异的辅助征象中,肝胆期低信号与HCC的相关性最强,其次为扩散受限。该结果与本研究结果有一定的一致性,也存在部分差异,考虑原因可能是由于不同的研究中所纳入病变的构成不同所致,而且该研究中采用的是肝细胞特异性对比剂,而本研究中采用的是细胞外对比剂。据文献报道,结中结可见于2%~36%的HCC病灶中,其生物学基础是大结节通常表现出癌前结节或早期HCC的特征,而其内的小结节通常表现为进展期HCC的特征,因此结中结与HCC的相关性较强[9,15]。将扩散受限与MRI增强扫描联合应用可提高诊断HCC的符合率,以病理诊断为金标准时,动脉期高强化及廓清联合扩散受限可使诊断HCC的敏感度从60%~62%提高到70%~80%。而且HCC的组织学分级越高时,扩散受限越明显。当乏血供的肝内结节表现为扩散受限时,更容易向富血供的HCC转化(风险比=7.4,95% CI:4.3~12.9)[9,16]。
本研究存在一定局限性:①为单中心研究,入组病例的样本量有限,可能会对结果产生影响。②本研究中由3位熟悉LI-RADS v2018的影像医师共同阅片并取得一致意见,而未进行观察者间的一致性比较。本院影像中心自2015年10月后开始在日常报告工作中规范使用LI-RADS v2014,参与本研究的医生也均及时掌握LI-RADS v2018的更新内容。杜婧等[17]报道本院影像中心2位阅片者对LI-RADS v2018的分类结果和征象识别的一致性为中等~好(对LR分类的一致性,Kappa=0.71;对恶性辅助征象识别的一致性,Kappa=0.46~1.00)。笔者也曾对参与本研究的3位医师应用LI-RADS v2017和v2018对肝脏局灶性病变进行分类的一致性研究,结果表明一致性较好[18]。③本研究为回顾性研究,在选择研究对象时难以避免可能存在的选择性偏倚。
总之,在HCC高危患者的MRI 诊断中,应用 LI-RADS v2018中的主要征象联合辅助征象有助于提高 对HCC的诊断效能。在倾向于HCC的辅助征象中,结中结和病灶含脂与HCC的相关性最强;在倾向恶性而非HCC特异的辅助征象中,扩散受限、T2WI上轻~中度高信号与HCC的相关性最强。在 MR图像判读时准确识别这些辅助征象,将有助于更准确地对肝内病灶进行LR分类从而提高 对HCC的诊断效能。

