肠内营养在肝硬化治疗中的应用
张同悦,茹清静
1.浙江中医药大学第二临床医学院,浙江杭州 310051;2.浙江中医药大学附属第二医院,浙江杭州 310005
肝硬化是慢性肝病的一个重要阶段,以肝细胞坏死、再生、纤维化,肝内血管和微循环广泛改变和破坏为特征,预后较差。严重肝细胞功能障碍影响肝脏多种合成、储存和分解功能,伴发的特征之一是营养不良。营养不良在肝硬化患者中发病率很高,且与疾病的严重程度相关。有研究报道Child-Pugh A、B、C级肝硬化患者营养不良发生率分别为44.5%、73.3%和94.4%[1]。营养不良会进一步恶化疾病,增加并发症发生率和住院死亡率。但营养不良是潜在可逆的,早期治疗有更好的总体预后。因而及时评估、尽早干预肝硬化患者的营养问题具有重要意义。该文归纳梳理了近年肠内营养在肝硬化治疗的应用情况,现陈述如下。
1 肝硬化营养不良与肠内营养
肝硬化患者发生营养不良是多因素导致的,如摄入不足、消化吸收不良、宏量营养素的代谢改变和加速代谢等[2]。复杂的基础代谢特征包括肝硬化糖异生增加、糖原贮存减少,蛋白质合成减少、支链氨基酸(Branched Chain Amino Acid,BCAA)/芳香族氨基酸或BCCA/酪氨酸的比率降低和禁食期间脂肪代谢紊乱等。这与肝硬化患者发生糖耐量降低、血糖水平异常、肌肉减少症、肝性脑病等都有密切的关系[3]。肠道微生态的改变也可能有一定作用。肝硬化患者常存在肠道菌群紊乱、细菌异位和代谢失衡。这些变化可能通过改变饮食能量产出,肠道通透性,调节胆碱、胆汁酸、脂类代谢等途径导致肝损伤、炎症和(或)纤维化,促进肝硬化和肝性脑病的发生发展[4]。
肠内营养是指通过消化道给予较全面的营养物质。在耐受性和胃肠功能允许的条件下,需要营养支持治疗的患者应首选肠内营养已得到共识。当肝硬化患者无法用日常进食满足热量需求,采用肠内营养进行补充,能够减少自身脂肪和蛋白质的分解,同时能维持肠道的功能和稳定肠道微生态,提升肌肉功能和质量,对改善预后有一定帮助。
2 新型肠内营养制剂
肠内营养制剂根据组成可分为非要素型、要素型、疾病专用型和组件型。特殊医学用途配方食品 (Food for Special Medical Purposes,FSMP)是一种新型的肠内营养制剂,临床需求大,各国标准不一。肠内营养制剂以往在我国属于药品,在分类上没有全国统一的标准,给产品研发和临床应用带来很多不便[5]。2016年新出台的食品安全法在法律上明确了FSMP属于“特殊食品”,这将改变它在临床应用中的地位。FSMP主要分为三类:全营养配方、特定全营养配方和非全营养配方食品。它在精准医学营养中可能会有重大作用,能帮助临床医生更好地进行肠内营养。
3 营养筛查与评定
在实施肠内营养干预之前,应先确定患者是否有营养不良或存在风险,识别可能从中获益者。这是按个体制定营养支持计划的前提,却也常常被忽视。评估主要包括营养筛查和营养评定等步骤[6-8],但各个指南对其定义和工具尚未有较统一的意见。
4 营养筛查
营养筛查的目的是筛选出有适应证的患者和判断下一步是否进行营养评定或者直接拟定营养支持计划。关于“营养风险”的含义,是“发生营养不良的风险”还是“营养因素导致不利结局的风险”,各国指南意见不同,从而导致对工具分类亦不同[6-8]。根据我国CSPEN指南(2008),营养筛查可以分为营养风险(出现不利结局的风险)筛查和营养不良筛查。前者的工具为营养风险筛查2002(Nutritional Risk Screening 2002,NRS 2002);后者的工具如通用筛查工具、微型营养评定法等。尽管现在没有金标准,NRS2002是首选并得到各指南的推荐,有大量有效证据为基础[7]。
鉴于肝硬化与营养不良的发病密切相关,肝硬化住院患者均应进行营养筛查。营养筛查应在就诊24~48 h内进行,这与缩短住院时间、降低感染率和减少总体死亡率相关[8-11],特别是营养风险高的患者是最可能从早期肠内营养获益的群体[8]。
营养评定:迄今尚未有一个较完美的营养评定工具。评定可从人体测量、身体成分、功能评估、生化学指标和综合评价等几方面进行。各种评价工具均有其优缺点(详见表1)。肝硬化患者肝脏的功能下降与外周水肿、腹水成为干扰指标准确性的重要因素。尤其是面对肝脏在代谢营养物质上的重要作用,辨明营养状况与肝功能下降在测量结果中的比例对临床医生来说是很大的挑战。主观全球评估、手握力测试、人体质量指数和中臂肌肉周长等可以作为临床实用的评定项目[12,13]。值得指出的是,各指南都推荐进行肌肉质量评估[8,12,14]。因为肌肉量的减少是客观可测量的,并且是与死亡率相关最常见的营养变量[13]。临床上应根据患者的具体情况,多学科综合评定患者的营养状况。
5 肠内营养
5.1 摄入时间
肝硬化患者应减少禁食时间,通过少食多餐和晚间加餐来对抗禁食时的高分解代谢状态。富含碳水化合物的深夜点心(Late Evening Snack,LES)和夜间补充葡萄糖能避免较慢的胃排空,降低活跃的脂肪和蛋白质代谢,改善氮平衡。相比普通食物,Aoyama等[18]报道包含BCAA的营养素混合物效果更好,且能改善肝硬化患者的血清白蛋白水平和葡萄糖耐受性。一项针对14项试验的荟萃分析显示,LES可以显著改善肝硬化患者营养不良和异常代谢状态[19]。
5.2 能量和蛋白质需求
①代偿期肝硬化
代偿期肝硬化患者的能量需求类似于健康人群。根据估计的干重计算,约为 25~35 kcal/(kg·d)[20]。 肝硬化患者葡萄糖代谢紊乱,往往会有葡萄糖耐受不良或糖尿病,能量摄入要因血糖而宜。代偿期肝硬化没有蛋白质的限制[12]。相反,因为肝硬化患者存在糖异生、肌肉分解增加和吸收减少,ESPEN指南(2006)建议应保证1.2~1.5 g/(kg·d)[12],高于健康个体的推荐摄入量。
②失代偿期肝硬化
失代偿期肝硬化患者的能量与蛋白质摄入变得复杂而有挑战。终末期肝硬化患者即使短期禁食,也可引起低血糖,严重可危及生命。由于腹水、门静脉高压、低蛋白血症的存在,应使用理想体重或者干重来计算能量和蛋白质需求量[8]。除了采用公斤体重和通用能量预测公式计算,在有条件的情况下,应采用间接能量测定法测量静态热量消耗(Resting Energy Expenditure,REE)值,以 1.3倍REE提供能量,但现阶段多数医院未有该技术。
失代偿期未发生肝性脑病的患者,应避免限制蛋白质摄入。研究表明状态稳定的肝脏疾病患者可以耐受标准蛋白质含量的天然混合饮食,高蛋白饮食并不会促成肝性脑病[21]。对于已患有肝性脑病的肝硬化患者,国际肝性脑病和氮代谢协会共识(2013)认为他们的需求与肝硬化患者推荐的需求量差别不大,建议能量摄入 35~40 kcal/(kg·d),蛋白质摄入 1.2~1.5 g/kg(kg·d)[14]。植物蛋白因其含有的支链氨基酸(鸟氨酸和精氨酸)较多,能更好地被肌肉利用,且患者对其耐受性相对动物蛋白更好。共识推荐每天可以摄入 30 g~40 g植物蛋白[14]。
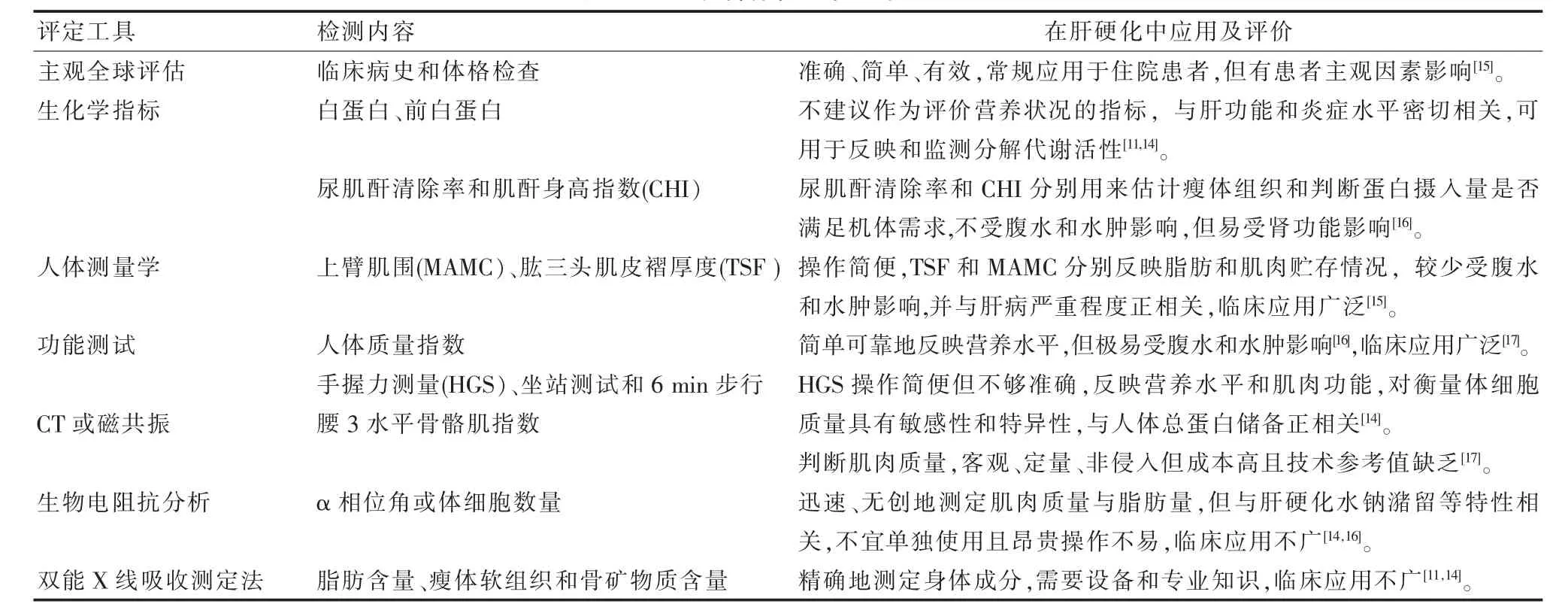
表1 肝硬化营养状态常用的评定工具
5.3 BCAA
BCAA包括缬氨酸、亮氨酸和异亮氨酸。肝硬化患者血浆中的BCAA水平降低会增加肌肉蛋白质的分解、减少白蛋白合成,在肝性脑病和恶病质的发病机制中有重要作用[22]。许多研究表明其可改善患者的临床症状和体征[23-24]。一项299例患者的前瞻性多中心研究指出补充BCAA降低了肝细胞癌的风险并延长了肝硬化患者的生存期[25]。欧美指南多推荐BCAA应用于肝硬化肝性脑病患者[8]。但Cochrane协作组对16项RCT试验的荟萃分析指出:有益效果的前提是排除肝性脑病一线用药的试验[24]。而在接受了一线药物治疗的患者中,尚未发现BCAA能改善患者昏迷等级或精神状态的证据[8]。
在BCAA的使用时机和配方上做出调整或许能使肝硬化患者更加获益。研究显示,在代偿期肝硬化中,BCAA可以提高白蛋白水平,患者血清白蛋白水平高于3.5 g/dL有更好的预后[26]。而在失代偿期,BCAA复合物会有效。其能增加肌肉质量、不会增加氨或血糖水平,不会促进肝性脑病的发展[27]。在日本,BCAA颗粒(不含碳水化合物或脂肪)和BCAA富集剂分别用于低蛋白血症和摄入不良的肝硬化患者[26]。
目前对BCAA是否应该进一步为肝硬化患者常规使用尚有争议。除了有限的临床效益,这也可能与BCAA专业配方的价格较高、口感不佳和副作用等有关[20]。Ney等[29]作者更是在其肠内营养对于肝硬化的荟萃分析中排除了BCAA,认为因其潜在独特的生理特性,不应该常规应用。HoleEk M等[22]作者指出BCAA的有利作用可能与几种不良影响有关如增加谷氨酰胺含量并激活其分解、改变脑中的谷氨酸能神经传递和增加猝倒症风险等。
最近研究表明BCAA在调节葡萄糖、脂肪和蛋白质平衡、肠道健康、免疫功能等方面还具有潜在效益[28],但目前大多还处于基础研究阶段。因而现有研究不足以倡导肝硬化患者广泛使用BCAA,提高其对肝硬化的治疗效果需要更多高质量的临床研究。
5.4 脂肪需求
肝硬化患者脂肪摄入量以占总能量摄入的20%~25%为宜。当患者存在脂肪吸收不良和脂肪泻时,可加入中链甘油三酸酯进行补充。其具有迅速供能、代谢快和不需辅助消化的胆汁盐等物质的特点,因而更适合肝硬化患者。
5.5 微量营养素
微量营养素的缺乏在肝硬化患者中很常见,如脂溶性维生素、锌、硒等。及时补充不仅有助于避免相关缺乏症,同时可能帮助改善肝硬化及其并发症的发展。早期补充维生素D除了能预防骨质疏松,研究指出其能增强肝硬化和腹水患者对自发性细菌性腹膜炎的免疫防御能力[30]。一项研究发现在患有肝性脑病的病毒性肝硬化患者中,补锌可能会改善临床结果[31]。同时锌也有助于降低血清铜的水平,减少铜过量对于肝脏的损害。硒能通过抑制氧化应激和抗纤维化,对肝脏起到保护作用。一项随机对照试验发现现由于严重肝硬化会损害硒代蛋氨酸代谢,因而相比补充硒代蛋氨酸,补充硒酸盐的临床结果更好[31]。
5.6 益生菌、益生元和合生元
益生菌、益生元和合生元是微生态制剂,可调节肠道的菌群结构、改善肠粘膜屏障和局部免疫功能,对减少肝硬化患者氨的生成、防止细菌移位,减少内毒素血症等有一定作用,从而更好地保护肝脏的整体健康。
益生元能选择性刺激肠道内特定微生物的生长和活性,有益于机体健康,是不可被消化的添加剂成分。其中乳果糖是肝性脑病发作的一线用药,能酸化肠内容物并促进氨在肠道细菌代谢中的利用。多项研究显示口服乳果糖可改善肝硬化轻微肝性脑病患者认知功能,一项多中心观察性研究发现使用乳果糖可以提高最小肝性脑病肝硬化患者神经认知评分,并且导致细菌DNA转位减少[33]。但乳果糖也有不良反应如容易导致腹胀、腹泻。
益生菌能够降低血氨水平,改善轻微肝性脑病和预防显性肝性脑病,降低严重不良事件,但荟萃分析显示对死亡率没有影响[34-35]。与乳果糖相比,多数分析认为两者疗效相似[34,36],但益生菌的耐受性相对更好,不良事件较少[37-38]。在此情况下,有学者认为益生菌更安全,更适合长期使用,可能是治疗轻微肝性脑病更好的选择[39]。但就目前而言,益生菌的临床应用不足,且关于使用的最佳剂量、组合与肝硬化药物的相互作用等目前尚不清楚,需进一步探索。
目前临床最常使用的益生菌是VSL#3(一种益生菌合剂,包括4种乳杆菌属、3种双歧杆菌属和一种链球菌属)。一项130例随机对照试验表明,长期服用VSL#3显著降低了因肝性脑病入院的风险以及Child-Pugh分级和MELD评分,并没有不良事件发生[40]。世界胃肠病学组织(WGO)全球指南(2017)[41]和耶鲁/哈佛研讨会:益生菌的应用(2015)共识[42]均推荐VSL#3用于肝性脑病防治。Douillard等[43]研究发现VSL#3产品中菌株的个体基因组表征,确定了其编码能力以及已鉴定的潜在益生菌功能。
合生元是益生元和益生菌的组合补充剂,对于肝性脑病的临床治疗效果仍不确定。有报道认为合生元对于肝硬化患者可能具有良好效益,甚至优于乳果糖[44]。
总之,虽然益生菌和益生元在临床的最佳使用效果还需进一步研究,但联合其他营养素应用于肝硬化肝性脑病患者,证明是安全有效的,可视为潜在的肝性脑病良好的替代疗法。
6 合并肌肉减少症
肌肉减少症是一种以骨骼肌肌量和强度逐渐广泛地丧失为特征,伴有不良后果风险的综合征。肌肉减少症是肝硬化重要的隐性并发症之一,常被忽视。它被认为是肝硬化患者进行肝移植不良后果的主要原因。它的患病率平均为48.1%,且亚洲患者相比西方具有更高的死亡率[44]。因而需要重视肝硬化患者肌肉减少症的筛查与治疗。
肌肉减少症尚没有明确的治疗方法,目前临床大多数治疗都集中在治疗氨基酸的不平衡。足量的能量和蛋白质摄入已被广泛推荐并证明是可靠和有益的。一些研究显示应用肠内营养的肝硬化患者肌肉质量参数有了变化。同时,通过夜间加餐和少食多餐的方式能够缩短肝硬化禁食时间,减少肌肉蛋白质水解。BCAA除了作为蛋白质合成的底物外,还能为肌肉提供能量来源[46]。Tsien等[47]报道富含亮氨酸的BCAA混合物能够逆转肝硬化患者肌肉生长抑制素下游骨骼肌中的分子紊乱,减少肌肉生长抑制素合成。
7 小结
营养不良是一个日益严重的问题,特别是在终末期肝硬化患者中。肌肉减少症是营养不良的主要组成部分,是预后不良的独立预测因子。肠内营养能够帮助改善肝硬化患者蛋白质-能量营养不良和肌肉质量。因而早期识别营养不良及时进行营养干预有重要意义。由于肝脏的特殊性,营养评定工具的准确性常常受到影响,需要临床医生根据实际情况结合多学科判定。针对肝硬化分期供给能量和营养素,白天均衡的少食多餐和晚上摄入富含碳水化合物和添加BCAA的LES,是目前比较好的饮食方式。除了传统的宏观和微量营养素支持,支链氨基酸、益生菌、合生元等加入肠内营养对于改善营养状况和并发症也具有一定作用,值得进一步研究。

