橙皮素通过抑制钙超载减轻低氧/复氧诱导的心肌H9c2细胞凋亡*
曾先燕,张妞妞,吉晔楠,王文丽,贺忠梅
(山西医科大学生理学系,细胞生理学教育部重点实验室,山西 太原 030001)
缺血性心脏病(ischemic heart disease)是患病率与死亡率很高的一种疾病,心脏再灌注是目前主要的治疗手段[1]。但在血流恢复过程中会使组织和器官的损伤加重,甚至危及生命,故将这种损伤称为缺血再灌注损伤(ischemia/reperfusion injury,I/RI)[2]。I/RI有多种机制,比如大量自由基产生、早期炎症细胞因子释放、钙超载以及线粒体功能障碍等,其中钙超载是导致细胞不可逆损伤的重要因素[3]。越来越多的流行病学研究报告指出,富含草药、水果和香料的饮食可以降低心血管疾病的风险[4]。橙皮素(hesperetin, HES)来源于芸香科柑橘类植物果实,它的主要药效成分是生物黄烷酮类,是橙皮苷的活性代谢产物,其生物学活性包括抗炎、抗肿瘤、抗过敏和抗氧化等[5]。近几年研究表明,橙皮素对视网膜、脑及其它器官的缺血再灌注损伤有保护效应[6]。我们的前期研究发现,橙皮素能减轻H2O2诱导的心肌 H9c2细胞氧化损伤[7],而橙皮素预处理对低氧/复氧(hypoxia/reoxygenation,H/R)诱导的心肌 H9c2细胞凋亡是否有影响尚不清楚。本文研究的主要目的是观察橙皮素对H/R诱导细胞凋亡的作用并探讨其可能的机制。
材 料 和 方 法
1 实验材料
大鼠心肌H9c2细胞购自上海生命科学院。胎牛血清购自BI;高糖DMEM培养基购自HyClone;100×青霉素-链霉素溶液和0.25%胰蛋白酶均购自武汉博士德生物工程有限公司;橙皮素和尼莫地平(nimodipine, Nim)均购自Sigma;Annexin V-FITC/PI细胞凋亡检测试剂盒、Ca2+GPCR分析-钙离子指示探针和JC-1试剂盒均购自江苏凯基生物技术股份有限公司;Ca2+-ATP酶ELISA试剂盒购自上海江莱生物科技有限公司;蛋白酶抑制剂PMSF、凝胶配制试剂盒和超敏ECL化学发光试剂盒均购自北京索莱宝科技有限公司;线粒体分离试剂、ATP检测试剂盒和RIPA裂解液均购自上海碧云天生物技术有限公司;0.45 μm PVDF膜购自Millipore;辣根过氧化物酶标记的羊抗鼠IgG、辣根过氧化物酶标记的羊兔IgG和抗β-actin抗体均购自北京中杉金桥生物有限公司;抗电压依赖性阴离子通道(voltage-dependent anion channel, VDAC)抗体购自CST;抗Bcl-2、Bax和细胞色素C(cytochrome C, Cyt-C)抗体均购自Abcam。
2 主要方法
2.1采用CCK-8法与乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒分别检测细胞的活力与坏死情况 细胞密度大约为5.0×106/L接种于96孔板,低氧12 h,复氧0 h、3 h、6 h、9 h、12 h和24 h,每组设6个平行孔,根据CCK-8试剂盒测定的细胞存活率,选择最佳的低氧/复氧时点;在低氧/复氧时点进行不同浓度(6、12、25、50和100 μmol/L)的橙皮素预处理4 h;同理根据CCK-8法和LDH测定的细胞活力和坏死情况,确定橙皮素最佳浓度。
2.2实验分组 细胞实验分为常氧对照(control)组、H/R组、HES+H/R组、Nim+H/R组和HES组。在6孔板里培养心肌H9c2细胞,待细胞长至80%左右时进行实验处理,橙皮素组培养液中含橙皮素浓度25 μmol/L,预处理4 h;10 μmol/L尼莫地平预处理1 h;正常对照组置于37 ℃、5% CO2的孵箱培养15 h;低氧/复氧组换成低糖培养基后置于37 ℃、1% O2、99% N2的低氧孵箱培养12 h,再次换液成10%胎牛血清高糖DMEM培养,复氧置于37 ℃、5% CO2、95%空气的孵箱培养3 h。
2.3Caspase-3活性与ATP水平的检测 正常状态下caspase-3没有活性,在胞浆中以酶原形式存在,而在细胞凋亡时caspase-3被激活;活化状态的caspase-3由2个大亚基及2个小亚基组成,引起胞核底物降解,最终导致细胞凋亡。将样本从-80 ℃取出,按照说明书比例加入裂解液,冰上裂解30 min,在4 ℃、12 000 r/min离心20 min,吸取上清液到新的EP管,按照试剂盒说明书步骤,通过A诱导剂/A阴性对照的倍数来确定caspase-3活化的程度;细胞处理好后,根据试剂盒说明书进行操作裂解并离心,取上清液,通过酶标仪检测吸光度(A)值,BCA法测定各组蛋白浓度,进而检测细胞内各组ATP水平。
2.4线粒体与胞浆蛋白的分离 细胞造模完成,收集细胞,使用线粒体分离试剂盒说明书进行操作,加入100 μL线粒体分离试剂4 ℃ 离心15 s再加入预冷线粒体分离试剂冰上玻璃匀浆器均匀化30次。匀浆完后在4 ℃、600 ×g离心10 min,去除细胞核和未破裂的细胞。然后上清液收集并离心4 ℃、12 000 ×g离心10 min,获得胞浆(上清液)和线粒体(沉积)部分。得到的线粒体溶解在裂解缓冲液中储存。
2.5ELISA测心肌 H9c2细胞Ca2+-ATP酶含量 细胞收集后用PBS稀释细胞悬液,通过反复冻融,3 000 r/min离心20 min并收集上清,按照说明书进行操作,用酶标仪在450 nm波长下测出心肌 H9c2细胞Ca2+-ATP酶含量。
2.6Fluo-3AM染色 细胞接种于6孔板里,细胞模型建立完成后按照Ca2+GPCR分析-钙离子指示探针试剂盒说明书操作,配制Fluo-3AM稀释液浓度为10 μmol/L,每孔加入1 mL染液,在37 ℃避光孵育40 min,之后去掉染液,PBS漂洗2次,采用荧光显微镜进行荧光图像采集。
2.7流式细胞术检测细胞凋亡、钙离子的荧光强度及线粒体膜电位 细胞处理后去掉培养液,加入不含EDTA胰蛋白酶消化细胞,800 r/min离心5 min并收集细胞,PBS洗3次,加入200 μL Binding Buf-fer,之后再加入5 μL AnnexinV-FITC与5 μL碘化丙啶(propidium iodide,PI)混匀,室温避光20 min,混匀后使用流式细胞术进行检测;在细胞处理后去掉培养液,采用Fluo-3AM进行染色,在37 ℃下避光孵育40 min,再加入不含EDTA胰蛋白酶消化细胞,转速800 r/min离心5 min收集细胞,使用流式细胞术检测Ca2+的荧光强度值;细胞处理后收集细胞,按试剂盒说明书配比例加入JC-1试剂混合液400 μL 37 ℃烘箱避光30 min,1 000 r/min离心5 min去掉上清加入200 μL buffer重悬细胞,上机进行检测。
2.8Western blot分析 从-80 ℃取出样本,加入RIPA裂解液(含PMSF)提取总蛋白,BCA法测蛋白浓度,取等质量蛋白进行SDS-PAGE分离,电泳结束后将蛋白半干转印至PVDF膜上,用5%脱脂奶粉封闭2 h,Ⅰ 抗4 ℃过夜孵育(Bcl-2 1∶1 000、Bax 1∶1 000、Cyt-C 1∶200、β-actin 1∶2 000、VDAC 1∶1 000稀释),Ⅱ 抗(1∶2 000稀释)室温孵育2 h,洗脱后用超敏ECL发光液显色,使用UVP凝胶成像系统获取图像,ImageJ软件分析条带的灰度值,则目的蛋白灰度值与内参照蛋白灰度值的比值表示蛋白的相对表达量。
3 统计学处理
采用SPSS 22.0软件对数据进行统计分析,采用GraphPad Prism 6.0软件进行作图。数据用均数±标准误(mean±SEM)表示。多组资料比较采用单因素方差分析(one-way ANOVA),组间两两比较多采用SKN-q法。以P<0.05为差异有统计学意义。
结 果
1 心肌 H9c2细胞低氧/复氧模型的建立与橙皮素最佳浓度确定
与control组相比,低氧12 h/复氧3 h细胞相对活力下降到50%左右(P<0.05),见图1A。给予不同浓度橙皮素0、6、12、25、50和100 μmol/L预处理心肌H9c2细胞,与0 μmol/L相比,25 μmol/L的HES可使H/R后的细胞活力显著升高,LDH释放显著降低(P<0.05),见图1B、C。因此,以低氧12 h/复氧3 h和橙皮素浓度25 μmol/L作为最佳条件进行后续实验。
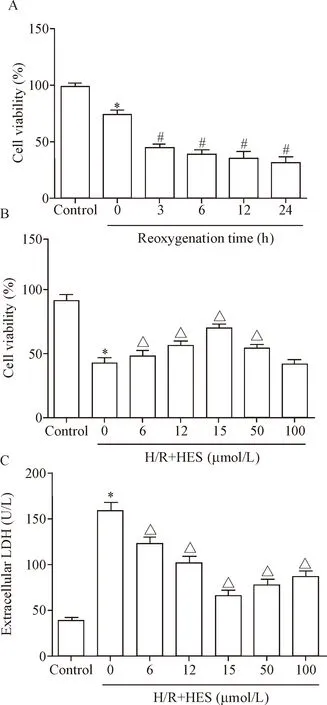
Figure 1.Optimal time point and HES concentration for H/R in the H9c2 cells. A: the viability of H9c2 cells was measured by CCK-8 assay at different reoxgenation time points; B and C: the effects of pretreatment with different doses of HES on H/R-induced cell viability (detected by CCK-8 assay) and cell death (detected by extracellular LDH assay). Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vs0 h;△P<0.05vs0 μmol/L.
图1 低氧复氧最佳时点与橙皮素最佳浓度的确定
2 橙皮素减轻H/R诱导心肌 H9c2细胞凋亡
Hoechst 33258染色与流式细胞术结果显示,与control组相比,H/R组明亮的蓝色细胞核明显增加,无论早期细胞凋亡率还是晚期细胞凋亡率均明显升高;而与H/R组比,HES+H/R组明亮蓝色的细胞核减少,凋亡率明显降低(P<0.05),见图2A、2B。此外,caspase-3活性检测结果发现,与control组相比,H/R组的caspase-3活性明显增加;给予橙皮素预处理后caspase-3活性显著降低(P<0.05),见图2C。这些结果表明橙皮素可减少H/R后的心肌H9c2细胞凋亡。
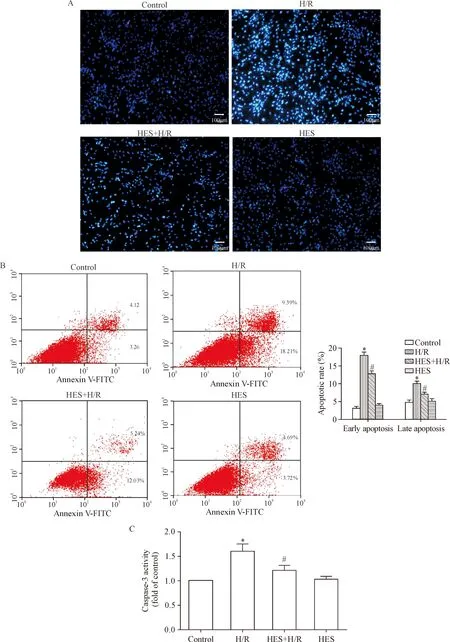
Figure 2.The effects of HES on H/R-induced apoptosis of the H9c2 cells. A and B: the apoptosis was detected by Hoechst 33258 staining (scale bar=100 μm) and flow cytometry; C: the caspase-3 activity was assayed. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsH/R group.
图2 橙皮素对低氧/复氧诱导心肌 H9c2细胞凋亡的影响
3 橙皮素可抑制低H/R诱导的心肌 H9c2细胞钙离子超载
采用细胞内Ca2+GPCR分析-钙离子指示探针检测,Fluo-3AM孵育后用荧光显微镜与流式细胞术观察心肌细胞内钙离子荧光强度变化。结果显示,与control组相比,H/R组细胞内钙离子荧光强度显著增强;相比H/R组,HES+H/R组细胞内钙离子强度降低,见图3A。流式细胞术结果分析,与control组相比,H/R组钙离子荧光强度值明显增加(P<0.05), HES+H/R组细胞内钙离子荧光强度值较H/R组降低(P<0.05),见图3B。以上结果表明橙皮素通过降低钙超载减少H/R后的心肌 H9c2细胞凋亡。

Figure 3.HES decreased H/R-induced calcium overload in the H9c2 cells. Intracellular Ca2+was measured by Fluo3-AM staining, and the fluorescence intensity was analyzed by fluorescence microscopy (A) and flow cytometry (B). The scale bar=100 μm. Mean±SEM.n=5.*P<0.05vscontrol group;#P<0.05vsH/R group.
图3 橙皮素降低低氧/复氧诱导心肌 H9c2细胞钙离子超载
4 橙皮素提高H/R诱导的心肌 H9c2细胞Ca2+-ATP酶活性
胞质内钙的排出是由细胞膜或者肌质网及线粒体膜上Ca2+-ATP酶来完成,因此我们检测Ca2+-ATP酶活性。ELISA结果显示,与control组相比,H/R组细胞膜Ca2+-ATP酶活性明显降低(P<0.05);与H/R组相比,给予橙皮素预处理后细胞膜Ca2+-ATP酶活性显著得以恢复(P<0.05),见图4。
5 橙皮素能逆转H/R诱导心肌 H9c2细胞线粒体功能障碍
我们通过测定线粒体膜电位及ATP含量以反映线粒体功能。JC-1染色后行流式细胞术检测,正常细胞位于R2门框外,居R2门框内的橙红色细胞代表发生凋亡的细胞,细胞下移数量可反映线粒体膜电位下降水平。结果显示与control组比,H/R组R2门框中橙红色荧光细胞数明显增加(P<0.05);与H/R组相比,HES+H/R组R2门框中橙红色荧光细胞数减少(P<0.05);给予钙离子拮抗剂尼莫地平(Nim)后,R2门框中橙红色荧光细胞数则较H/R组有所减少(P<0.05),见图5A。ATP含量测定结果显示:与control组相比,H/R组心肌 H9c2 细胞内ATP水平明显下降(P<0.05);与H/R组比,HES+H/R组与Nim+H/R组则增加细胞内的ATP水平(P<0.05),见图5B。以上结果表明橙皮素减轻H/R后的细胞凋亡,并与抑制钙超载从而改善线粒体功能障碍有关。
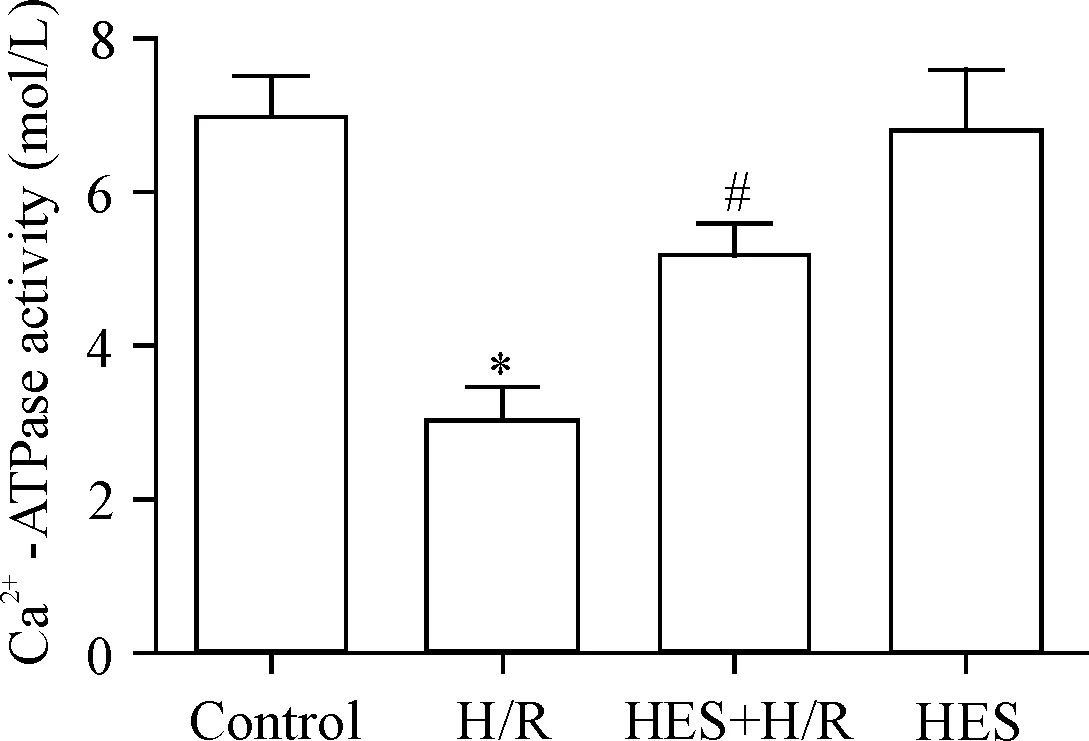
Figure 4.HES elevated H/R-induced calcium-ATPase activity. The Ca2+-ATPase activity was analyzed by ELISA assay. Mean±SEM.n=5.*P<0.05vscontrol group;#P<0.05vsH/R group.
图4 橙皮素升高低氧/复氧诱导心肌 H9c2细胞Ca2+-ATP酶活性
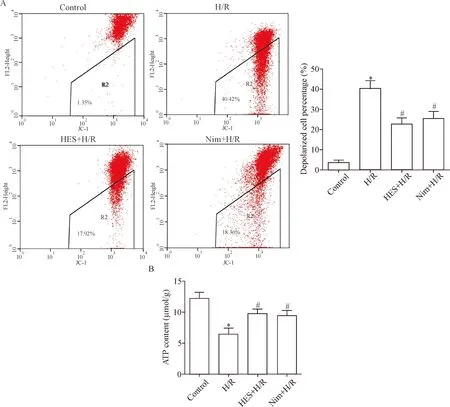
Figure 5.HES and Nim improved H/R-induced mitochondria function. A: mitochondrial transmembrane potential was analyzed by flow cytometry; B: the level of ATP was measured by microplate reader. Mean±SEM.n=4.*P<0.05vscontrol group;#P<0.05vsH/R group.
图5 橙皮素与尼莫地平改善低氧/复氧诱导的线粒体功能
6 橙皮素能逆转H/R诱导的心肌 H9c2细胞线粒体凋亡相关蛋白表达增加
利用Western blot法检测线粒体蛋白Bcl-2、Bax和Cyt-C的表达情况,结果显示,与control组相比,H/R组Bcl-2/Bax比值明显下降,胞浆Cyt-C蛋白表达明显升高(P<0.05);与H/R组相比,HES+H/R组与Nim+H/R组均明显上调Bcl-2/Bax比值,同时胞浆Cyt-C蛋白表达水平明显下调(P<0.05),见图6。该结果表明橙皮素与尼莫地平预处理能降低线粒体凋亡相关蛋白的表达。
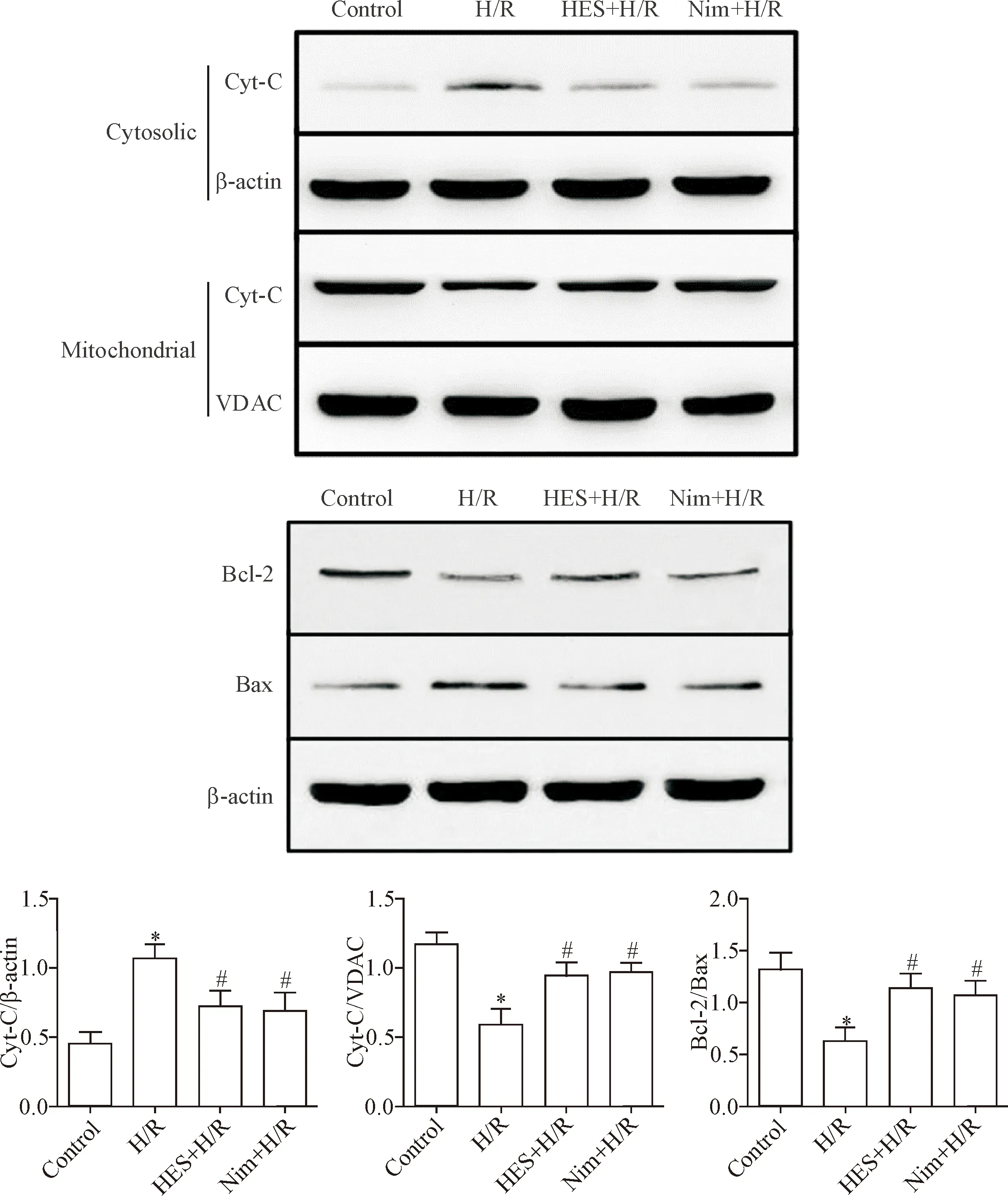
Figure 6.HES and Nim inhibited the expression of mitochondrial apoptosis-related proteins. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsH/R group.
图6 橙皮素和尼莫地平抑制线粒体凋亡通路相关蛋白表达
讨 论
细胞凋亡是缺血性心脏病重要的病理改变。心肌缺血再灌注损伤中心肌细胞凋亡与钙超载密切相关,再灌注时,心肌细胞膜上Ca2+-ATP酶活性下降导致胞浆内Ca2+明显升高,引起钙超载[8]。Ca2+是细胞内重要的第二信使,不仅可激活磷脂酶使细胞及细胞器的生物膜结构破坏,而且能够降解膜磷脂生成花生四烯酸和溶血卵磷脂,加重细胞功能紊乱,激活蛋白酶促进结构蛋白的分解[9]。研究表明银杏叶其成分为黄酮苷类,其作用是抑制慢钙通道缩短APD50和APD90,缩短有效不应期,发挥抗心律失常的作用[10]。橙皮素其主要成分为黄烷酮类,本研究结果显示橙皮素对H/R诱导细胞内钙离子超载有抑制作用,并增加心肌细胞膜Ca2+-ATP酶活性从而改善细胞凋亡。
线粒体是细胞的能量工厂,文献报道心肌缺血再灌注会引起心肌细胞内钙超载,导致线粒体功能障碍,从而引起心肌细胞能量减少[9]。线粒体膜电位降低启动细胞凋亡的级联反应,是细胞凋亡的一个早期特征[11]。本实验对线粒体膜电位及ATP进行检测发现橙皮素逆转H/R诱导线粒体膜电位下降并提升ATP,同时给予钙离子拮抗剂尼莫地平同样可逆转H/R后的心肌细胞线粒体膜电位降低。以上结果说明橙皮素是通过降低钙超载而改善线粒体功能的。有研究表明,橙皮素通过减轻JNK-Bax线粒体凋亡途径,发挥对脂多糖诱导心肌H9c2 细胞的保护作用[12]。当细胞凋亡时,线粒体结构会发生一些明显变化,例如线粒体凋亡蛋白Cyt-C等释放于胞浆内,线粒体凋亡途径中凋亡分子的关键调节因子Bcl-2家族包括许多抗凋亡蛋白(例如Bcl-2、Bcl-xL和Bcl-w)及某些促凋亡蛋白(例如Bax、Bak和Bid)被激活表达[13-14],本实验结果发现橙皮素上调Bcl-2/Bax比值及减少线粒体Cyt-C释放到胞浆。
综上所述,本实验通过建立心肌 H9c2细胞低氧/复氧模型,观察橙皮素对细胞凋亡的影响。结果显示橙皮素可明显减少H/R后的心肌 H9c2 细胞凋亡率,同时对胞内钙离子超载有抑制作用,可改善线粒体功能及降低线粒体凋亡相关蛋白表达;给予钙离子拮抗剂尼莫地平,同样减轻H/R诱导的线粒体功能障碍。可见橙皮素减少H/R诱导的心肌 H9c2细胞凋亡与降低钙离子超载从而改善线粒体功能有关。本研究为冠心病术后并发症治疗提供新的方向。由于Ca2+调控是一个复杂的过程,完全阐释橙皮素对Ca2+超载的作用,还需进一步探究其具体的通路和上下游关系。

