卵巢癌顺铂敏感与耐药细胞ClC-3蛋白表达及通道功能的差异*
封洁珠, 李恩泽, 彭子瀚, 裴一飞, 朱林燕△, 高绿芬
(暨南大学1基础医学院药理学系,2附属第一医院妇产科,广东 广州 510632)
卵巢癌是女性生殖器官常见的恶性肿瘤之一,其中卵巢上皮癌死亡率占各类妇科肿瘤的首位,其5年存活率仅为44%,对女性生命造成严重威胁[1]。手术联合化疗是卵巢恶性肿瘤的主要治疗手段[2-4]。约60%~80%的晚期卵巢上皮癌的患者对顺铂(cisplatin, CIS)加紫杉醇联合化疗敏感,可达到完全临床缓解,但是部分患者在化疗过程中出现对顺铂敏感性降低而导致复发,此外约22.8%患者表现为原发性耐药[5-7]。卵巢癌对化疗药物的耐受是其预后差的重要原因。因而,卵巢癌对顺铂耐药的机制及如何逆转耐药仍是当前卵巢癌基础和临床研究的热点。
ClC-3氯通道在多种肿瘤中表达及活性异常,从而影响着肿瘤细胞的增殖、侵袭及转移等恶性生物学行为[8-12]。化疗药物诱导的ClC-3上调激活NF-κB信号通路,导致NF-κB p65核易位,这就提高了多药耐药基因mdr1的转录活性,最终增加了其编码的P-糖蛋白的表达,促进了化疗药物的外排[13]。本课题组发现在卵巢癌紫杉醇耐药细胞中ClC-3氯通道的表达增多、通道功能增强;而在乳腺癌他莫昔芬耐药细胞中,ClC-3氯通道的表达减少、通道功能则降低(数据未发表)。ClC-3氯通道在不同肿瘤和不同化疗药物耐药细胞中如何改变,如何影响肿瘤对化疗药物的敏感性依然存在诸多争议。本项工作从 mRNA、蛋白和通道功能方面研究卵巢癌顺铂敏感细胞a2780和顺铂耐药细胞a2780cp中ClC-3的差异,为深入探讨ClC-3氯通道在卵巢癌细胞耐药中的作用提供参考资料。
材 料 和 方 法
1 细胞株
人卵巢上皮癌细胞株a2780和a2780cp 由Benjamin K. Tsang教授赠予 (Ottawa Hospital Research Institute)。
2 主要试剂
顺铂购自Sigma,纯度≥98%,用DMSO溶解成100 mmol/L的储存液,避光保存于4 ℃;SYBR®Premix Ex TaqTMII (Tli RNaseH Plus)购自TaKaRa;抗ClC-3抗体购自Abcam;山羊抗兔辣根过氧化物酶IgG (H+L) 购自Proteintech;抗GAPDH抗体购自杭州贤至生物有限公司;5-nitro-2-(3-phenylpropylamino) benzoic acid(NPPB) 购自Sigma,用DMSO溶解为100 mmol/L的储存液。
3 主要方法
3.1MTT法检测细胞存活率,计算抑制率 将a2780和a2780cp细胞以每孔6 000个的数量分别种于96孔板中,培养4 h待细胞贴壁后,加入顺铂,浓度按照如下设置(μmol/L):0、1、2、4、8、16、32、64和128。培养48 h后,各孔加入20 μL 5 μmol/L的MTT,37 ℃培养4 h。吸取培养液,各孔加入150 μL DMSO,振荡培养板,于37 ℃孵育10 min,充分溶解结晶物。用酶标仪测定吸光度(A)值,以空白组调零,通过与对照组比较得到实验组细胞的存活率,抑制率(%)=(A对照组-A顺铂组)/A对照组×100%。
3.2Real-time PCR检测ClC氯通道家族mRNA的表达 采用氯仿抽提RNA,上机检测A值与浓度,再根据逆转录试剂盒的要求配制试剂,进行逆转录,设置逆转录反应条件如下:37 ℃ 15 min、85 ℃ 5 s、4 ℃ ∞。将逆转录好的cDNA根据SYBR®Premix Ex TaqTMII试剂盒的要求配制体系,设置反应条件如下:95 ℃ 30 s; 95 ℃ 5 s、60 ℃ 30 s,40个循环;获得熔解曲线,最后根据得出的Ct值计算mRNA的相对表达量。实验中用到的引物序列见表1。

表1 Real-time PCR引物序列
3.3Western blot检测细胞中ClC-3蛋白的表达 将a2780和a2780cp细胞用蛋白裂解液裂解之后,用BCA试剂盒检测蛋白浓度。根据蛋白浓度计算20 μg蛋白的上样量,用10%SDS-PAGE根据分子量大小分离蛋白,将目的蛋白进行切胶并且转移到PVDF膜上,牛奶封闭后,加入ClC-3 Ⅰ抗孵育过夜,洗膜后再加入Ⅱ抗孵育2 h,最后进行显影以及条带灰度值分析。
3.4免疫荧光观察ClC-3氯通道的分布 将a2780和2780cp细胞接种在confocal皿上,a2780细胞长得缓慢且抱团生长,故每个皿约种10×104个细胞,a2780cp细胞生长较快,故每个皿约种8×104个细胞。培养1 d,待细胞单层长到80%时进行处理。经过固定,通透和封闭等一系列处理,采用1∶50的比例用Ⅰ抗稀释液稀释抗体,孵育ClC-3抗体。根据Ⅰ抗的稀释比例,采用1∶100的比例稀释荧光Ⅱ抗对细胞进行染色处理。
3.5全细胞膜片钳技术检测细胞氯电流 降低胰酶浓度消化 a2780和a2780cp细胞,然后吹打为单细胞悬液,滴加在直径 22 mm 的圆形玻片上,37 ℃孵育5 min,然后贴于灌流槽内进行实验。EPC-7 膜片钳放大器在全细胞电压钳制模式下记录全细胞电流,在 0 mV、±40 mV和±80 mV的电压下钳制细胞,脉冲波宽 200 ms,间隔 4 s。用 CED 1401 采集电流和电压信号,用 EPC 软件(CED,Cambridge Electronic Design) 记录并分析实验数据。等渗灌流2~5 min待基础电流稳定,加入5 μmol/L顺铂,待电流达到稳定峰值,加入100 μmol/L NPPB 阻断电流,计算抑制率,抑制率(%)=[(Cmax-Ciso)-(Cblocker-Ciso)]/(Cmax-Ciso)×100%,其中 Ciso是基础电流值,Cmax是顺铂激活的电流最大值,Cblocker是加入阻断剂后的稳定电流值。
3.6细胞转染实验 转染前1天接种细胞约每孔1.5×106个于6孔板中,细胞密度在转染时为90%~95%覆盖率较好。以下以1个孔转染样本为例,配转染液。准备2个EP管,分别各吸取120 μL Opti-MEM 于2个EP管中。使用前先轻轻弹匀Lipofectamine 2000。 取5μL 的ClC-3 siRNA加入Opti-MEM中,最好逐滴加入,用小枪头靠近液面慢慢打出,轻轻吹打混匀,标记为siRNA管。阴性对照(negative control, NC)管操作相同。将以上2管液体分别混匀,室温放置20 min。将该混合液轻轻滴入到需要转染的孔板中,轻轻摇板将其与培养基混匀。将细胞放入孵箱中培养,根据具体转染要求考虑何时更换新的培养基,一般应在6~10 h内进行换液。转染48 h后,采用Western blot检测细胞ClC-3蛋白的表达。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,采用(配对)t检验和方差分析方法检验差异显著性,以P<0.05表示差异有统计学意义。
结 果
1 a2780和a2780cp细胞对顺铂敏感性存在差异
与未加顺铂细胞相比,顺铂作用于a2780,可以明显看到细胞皱缩,细胞数目减少,随着顺铂的作用浓度增加,细胞数量减少明显,形态由原来的多棱形变成椭圆形或者圆形,见图1A;MTT结果显示,顺铂对a2780细胞增殖的抑制率也表现出浓度依赖性,其IC50值为5 μmol/L,而顺铂对a2780cp细胞增殖的抑制率并不明显,其IC50值高达20 μmol/L,与a2780细胞相比显著升高(P<0.01),见图1B。本实验结果确定a2780和a2780cp对顺铂敏感性存在差异。
2 a2780和a2780cp细胞ClC家族mRNA的表达
Real-time PCR结果显示,a2780细胞主要表达ClC-3 mRNA,此外少量表达ClC-2 mRNA,a2780cp细胞也主要表达ClC-3 mRNA以及少量表达ClC-2 mRNA。然而与a2780细胞相比,a2780cp细胞中ClC-3 mRNA表达降低(P<0.01),而ClC-2的mRNA无显著差异,见图2。
3 a2780和a2780cp细胞ClC-3蛋白的表达
Western blot结果显示,与敏感株a2780细胞相比,耐药株细胞a2780cp的ClC-3蛋白表达减少(P<0.01),见图3。
4 a2780和a2780cp细胞ClC-3蛋白的细胞分布
免疫荧光结果显示,卵巢癌a2780和a2780cp细胞的ClC-3在细胞膜、胞质和细胞核内均有分布,但在a2780细胞主要分布在其细胞膜和核上,而在a2780cp细胞中则主要分布在其细胞核,见图4。
5 膜片钳技术检测细胞氯通道功能差异

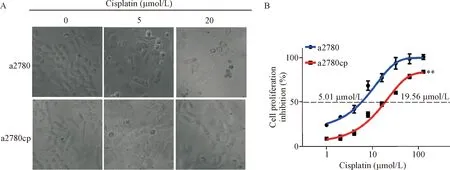
Figure 1.Effects of cisplatin on proliferation of ovarian cancer sensitive cells a2780 and ovarian cancer resistant cells a2780cp. A: optical images of a2780 and a2780cp cells after treating with different concentration cisplatin for 48 h, respectively (×200); B: results of MTT assay. Mean±SD.n=3.**P<0.01vsa2780cp group.
图1 卵巢癌a2780 和a2780cp细胞对顺铂敏感性的差异
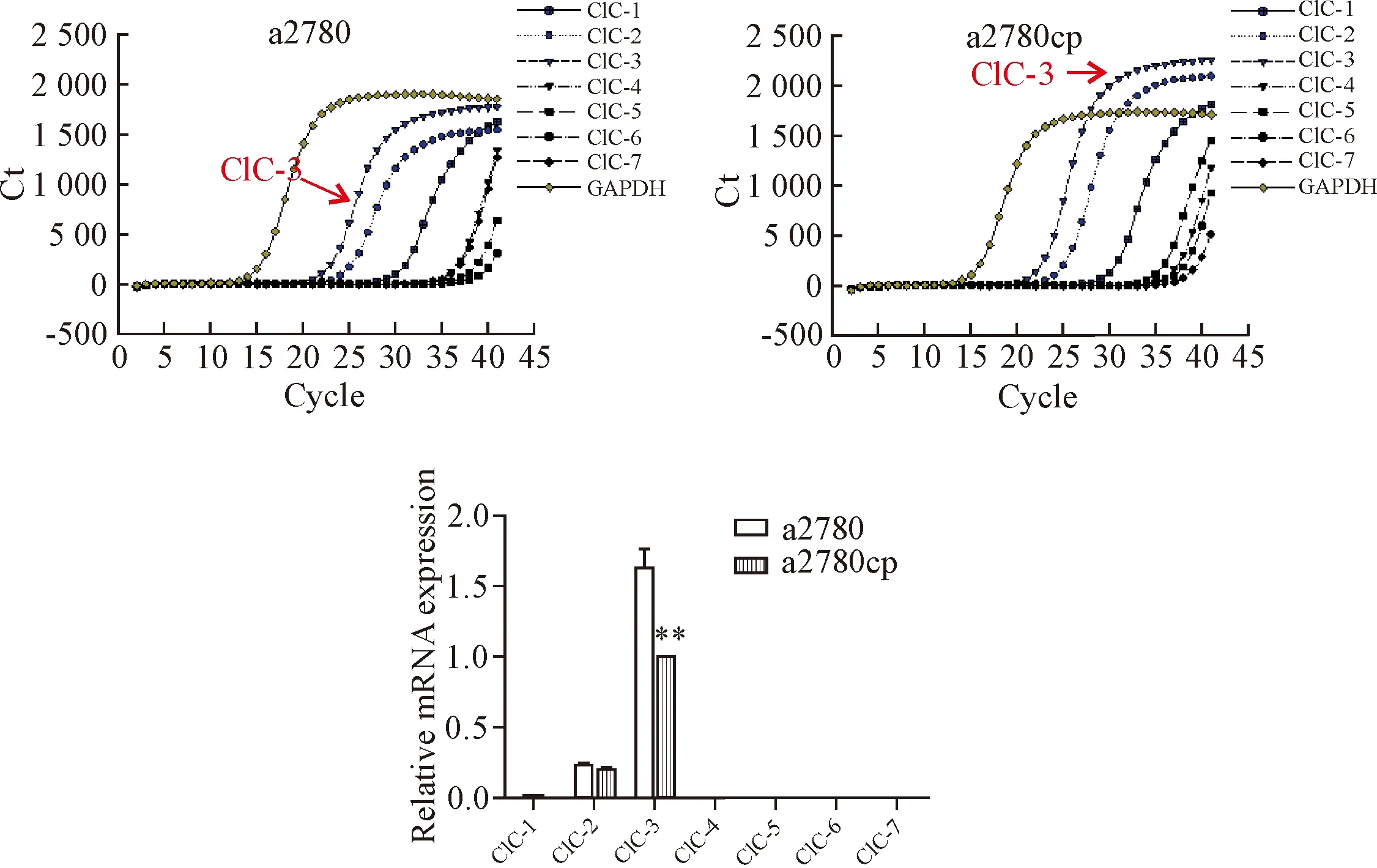
Figure 2.The expression and difference of ClC families in ovarian cancer sensitive cells a2780 and ovarian cancer resistant cells a2780cp by real-time PCR. Mean±SD.n=3.**P<0.01vsa2780 group.
图2 Real-time PCR法定量分析ClC家族在a2780和a2780cp细胞中表达差异
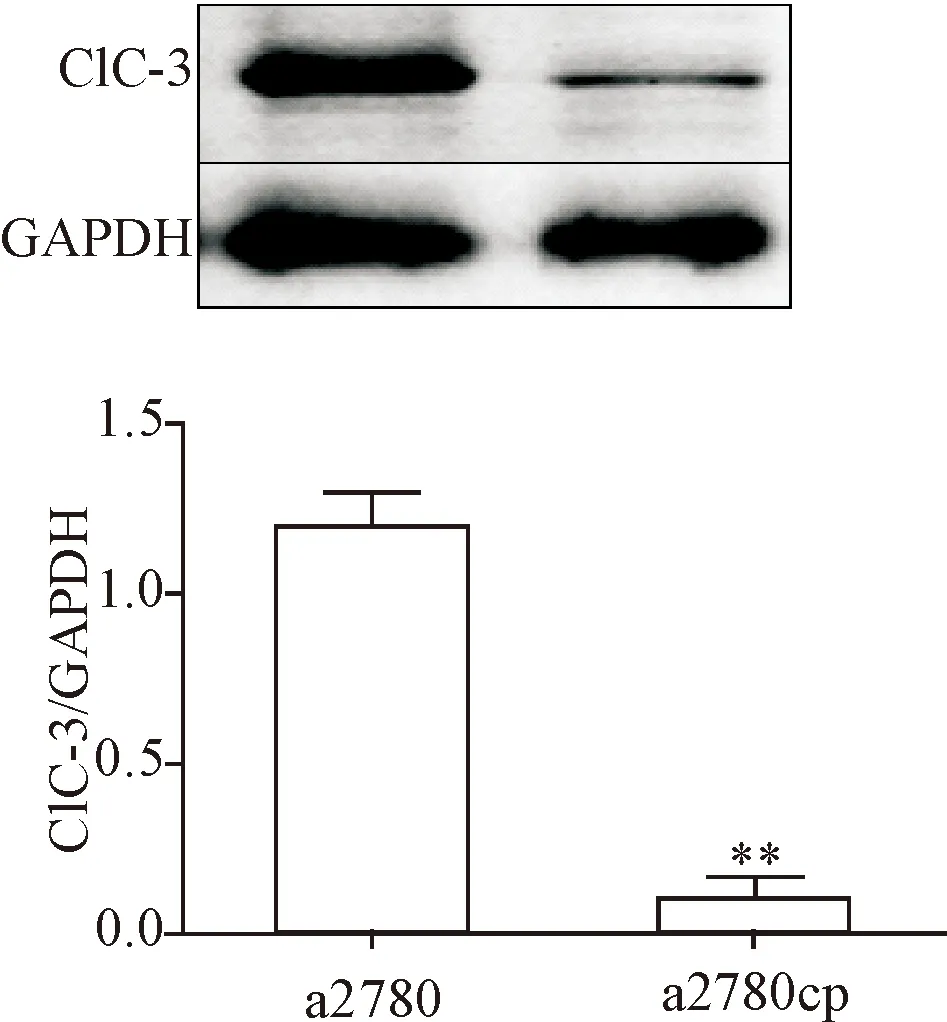
Figure 3.Difference of ClC-3 expression between a2780 and a2780cp cells. Mean±SD.n=4.**P<0.01vsa2780 group.
图3 Western blot测细胞之间ClC-3蛋白表达量的差异
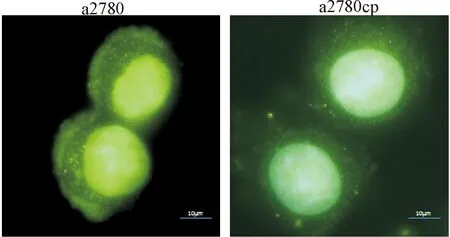
Figure 4.Distribution of ClC-3 in membrane, organelle and nucleus of sensitive and drug-resistant ovarian cancer cells by immunofluorescence assay. ClC-3 protein is labeled by green fluorescent. The scale bar=10 μm.
图4 免疫荧光法观察卵巢癌a2780和a2780cp细胞的ClC-3在膜、细胞器和核的分布情况
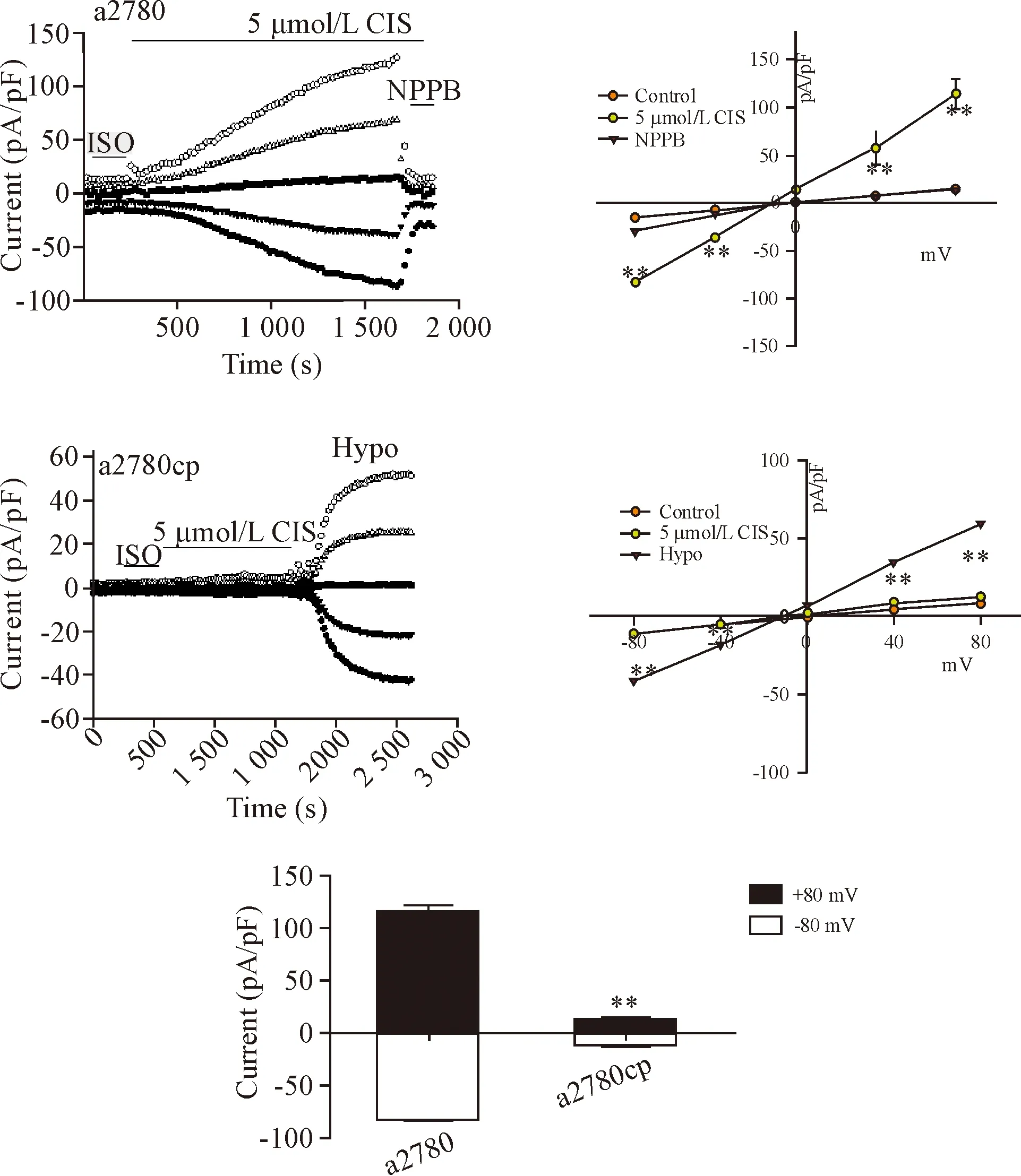
Figure 5.Cisplatin activated Cl-currents in a2780 cells, but can not activated in a2780cp cells. Mean±SD.n=5,**P<0.01vsa2780 group.
图5 膜片钳技术检测细胞氯通道功能差异
而a2780cp细胞在等渗灌流情况下,±80mV电压钳制下背景电流分别为(5.32±1.37)pA/pF和(-5.68±2.03)pA/pF;5 μmol/L顺铂溶液灌流40 min后,电流密度没有增大,但是低渗(Hypo)刺激使电流分别增加到(55.67±4.65)pA/pF和(-45.34±3.78)pA/pF,表明a2780cp细胞的氯通道只是对5 μmol/L的顺铂无反应,见图5。
6 膜片钳技术确定ClC-3氯通道在两者功能差异中起主要作用
Western blot检测确定a2780细胞的ClC-3蛋白表达被成功下调(P<0.01),见图6A。从结果可以看出,在±80 mV的电压钳制下,顺铂仍然能够激活NC siRNA处理的a2780细胞,电流分别为(56.52±4.36) pA/pF 及(-43.16±3.02) pA/pF;然而,ClC-3 siRNA沉默a2780细胞的ClC-3表达后,顺铂则无法激活其氯通道,见图6。
讨 论
卵巢癌是妇科死亡率最高的恶性肿瘤。以铂类为基础的化疗耐药是卵巢癌预后差的重要原因,基础与临床研究在这方面也做了大量的工作,如:(1)药物的进入和排出可能是药物敏感性降低的重要因素之一;(2)也有报道说胞内蛋白的失活是导致顺铂耐药的原因;(3)DNA的修复状态也有可能影响耐药[11-12]。然而卵巢癌顺铂耐药机制复杂,迄今人们对卵巢癌顺铂耐药的机制并未完全了解。
氯通道在多种肿瘤中表达异常,在肿瘤细胞的增殖、侵袭,转移及耐药等恶性生物学行为中起着重要作用[13-16]。我们在对 ClC-3 氯通道的研究中观察到,低分化鼻咽癌细胞 ClC-3 蛋白表达增高,其通道功能对抗肿瘤药物反应更敏感;具有抗肿瘤活性的中药单体大黄素、双氢青蒿素,及最新引起研究者关注的传统抗酗酒药——双硫仑螯合铜等均可快速在3~10 min内激活氯电流、增加 ClC-3 氯通道蛋白的表达; siRNA 干扰ClC-3 蛋白表达则抑制这些药物诱导的肿瘤细胞凋亡[17-20]。然而,在卵巢癌中ClC-3参与抗肿瘤药物的作用机制及其在抗肿瘤药物耐药中的作用国内外尚未见报道。
本研究观察到敏感细胞和耐药细胞在ClC家族的主要表达ClC-3,并且耐药细胞的ClC-3表达减少,紧接着我们还检测到敏感细胞ClC-3主要分布在细胞膜上,而耐药细胞主要分布在胞质和胞核中。然而在Chen等[21]的研究中,肺癌紫杉醇耐药细胞A549T的ClC-3表达高于敏感细胞,这提示ClC-3的差异性表达和分布可能是细胞对顺铂以及其它药物敏感性存在差异的原因,并且ClC-3可能在不同药物的耐药细胞中扮演了不同的角色。为了进一步证明这个问题,我们用顺铂作用于2种细胞,观察顺铂对2种细胞氯通道的影响。有文献报道顺铂能够通过嘌呤受体途径激活鼻咽癌细胞的ClC-3,从而诱导细胞凋亡[20]。在本研究中也观察到顺铂能够激活顺铂敏感细胞的氯通道,而下调敏感细胞ClC-3蛋白的表达,则无法再被顺铂激活,确定顺铂激活的为ClC-3介导的氯电流。同时相同浓度的顺铂是无法激活耐药细胞的。说明2种细胞之间的ClC-3氯通道功能存在差异。有报道分析,在ClC-3高表达的细胞中,化疗药物诱导ClC-3的上调,激活 NF-κB 信号通路并导致 NF-κB的 P65 核转位,从而增强多药耐药基因mdr1的转录活性,最终增加 P-糖蛋白表达并促进化疗药物的外排[13]。而顺铂耐药细胞ClC-3低表达,那么此时ClC-3的作用并非促进药物外排,可能是阻止药物进入细胞,从而引起耐药。根据实验结果推测,顺铂作用于耐药细胞,诱导ClC-3蛋白表达的减少以及细胞膜上ClC-3的构象改变,导致药物与ClC-3的作用靶点发生改变,最后顺铂无法激活细胞的ClC-3氯通道,从而被阻滞于细胞外。通过本文的分析,ClC-3可能是卵巢癌顺铂耐药的重要因素。这为我们进一步研究ClC-3在卵巢癌顺铂耐药中所起到的作用打下坚实的基础。
Figure 6.Cisplatin activated Cl-currents in a2780-NC siRNA cells, but cannot activated in a2780-ClC-3 siRNA cells. A: we successfully down-regulated the expression of a2780 ClC-3 protein in a2780 cells; B: cisplatin could induce Cl-current in a2780-NC siRNA cells as shown with a typical time course, but could not in a2780-ClC-3 siRNA cells. Mean±SD.n=5.**P<0.01vsa2780-NC siRNA group.
图6 膜片钳技术检测细胞氯通道功能差异

